信迪利单抗联合化疗对晚期胃癌疗效及可溶性淋巴细胞活化基因-3、可溶性T细胞免疫球蛋白黏蛋白分子3水平的影响
陈军,周龙

【摘要】目的 探讨信迪利单抗(Sin)联合化疗治疗晚期胃癌的疗效,以及对患者肿瘤标志物与免疫功能指标的影响,为提高晚期胃癌患者治疗效果、改善预后提供有效依据。方法 采用随机数字表法将2022年4月至2023年4月湘潭市中心医院收治的68例晚期胃癌患者分为对照组[34例,使用奥沙利铂+卡培他滨(XELOX)方案化疗治疗]、研究组(34例,在对照组的基础上联合Sin治疗)。两组患者均治疗6个月后评估疗效。对比两组患者治疗6个月后的临床疗效,治疗前与治疗6个月后肿瘤标志物、免疫功能指标,以及治疗期间不良反应发生情况。结果 研究组患者临床疗效与不良反应总发生率均高于对照组,但差异均无统计学意义(均P>0.05);与治疗前比,治疗6个月后两组患者血清糖链抗原125(CA125)、糖链抗原724(CA724)、癌胚抗原(CEA)及可溶性淋巴细胞活化基因-3(sLAG-3)、可溶性T细胞免疫球蛋白黏蛋白分子3(sTim-3)水平均降低,且研究组均低于对照组(均P<0.05)。结论 Sin联合XELOX化疗方案治疗晚期胃癌的效果与安全性均良好,能够更有效降低患者的肿瘤标志物水平,提高患者机体免疫功能。
【关键词】晚期胃癌 ; 信迪利单抗 ; 化疗 ; 肿瘤标志物 ; 免疫功能
【中图分类号】R735.2【文献标识码】A【文章编号】2096-3718.2024.09.0032.03
DOI:10.3969/j.issn.2096-3718.2024.09.011
胃癌是全球范围内常见的恶性肿瘤之一,尽管近年来胃癌的治疗手段不断进步,但晚期胃癌的治疗仍然面临挑战,患者的预后仍然较差。奥沙利铂联合卡培他滨(XELOX)是临床上常用的化疗方案之一,能够抑制肿瘤细胞的增殖和生长,但单一的化疗方案存在耐药与不良反应多等限制[1],因此迫切需要寻找新的治疗策略来改善患者的预后。信迪利单抗(Sin)是一种免疫检查点抑制剂,通过抑制胃癌细胞的生长和扩散,可以有效延长患者的生存期,同时联合化疗药物使用具有协同作用,增强治疗效果,减少肿瘤对单一治疗方式产生的耐药性[2-3]。基于此,本研究选取68例晚期胃癌患者,旨在分析Sin联合XELOX化疗方案的效果,现报道如下。
1 资料与方法
1.1 一般资料 以随机数字表法将2022年4月至2023年4月湘潭市中心医院收治的68例晚期胃癌患者分为两组,各34例。对照组中男、女患者分别为21、13例;年龄44~63岁,平均(55.32±5.13)岁;病程5~21个月,平均(13.15±4.25)个月。研究组中男、女患者分别为20、14例;年龄44~68岁,平均(56.56±5.62)岁;病程4~20个月,平均(13.15±4.31)个月。对比两组一般资料,差异无统计学意义(P>0.05),可比。纳入标准:⑴符合《我国晚期胃癌临床特点及诊治策略》 [4]中的相关标准;⑵预计生存期≥12个月;⑶初次确诊癌症;⑷居住地稳定,能够定期随访。排除标准:⑴对化疗药物不耐受;⑵伴有免疫功能障碍;⑶合并其他肿瘤。研究符合《世界医学协会赫尔辛基宣言》中相关要求,患者或家属均签署知情同意书。
1.2 治疗方法 对照组患者使用XELOX化疗方案治疗,治疗第1天静脉滴注奥沙利铂注射液(四川汇宇制药股份有限公司,国药准字H20213060,规格:10 mL∶50 mg)130 mg/m?,治疗第1~14天口服卡培他滨片(江苏恒瑞有限公司,国药准字H20133365,规格:0.5 g/片)1 000 mg/m?,2次/d,连用14 d,停药7 d,21 d为1个疗程周期。研究组患者同时使用Sin治疗,静脉滴注信迪利单抗注射液[信达生物制药(苏州)有限公司,国药准字S20180016,规格:100 mg(10 mL)/瓶],200 mg/次,1次/周期,21 d为1个治疗周期,用药至疾病进展或毒性患者不耐受,两组患者均治疗观察6个月后评估疗效。
1.3 观察指标 ⑴临床疗效:采用《实体瘤疗效评价标准(RECIST1.1)》 [5]评估患者治疗6个月后的疗效,分为完全缓解(CR):肿瘤病灶完全消失;部分缓解(PR):病灶长径总和缩小≥30%;稳定(SD):病灶长径总和缩小<30%或扩大<20%;疾病进展(PD):病灶长径总和增加≥20%或出现新病灶,临床总有效率=CR率+PR率+SD率。⑵肿瘤标志物水平:于治疗前、治疗6个月后分别采集两组患者空腹静脉血3 mL,经3 500 r/min离心15 min,分离上层血清,使用电化学发光法检测血清糖链抗原125(CA125)、糖链抗原724(CA724)、癌胚抗原(CEA)水平。⑶免疫功能:于治疗前、治疗6个月后分别采集两组患者空腹静脉血3 mL,血清分离方法同⑵,使用酶联免疫吸附法检测血清可溶性淋巴细胞活化基因-3(sLAG-3)、可溶性T细胞免疫球蛋白黏蛋白分子3(sTim-3)水平。⑷不良反应:统计胃肠道反应、甲状腺功能异常、骨髓抑制的发生情况,不良反应总发生率为各项发生率之和。
1.4 统计学方法 采用SPSS 25.0统计学软件分析数据,计数资料以[例(%)]表示,采用χ2检验,等级资料采用秩和检验;计量资料经S-W法检验证实符合正态分布,用( x ±s)表示,组间比较采用独立样本t检验,治疗前后比较采用配对t检验。P<0.05为差异有统计学意义。
2 结果
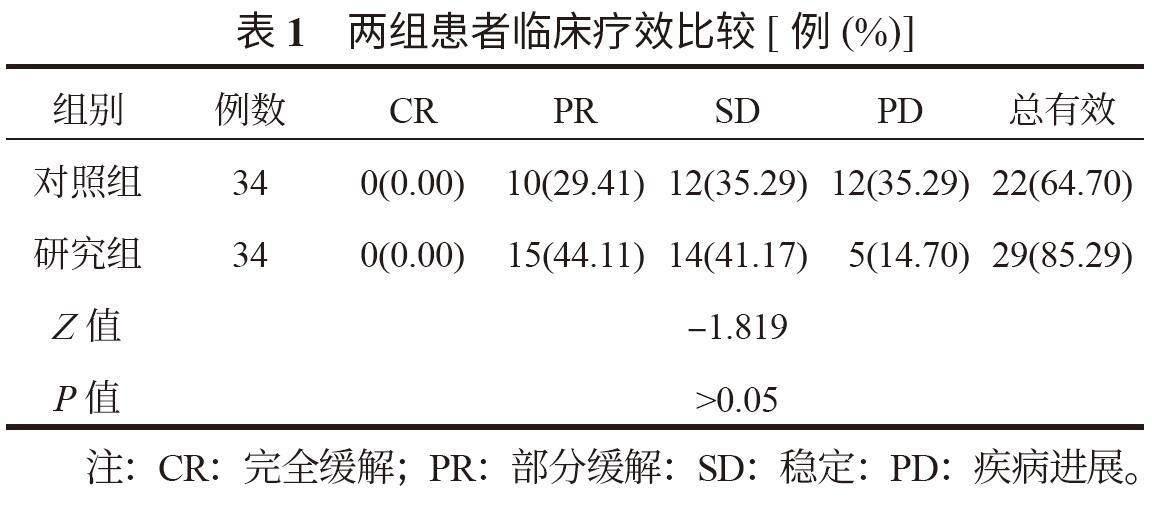
2.1 两组患者临床疗效比较 两组治疗效果比较,差异无统计学意义(P>0.05),见表1。
2.2 两组患者肿瘤标志物水平比较 与治疗前比,治疗6个月后两组肿瘤标志物水平均降低,研究组均低于对照组,差异均有统计学意义(均P<0.05),见表2。
2.3 两组患者免疫功能指标比较 与治疗前比,治疗6个月后两组免疫功能指标均降低,研究组均低于对照组,差异均有统计学意义(均P<0.05),见表3。
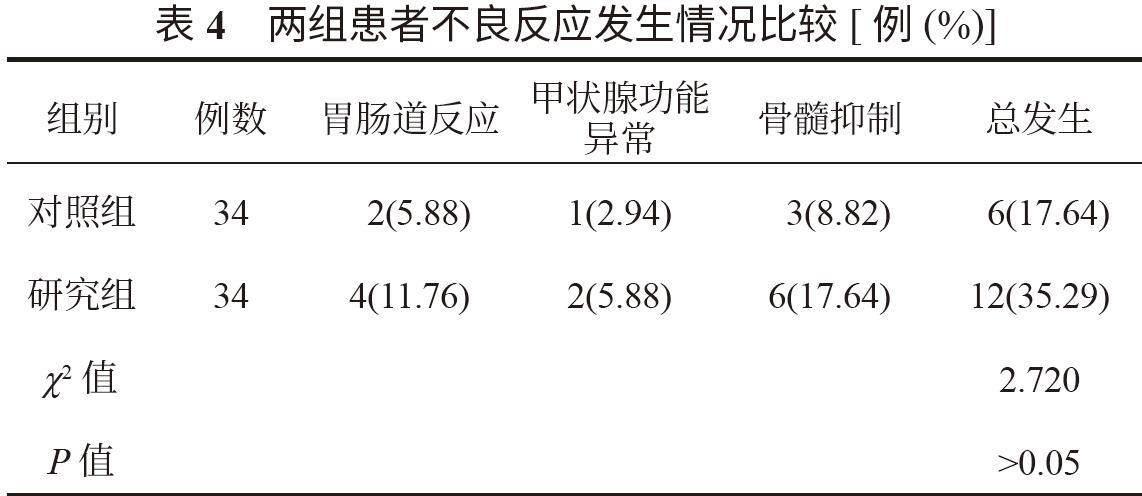
2.4 两组患者不良反应发生情况比较 研究组患者胃肠道反应、甲状腺功能异常、骨髓抑制总发生率高于对照组,但差异无统计学意义(P>0.05),见表4。
3 讨论
胃癌的发生往往与饮食习惯、生活方式、遗传因素等多种因素相关。胃癌在早期往往没有明显的临床症状,这使得早期胃癌的筛查困难,很多患者在确诊时已经进入晚期,肿瘤已经扩散到胃壁深层组织、淋巴结或远处器官,或者因肿瘤的大小和位置导致无法手术切除。治疗晚期胃癌的目标主要是缓解症状、延长患者的生存期及提高生活质量。常用的治疗方法包括化疗、放疗、靶向治疗及支持性治疗等。XELOX方案是临床上用于治疗晚期胃癌的一种常用化疗方案,尽管该方案在一定程度上可缩小肿瘤病灶,但也存在一些不足之处,如长期使用XELOX可能导致肿瘤对这些药物产生耐药性,从而减弱治疗效果,同时XELOX的使用可能引起一系列不良反应,包括恶心、呕吐、脱发、骨髓抑制等,影响患者的生活质量[6]。
Sin是一种人源化的免疫检查点抑制剂,属于抗程序性死亡-1(PD-1)抗体类药物,PD-1是一种位于T细胞表面的免疫检查点分子,与其配体程序性死亡配体-1(PD-L1)结合后,抑制T淋巴细胞的活化和功能,从而避免过度免疫反应和自身免疫损伤。Sin通过阻断PD-1与PD-L1的结合,恢复T细胞对肿瘤细胞的识别和攻击能力,从而增强机体的抗肿瘤免疫反应。此外,Sin的作用机制使得免疫系统能够更有效地识别和清除肿瘤细胞,从而抑制肿瘤的生长和扩散[7]。分析两组疗效发现,研究组高于对照组,差异无统计学意义,这表明Sin联合XELOX化疗方案治疗晚期胃癌的效果良好。
LAG-3、sTim-3是一种免疫检查点分子,主要表达在活化的T淋巴细胞、调节性T淋巴细胞及NK细胞上。sLAG-3、sTim-3通过与其配体结合,抑制T淋巴细胞的活化和功能,从而影响免疫应答。在晚期胃癌患者治疗中,sLAG-3、sTim-3的水平可能与肿瘤的免疫逃逸相关,其水平升高可能提示患者处于免疫抑制状态[8]。CA125、CA724、CEA是常用的肿瘤标志物,其在晚期胃癌患者治疗中具有一定的意义,主要用于评估治疗效果、监测疾病进展及预测预后[9]。通过对比分析两组肿瘤标志物和免疫功能指标结果发现,治疗6个月后研究组肿瘤标志物与免疫功能指标均低于对照组,这提示Sin联合XELOX化疗治疗晚期胃癌能够降低患者的肿瘤标志物水平,提高免疫功能。分析原因可能为,Sin通过解除PD-1/PD-L1通路的抑制作用,增强T淋巴细胞的活性,从而增强免疫系统对肿瘤的攻击能力;而XELOX化疗药物则可以直接杀伤肿瘤细胞,这种联合作用可以在不同层面同时攻击肿瘤,抑制肿瘤标志物水平的表达。同时,Sin与化疗药物联合使用有助于减少肿瘤对单一治疗方式产生的耐药性,Sin和化疗药物具有不同的作用机制,联合使用可以减少肿瘤对任一治疗方式的逃逸和抵抗;同时Sin还能够改善肿瘤微环境,增加化疗药物在肿瘤内的渗透性和作用靶点,从而增强了化疗对肿瘤细胞的杀伤作用,降低患者的肿瘤标志物水平,提高免疫功能[10-11]。
另外,通过分析两组安全性结果发现,研究组患者胃肠道反应、甲状腺功能异常、骨髓抑制总发生率高于对照组,但差异无统计学意义,这说明Sin联合XELOX化疗治疗晚期胃癌的安全性良好。分析其原因可能为,Sin是一种相对针对性较高的药物,能够针对肿瘤细胞的特定通路或分子,以达到抑制肿瘤生长和扩散的目的,这种针对性可能有助于减少对健康组织的不良影响,从而维持良好的安全性[12]。
综上,Sin联合XELOX化疗方案治疗晚期胃癌的效果与安全性均良好,能够更有效降低患者的肿瘤标志物水平,提高患者机体免疫功能。但本研究可能存在样本量不足的问题,并且研究的随访时间可能过短,无法观察到长期效果和潜在的不良反应,因此在未来的研究中仍需要更严谨的设计、更大样本量的临床试验及更长期的随访数据来进一步验证其临床应用的可行性和有效性。
参考文献
[1]李婷, 马彦娥, 贺双. 阿帕替尼片联合奥沙利铂、替吉奥胶囊对晚期胃癌患者肿瘤标志物及CCL20、HSP70水平的影响[J]. 临床医学研究与实践, 2023, 8(17): 25-28.
[2]李娟, 叶斯斯, 张鹏飞, 等. 信迪利单抗一线治疗晚期胃癌或胃食管结合部腺癌的疗效分析[J]. 武警医学, 2023, 34(6): 476-480.
[3]姬颖华, 杨晓煜, 王瑾, 等. 盐酸安罗替尼联合Sin注射液治疗对微卫星稳定型结直肠癌患者血管内皮生长因子、转化生长因子-β水平及免疫功能的影响[J]. 癌症进展, 2021, 19(7): 725-728.
[4]解亦斌, 田艳涛. 我国晚期胃癌临床特点及诊治策略[J]. 中华医学杂志, 2018, 98(24); 1897-1898.
[5]EISENHAUER E A, THERASSE P, BOGAERTS J, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1)[J]. Eur J Cancer, 2009, 45(2): 228-247.
[6]闫睿, 赵敏, 韩冬. 脾多肽注射液联合替吉奥+顺铂方案治疗晚期胃癌的效果及对外周血γ干扰素/白细胞介素4比值、T淋巴细胞亚群水平的影响[J]. 广西医学, 2021, 43(13): 1547-1552.
[7]卫春燕, 宋丽丽. 信迪利单抗联合改良DCF方案治疗晚期胃癌的临床研究[J]. 检验医学与临床, 2022, 19(14): 1970-1974.
[8]胡培, 徐健, 鲍柏军. 含多西他赛联合方案治疗晚期胃癌近远期效果及对可溶性细胞间黏附因子-1和E-钙黏蛋白的影响[J]. 药学服务与研究, 2021, 21(1): 37-40.
[9]田洁, 付文华, 张媛, 等. 恩度联合信迪利单抗注射液治疗晚期结直肠癌的效果及其对血清CA199、CEA、CYFRA21-1水平的影响[J]. 分子诊断与治疗杂志, 2023, 15(5): 897-900.
[10]刘昭, 任玉川, 张亚鹏, 等. Sin联合化疗对晚期胃癌患者近期疗效及血清CEA sTim-3 sLAG-3和T淋巴细胞亚群的影响[J]. 河北医学, 2024, 30(2): 335-340.
[11]李璐璐, 黄然欣, 张蓉, 等. 信迪利单抗联合白蛋白紫杉醇对晚期胃癌血清肿瘤标志物水平及免疫功能的影响[J]. 临床和实验医学杂志, 2023, 22(22): 2384-2387.
[12]从丽,刘国欣,叶劲军,等.信迪利单抗联合常规化疗治疗中晚期食管癌患者对外周血程序性死亡受体1/程序性死亡受体配体1及1年存活率影响[J]. 临床军医杂志, 2023, 51(6): 629-631, 634.

