基于斑马鱼模型和代谢组学技术筛选天麻中潜在抗癫痫活性成分
陈善军 王欢 胡凯庆 毕文杰 程贵东 王松松 韩利文 王晓静

DOI:10.3976/j.issn.1002-4026.20230089
收稿日期:2023-05-27
基金项目:山东省自然科学基金(ZR2019MH037);山东第一医科大学学术提升计划(2019LJ003);山东省中医药高层次人才培育项目
作者简介:陈善军(1997—),男,硕士研究生,研究方向为中药复杂药效物质解析。E-mail: 13562918151@163.com
*通信作者,王晓静(1966—),女,研究员,研究方向为天然药物化学。E-mail: xj68cn@163.com
韩利文(1980—),男,副研究员,研究方向为中药质量控制。E-mail: hanliwen08@126.com
摘要:从确有疗效的中药天麻中挖掘潜在的抗癫痫活性成分对于癫痫的防治意义重大。使用斑马鱼幼鱼癫痫模型评价两个产地天麻样本的抗癫痫活性;利用基于LC-MS/QE plus(液相色谱-质谱)的代谢组学技术检测天麻成分,结合模式判别分析方法寻找重要差异代谢物;通过一级质谱与二级质谱数据及文献进行代谢物鉴定,并利用斑马鱼癫痫模型进一步对代谢物的抗癫痫活性进行确认。结果显示9个天麻提取物能够显著减少斑马鱼的涡旋数量,并且两产地天麻在抗癫痫活性上有着显著差异(P<0.05)。代谢组学检测以及模式判别分析筛选并鉴定出了6个重要差异代谢物(巴利森苷E、天麻素、巴利森苷C、巴利森苷D、N6-对羟基苄基腺苷、4, 4′-二羟基二苄基醚)。活性验证发现巴利森苷E、天麻素、N6-对羟基苄基腺苷能够显著抑制斑马鱼癫痫样行为。该研究运用斑马鱼模型与代谢组学找出并确定了天麻中多个具有抗癫痫活性的成分,其中巴利森苷E以及N6-对羟基苄基腺苷首次被发现具有抗癫痫活性,为天麻抗癫痫作用的研究提供了参考价值。
关键词:天麻;癫痫;代谢组学;斑马鱼;活性成分
中图分类号:R917 文献标志码:A 文章编号:1002-4026(2024)03-0001-09
开放科学(资源服务)标志码(OSID):
Screening of potential antiepileptic active ingredients in Rhizoma Gastrodiae
based on zebrafish model and metabolomics technology
CHEN Shanjun, WANG Huan, HU Kaiqing, BI Wenjie, CHENG Guidong, WANG Songsong, HAN Liwen*, WANG Xiaojing*
(National Key Laboratory of Advanced Drug Delivery System, School of Pharmaceutical Sciences &Institute of Materia Medica, Shandong First Medical University &Shandong Academy of Medical Sciences, Jinan 250117, China)
Abstract∶Identifying potential antiepileptic active ingredients in Rhizoma Gastrodiae is of immense significance for the prevention and treatment of epilepsy. In this study, we used a larval zebrafish epilepsy model to evaluate the antiepileptic activity of Rhizoma Gastrodiae from two different regions. In addition, we employed metabolomics technology based on liquid chromatography tandem mass spectrometry/QE plus to detect the ingredients in Rhizoma Gastrodiae and performed pattern analysis to identify key differential metabolites. The metabolites were further identified using primary and secondary mass spectrometry data and literature references. This step was followed by the confirmation of their antiepileptic activity using the zebrafish epilepsy model. The results showed that nine extracts of Rhizoma Gastrodiae significantly reduced the number of whirls in zebrafish, and significant differences in antiepileptic activity were observed between the Rhizoma Gastrodiae samples from the two regions (P<0.05). Metabolomics and pattern analysis identified six important differential metabolites (Parishin E, Gastrodin, Parishin C, Parishin D, N6-p-hydroxybenzyl adenosine, and 4,4′-dihydroxydibenzyl ether). Activity verification results showed that Parishin E, Gastrodin, and N6-p-hydroxybenzyl adenosine significantly inhibited zebrafish epilepsy-like behavior. This study utilized the zebrafish model and metabolomics to identify and determine several active antiepileptic ingredients in Rhizoma Gastrodiae. Of these, Parishin E and N6- p-hydroxybenzyl adenosine were reported for the first time to exhibit antiepileptic activity, thereby serving as a valuable reference for further research on the antiepileptic effects of Rhizoma Gastrodiae.
Key words∶Rhizoma Gastrodiae; epilepsy; metabolomics; zebrafish; active ingredients
癫痫(epilepsy)是一种由神经元异常放电引起的神经系统疾病,影响着全球7 000多万人,具有突发性和不可预测的特征[1-2]。癫痫发作能够引起大脑的形态和功能变化,主要表现为认知和神经心理障碍,若没有得到及时控制与治疗,可能会导致永久性认知功能障碍[3]。抗癫痫药物(AEDs)主要通过平衡兴奋性神经递质与抑制性神经递质水平从而达到抑制癫痫发作的目的,但仍然有约三分之一的患者对抗癫痫药物有着不同程度的耐药[4]。天然产物具有毒副作用小、骨架结构多样、生物活性广泛等特点[5],因此从传统中药中筛选潜在的活性物质能够为抗癫痫药物研发提供科学依据。
天麻又叫“赤箭”“定风草”,是植物天麻Gastrodia elata Bl.的干燥块茎。作为我国的传统“止痉”中药,天麻在治疗惊痫抽搐上具有确切的疗效。《中国药典》中记载天麻具有息风止痉、平抑肝阳、祛风通络的效果,常用于小儿惊风、癫痫抽搐等。现代药理学研究发现天麻中的天麻素、香草醇等成分具有明显的抗癫痫活性[6-7]。但天麻中以对羟基苯甲醇为母核的衍生物成分超过40种,还有许多成分的抗癫痫活性并不明确[8],因此有必要对天麻中潜在抗癫痫成分进行进一步筛选。
本实验拟采用斑马鱼模型对天麻进行抗癫痫活性评价,利用代谢组学与模式判别辨识天麻中潜在的抗癫痫活性物质,并使用斑马鱼模型评价潜在活性成分的抗癫痫作用,从而确定抗癫痫活性成分,以便为天麻抗癫痫作用的研究提供参考价值。
1 实验材料
1.1 试剂与仪器
戊四唑(PTZ)购自Sigma-Aldrich公司;二甲基亚砜(DMSO,批号:C15210581,纯度:大于99.8%)、丙戊酸钠(VPA,批号:C11370830,纯度:98%)均购自上海麦克林生化科技有限公司;天麻素(GAS,批号:T10M9F55562,纯度:HPLC ≥ 98%)、巴利森苷E(PE,批号:M20HB178561,纯度:HPLC ≥ 98%)、巴利森苷C(PC,批号:D06N11S130122,纯度:HPLC ≥ 98%)、N6-对羟基苄基腺苷(NHBA,批号:C12073575,纯度:98%),以上试剂购自上海源叶生物有限公司;天麻药材购自济南鼎国生物科技有限公司(2022年8月),由山东第一医科大学韩利文副研究员鉴定为兰科植物天麻Gastrodia elata Bl.的干燥块茎,共分为13批次,命名为P1~P13,其中P1~P6产自云南昭通,P7~P13产自吉林长白山;无水乙醇(国药集团化学试剂有限公司,批号:20221213,AR),甲醇(赛默飞世尔科技,批号:A452-4,fisher),乙腈(赛默飞世尔科技,批号:A998-4,fisher),甲酸(赛默飞世尔科技,批号:A117-50,fisher),纯净水(杭州娃哈哈集团有限公司)。
索尼摄像机(DSC-RX100M7,日本索尼公司),中药粉碎机(BJ-150,拜杰多功能粉碎机),旋转蒸发器(RE-200A,郑州科泰实验设备有限公司),全自动样品快速研磨仪(Wonbio-E,上海万柏生物科技有限公司),台式高速冷冻离心机(TGL-16MS,上海卢湘仪离心机仪器有限公司),高分辨质谱仪(QE plus,赛默飞世尔科技公司),高效液相色谱仪(ACQUITY UPLC I-Class plus,Waters),色谱柱(ACQUITY UPLC HSS T3,100 mm×2.1 mm, 1.8 μm, Waters)。
1.2 实验动物
AB系斑马鱼(Danio rerio)由山东第一医科大学斑马鱼研究中心提供,斑马鱼养殖系统购自上海海圣生物实验设备有限公司。AB系成年斑马鱼在(28±0.5)℃的恒温养殖系统下养殖,整个系统为自动水循环系统,并进行14 h/10 h(上午8:30光照,晚上22:30黑暗)的光照/黑暗循环。健康成年雄性和雌性斑马鱼以2:2的比例光刺激产卵,在产卵2 h后收集的鱼卵使用专用养鱼水冲洗3次。将干净的胚胎转移到含有养鱼水的90 mm培养皿中,加入适量的亚甲基蓝抑制细菌生长,并去除未受精以及发育不良的鱼卵,健康鱼卵在 28.5 ℃ 的恒温培养箱中孵育用于后续实验。实验之前需要经常观察鱼卵的发育状况,并及时去除发育过程中鱼卵褪下的卵膜以及死去的鱼卵。
2 实验方法
2.1 天麻样品的提取制备
天麻粉碎过4号筛(65目),称取各批天麻粉末约15 g,精密称定,置于500 mL圆底烧瓶中,按照料液比1:20加入70%的乙醇回流2.5 h,过滤,取滤液进行55 ℃旋蒸,直至旋至无醇味,冷冻干燥24 h,得到各批次中药天麻的提取物样品。
2.2 利用斑马鱼癫痫模型对不同产地天麻进行抗癫痫活性评价
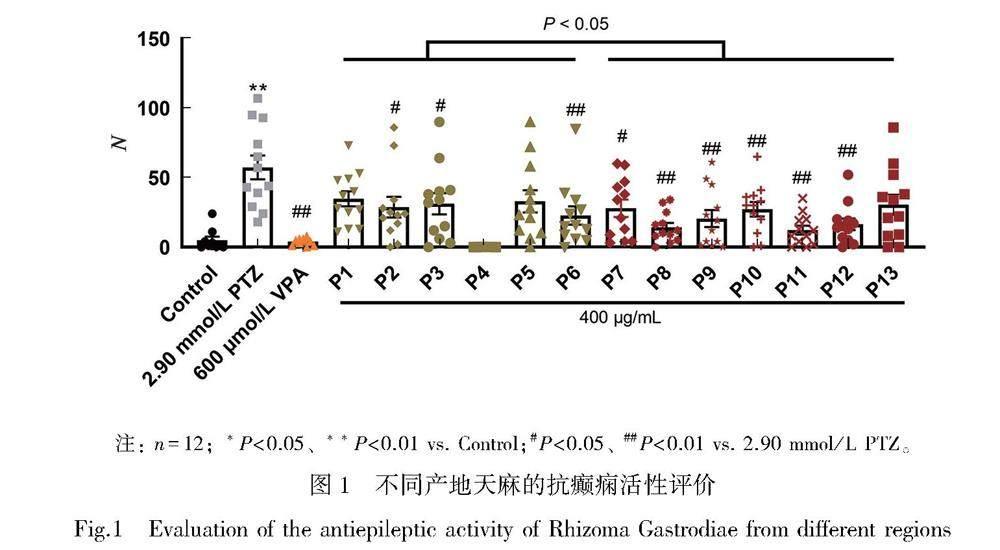
使用本实验室建立的斑马鱼抗癫痫活性评价方法,即ZebVortrack行为分析系统对天麻提取物的抗癫痫活性进行评价[9]。斑马鱼癫痫发作时会产生癫痫样涡旋游泳行为,ZebVortrack行为分析系统可以根据斑马鱼涡旋游泳时的向量夹角以及涡旋游泳持续时间进行分析,量化斑马鱼幼鱼在癫痫发作过程中产生的涡旋数量Number(N)。
精密称各批次天麻提取物粉末,加入纯净水溶解定容,得到400 μg/mL的溶液。精密称取戊四唑(PTZ)与丙戊酸钠(VPA),加入纯净水溶解,分别配制得到2.90 mmol/L PTZ水溶液以及600 μmol/L VPA 水溶液,并分别作为造模药物以及阳性对照药物。
将受精后4天(4 days post fertilization, 4 dpf)的AB品系斑马鱼置于6孔板中,加入400 μg/mL天麻提取物溶液或600 μmol/L VPA预处理幼鱼24 h,之后转移至12孔板中,每孔1条,除去水分并分别加入2.90 mmol/L PTZ溶液诱导幼鱼癫痫发作30 min。PTZ处理过程中同时使用相机拍摄,拍摄结束后将视频导入ZebVortrack系统进行分析,输出斑马鱼癫痫发作时的涡旋数量N。
对两个产地天麻的抗癫痫活性进行分析,检验两地天麻对斑马鱼幼鱼的抗癫痫活性差异。
2.3 天麻样品的LC-MS代谢组学检测
称取各天麻样本60 mg,放入1.5 mL的离心管,加入甲醇水溶液超声溶解30 min,使用0.22 μm的有机相针孔过滤器过滤后,转移到LC(液相色谱)进样小瓶进行LC-MS(液相色谱-质谱)分析。质控样本(QC)由所有样本的提取液等体积混合制备而成。
色谱条件:色谱柱为ACQUITY UPLC HSS T3 (100 mm×2.1 mm, 1.8 μm), 柱温为45 ℃;流动相A为水(含0.1%甲酸),B为乙腈(含0.1%甲酸);流速为0.35 mL/min;进样体积2 μL。梯度程序:0~2 min,5% B;2~4 min,5%→30% B;4~8 min,30%→50% B;8~10 min,50%→80% B;10~14 min,80%→100% B;14~15 min,100% B;15~15.1 min,100%→5% B;15.1~16 min,5% B。离子源:ESI;样品质谱信号采集分别采用正负离子扫描模式。
2.4 数据预处理与多元统计分析
使用质谱检测天麻样本后,原始数据采用Progenesis QI v3.0 软件 (Nonlinear Dynamics, Newcastle, UK) 进行数据预处理,包括基线过滤、峰识别、积分、保留时间校正、峰对齐和归一化;删除组内缺失值(0值)> 50%的离子峰;最后将正负离子数据合并成一个数据矩阵表用于后续数据分析。
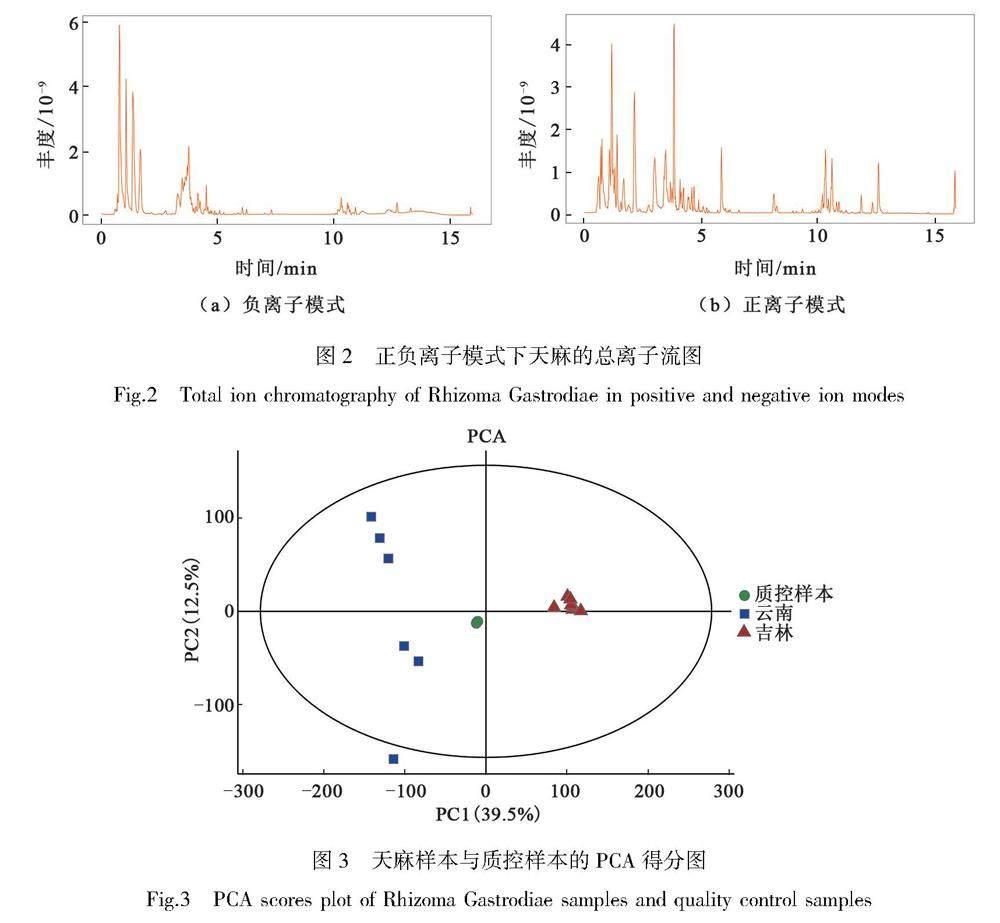
主成分分析(PCA)是一种非监督分析,可以反映数据的原始情况,能够观察样本间的总体分布趋势[10-11]。采用主成分分析对天麻样本的质谱数据进行分析,以判断样本的离散情况。如果两组天麻样本的成分之间有显著性差异,那么两组的样本点在PCA得分图上相距较远,若是两组天麻样本成分之间差异并不显著,那么两组样本点在PCA得分图上就会相距较近。
进一步采用有监督分析方法正交-偏最小二乘法(OPLS-DA)寻找两组天麻样本的差异代谢物[12-13]。同时采用7次循环交互验证(7-fold cross validation)实验和200次响应排序检验(response permutation testing, RPT)验证模型是否过拟合。利用OPLS-DA分析的变量权重值(variable important in projection, VIP)、P值以及S-plot中的相关系数(correlation coefficient)绝对值|p(corr)|综合衡量各代谢物的重要性,帮助挖掘差异代谢物。
2.5 差异代谢物鉴定
差异代谢物主要通过文献查阅以及一级、二级质谱数据进行鉴定。利用赛默飞Xcalibur软件对差异代谢物进行一级质谱比对鉴定,鉴定标准为该化合物一级质谱质荷比的测量值与理论值的误差,误差的计算方法如式(1)。
Δ= [(理论值-测量值)/理论值]×106, (1)
式(1)中Δ表示误差,数值大小范围为(-10, 10)。与文献中查找的二级质谱数据进行比对,从而确定代谢物成分,即潜在抗癫痫活性成分。
2.6 潜在抗癫痫活性成分的活性验证
使用斑马鱼行为分析系统对组学筛选出的差异代谢物进行活性验证。称取筛选出的代谢物标准品适量,配制成合适浓度。使用以上溶液对4 dpf 斑马鱼进行预处理24 h,处理结束后将斑马鱼置于12孔板,每孔1条,加入2.90 mmol/L PTZ溶液处理30 min,并使用摄像机拍摄斑马鱼幼鱼的游动状态,拍摄结束后将视频导入ZebVortrack系统进行行为分析,输出斑马鱼癫痫样涡旋游泳数量N。
2.7 统计学分析
活性评价使用GraphPad Prism 8软件进行统计,统计数据采用(平均值±标准误差)的方式表示,统计学差异通过单因素方差分析,P<0.05表示有显著统计学差异,P<0.01表示有极显著统计学差异。
3 结果
3.1 不同产地天麻提取物对斑马鱼癫痫的影响
天麻提取物活性评价结果如图1所示。使用2.90 mmol/L的PTZ处理后的斑马鱼幼鱼癫痫样涡旋次数显著增多;使用VPA进行了幼鱼24 h的预处理以后进行了PTZ诱导癫痫发作,从图中可以看到斑马鱼幼鱼的涡旋次数显著减少,表明了斑马鱼癫痫模型在此次实验中构建成功。天麻提取物抗癫痫实验结果显示P2、P3、P6~P12能够显著减少斑马鱼的涡旋数量,但P1、P5、P13批次并未显著减少斑马鱼的涡旋次数,P4提取物在相等剂量处理斑马鱼的过程中造成斑马鱼死亡。通过进一步检验发现两个产地天麻之间对于PTZ诱导的斑马鱼幼鱼涡旋次数的影响有着显著差异(P<0.05)。
3.2 不同产地天麻样品的组学检测分析结果
实验采用液-质联用技术检测了天麻样品并进行了3次质量控制检查,图2为在负离子与正离子模式下检测的总离子流图(TIC)。如图3的PCA得分图显示, QC点分布在一起并处在原点附近,表明实验过程中仪器稳定性较好。
实验采用PCA主成分分析观察天麻样本的总体分布,使用OPLS-DA寻找组间的差异代谢物。如图4(a)所示,椭圆区域代表95%的置信区间,PCA能够将两地天麻成功区分,其中第一主成分为41.2%,第二主成分为13%,表明两地天麻成分含量有着显著差异;OPLS-DA结果也显示两地天麻的成分含量具有显著差异,其中变量拟合指数R2x为0.726,R2y 为0.998,预测指数Q2为0.975,表明了OPLS-DA模型具有良好的可测量性和适用性(图4(b));S-plot图的左下角离子与右上角离子为重要离子(图4(c));响应排序检验结果显示R2 为 0.858,Q2为-0.466,并且R2与Q2左边的点均低于最右边的点,同时 Q2点的绿色回归线与纵轴(左侧)截距小于零,表明了OPLS-DA模型没有过度拟合(图4(d))。
3.3 重要差异代谢物的鉴定结果
对代谢组学检测到的天麻成分进行判别分析,设定VIP值>3, P<0.05, |p(corr)|>0.58筛选后,得到183个差异特征离子,比对一级质谱数据与二级质谱数据以及文献查阅鉴定辨识了6种成分,分别为巴利森苷E、天麻素、巴利森苷C、巴利森苷D、N6-对羟基苄基腺苷、4, 4′-二羟基二苄基醚,即潜在活性成分,详情见表1。
天麻素(C13H18O7, m/z 286.104 7),负离子模式能量撞击得到碎片离子峰为:m/z 123.045 3,具体裂解方式如图5(a)所示。巴利森苷D (C20H20O9, m/z 404.110 1),正离子模式下能量撞击得到碎片离子峰为:m/z 107.049 7。具体裂解方式如图5(b)所示。
3.4 潜在活性成分的抗癫痫作用验证
使用斑马鱼癫痫模型验证了4种潜在活性成分在不同浓度下的抗癫痫活性,具体为GAS(699、1 398、2 796 μmol/L)、PE(16.3、32.6、65.2 μmol/L)、PC(54.9、109.8、164.7 μmol/L)以及NHBA(26.8、53.6、80.4 μmol/L)。结果如图6所示,GAS在中、高剂量下能够显著减少斑马鱼的涡旋次数,NHBA在低、中、高剂量下都能够显著减少斑马鱼涡旋次数,PE在低、高剂量下能够显著减少斑马鱼涡旋次数,PC在3个剂量下均未显著减少斑马鱼幼鱼的涡旋次数。
4 讨论
斑马鱼作为新型模式生物,与人类基因高度同源[14-15],并且斑马鱼胚胎透明,生长周期短,体积小,适合高通量实验。斑马鱼的神经系统与人类相似,4 dpf斑马鱼中就可以检测到胶质细胞亚型(少突胶质细胞、雪旺细胞和星形胶质细胞),同时神经系统还表达出一系列的信号分子[16]。此外,促惊厥剂还可以导致斑马鱼行为障碍,如游泳速度加快、姿势丧失等[17]。这些行为表型结合强大的视频跟踪分析工具使斑马鱼成为药物开发研究中高通量筛选分析的优良脊椎动物。然而,当斑马鱼暴露于其他外部刺激(如毒素)时,游泳速度与距离也会增加[18-19]。为此,本研究基于斑马鱼癫痫发作时产生的典型涡旋游泳行为,使用实验室构建的行为分析系统ZebVortrack对斑马鱼癫痫发作的涡旋行为进行量化,以便更加准确地评估天麻的抗癫痫活性。
中药代谢组学的快速发展推动了中药研究,为中药现代化发展注入了新的动力。中药代谢组学主要通过现代分析仪器对中药或方剂中的成分进行检测,具有系统性、高灵敏度、特异性的特点,结合多元计量分析如主成分分析、偏最小二乘法或正交-偏最小二乘法寻找出中药中的重要化合物,继而对化合物进一步分析,在中药药效物质辨识研究以及质量控制上发挥了巨大的作用[20-21]。本研究通过代谢组学检测了不同产地天麻的成分,结合模式判别找出了6种重要差异代谢物,即潜在抗癫痫活性成分,其结构多为对羟基苯甲醇衍生物,此外还有腺苷类似物N6-对羟基苄基腺苷。对羟基苯甲醇[22]、腺苷[23]、天麻素[24-25]是天麻中已知的具有抗癫痫作用的成分。在本研究筛选出的6种潜在抗癫痫活性成分中,除天麻素是已知具有抗癫痫作用的成分外,其余5种均未被报道有抗癫痫作用。为了进一步验证所筛选成分的抗癫痫活性,利用构建的斑马鱼癫痫模型评价了天麻素、N6-对羟基苄基腺苷、巴利森苷E以及巴利森苷C的抗癫痫活性。结果显示天麻素、N6-对羟基苄基腺苷以及巴利森苷E能够显著抑制斑马鱼的癫痫发作,巴利森苷C并未显著抑制斑马鱼的癫痫发作,其中N6-对羟基苄基腺苷以及巴利森苷E首次被发现具有抗癫痫作用。
综上所述,通过斑马鱼模型结合代谢组学技术找出了6种潜在的抗癫痫活性成分,并利用斑马鱼癫痫模型进一步确定了天麻素、N6-对羟基苄基腺苷以及巴利森苷E的抗癫痫活性。其中N6-对羟基苄基腺苷以及巴利森苷E首次被发现具有抗癫痫活性,为天麻抗癫痫的复杂作用提供了理论依据。
参考文献:
[1]de FARIAS A C S, de PIERI PICKLER K, BERNARDO H T, et al. Melatonin pretreatment protects against Status epilepticus, glutamate transport, and oxidative stress induced by kainic acid in zebrafish[J]. Molecular Neurobiology, 2022, 59(1): 266-275. DOI: 10.1007/s12035-021-02579-4.
[2]苏发智, 孙延平, 白晨曦, 等. 中医药辨证治疗癫痫的研究进展[J]. 中国实验方剂学杂志, 2023, 29(11): 200-211. DOI: 10.13422/j.cnki.syfjx.20220490.
[3]LANDI S, PETRUCCO L, SICCA F, et al. Transient cognitive impairment in epilepsy[J]. Frontiers in Molecular Neuroscience, 2019, 11: 458. DOI: 10.3389/fnmol.2018.00458.
[4]LERCHE H. Drug-resistant epilepsy - time to target mechanisms[J]. Nature Reviews Neurology, 2020, 16(11): 595-596. DOI: 10.1038/s41582-020-00419-y.
[5]杨震. 活性天然产物和结构多样性类天然产物的合成[J]. 化学进展, 2009, 21(1): 47-54.
[6]YANG C S, CHIU S C, LIU P Y, et al. Gastrodin alleviates seizure severity and neuronal excitotoxicities in the rat lithium-pilocarpine model of temporal lobe epilepsy via enhancing GABA ergic transmission[J]. Journal of Ethnopharmacology, 2021, 269: 113751. DOI: 10.1016/j.jep.2020.113751.
[7]HSIEH C L, CHANG C H, CHIANG S Y, et al. Anticonvulsive and free radical scavenging activities of vanillyl alcohol in ferric chloride-induced epileptic seizures in Sprague-Dawley rats[J]. Life Sciences, 2000, 67(10): 1185-1195. DOI: 10.1016/S0024-3205(00)00706-2.
[8]于涵, 张俊, 陈碧清, 等. 天麻化学成分分类及其药理作用研究进展[J]. 中草药, 2022, 53(17): 5553-5564. DOI: 10.7501/j.issn.0253-2670.2022.17.033.
[9]韩利文, 陈善军, 李太平, 等. 利用斑马鱼幼鱼模型高通量筛选抗癫痫药物的方法及装置: CN115227836A[P]. 2022-10-25.
[10]TA瘙塁-KKAYDN M, TEL-AYAN G, AYAN F, et al. Chemometric classification of chestnut honeys from different regions in Turkey based on their phenolic compositions and biological activities[J]. Food Chemistry, 2023, 415: 135727. DOI: 10.1016/j.foodchem.2023.135727.
[11]穆岩, 李丽丽, 马双双, 等. 铅离子导致神经胶质细胞毒性的代谢组学机制[J]. 山东科学, 2019, 32(6): 26-33. DOI: 10.3976/j.issn.1002-4026.2019.06.005.
[12]OTA M, XU F, LI Y L, et al. Comparison of chemical constituents among licorice, roasted licorice, and roasted licorice with honey[J]. Journal of Natural Medicines, 2018, 72(1): 80-95. DOI: 10.1007/s11418-017-1115-4.
[13]LIU X L, ZHONG C, XIE J, et al. Geographical region traceability of Poria cocos and correlation between environmental factors and biomarkers based on a metabolomic approach[J]. Food Chemistry, 2023, 417: 135817. DOI: 10.1016/j.foodchem.2023.135817.
[14]DRIEVER W, SOLNICA-KREZEL L, SCHIER A F, et al. A genetic screen for mutations affecting embryogenesis in zebrafish[J]. Development, 1996, 123: 37-46. DOI: 10.1242/dev.123.1.37.
[15]李雷, 蒋林华. 基于Cytoscape下斑马鱼衰老基因-蛋白质的模块化分析[J]. 生物信息学, 2019, 17(3): 175-181. DOI: 10.12113/j.issn.1672-5565.201901001.
[16]GUO S. Using zebrafish to assess the impact of drugs on neural development and function[J]. Expert Opinion on Drug Discovery, 2009, 4(7): 715-726. DOI: 10.1517/17460440902988464.
[17]BARABAN S C, TAYLOR M R, CASTRO P A, et al. Pentylenetetrazole induced changes in zebrafish behavior, neural activity and c-fos expression[J]. Neuroscience, 2005, 131(3): 759-768. DOI: 10.1016/j.neuroscience.2004.11.031.
[18]陈锡强, 侯海荣, 刘可春, 等. 苍耳子提取物对斑马鱼的发育及运动行为的毒性研究[J]. 山东科学, 2014, 27(5): 9-13. DOI: 10.3976/j.issn.1002-4026.2014.05.002.
[19]HUANG Y, ZHANG J S, HAN X B, et al. The use of zebrafish (Danio rerio) behavioral responses in identifying sublethal exposures to deltamethrin[J]. International Journal of Environmental Research and Public Health, 2014, 11(4): 3650-3660. DOI: 10.3390/ijerph110403650.
[20]郭思凡, 蔡莹, 张爱华. 基于代谢组学的中药药效评价、药效物质发现及作用机制研究进展[J]. 药物评价研究, 2022, 45(11): 2338-2346. DOI: 10.7501/j.issn.1674-6376.2022.11.023.
[21]SHI Y P, ZHANG Y G, LI H N, et al. Discovery and identification of antithrombotic chemical markers in Gardenia Fructus by herbal metabolomics and zebrafish model[J]. Journal of Ethnopharmacology, 2020, 253: 112679. DOI: 10.1016/j.jep.2020.112679.
[22]苏逸. 对羟基苯甲醇对大鼠杏仁核点燃的影响[D]. 杭州: 浙江大学, 2013.
[23]MASINO S A, KAWAMURA M Jr, RUSKIN D N. Adenosine receptors and epilepsy: Current evidence and future potential[J]. International Review of Neurobiology, 2014, 119: 233-255. DOI: 10.1016/B978-0-12-801022-8.00011-8.
[24]陆延安, 徐冬君. 天麻素治疗癫痫患者脑电图变化研究[J]. 中药药理与临床, 2015, 31(2): 114. DOI: 10.13412/j.cnki.zyyl.2015.02.049.
[25]JIN M, HE Q X, ZHANG S S, et al. Gastrodin suppresses pentylenetetrazole-induced seizures progression by modulating oxidative stress in zebrafish[J]. Neurochemical Research, 2018, 43(4): 904-917. DOI: 10.1007/s11064-018-2496-9.

