高良姜乙醇提取物微囊的制备及其性能表征
彭素娟, 温镇榕, 冯真英, 陈丹, 王建文, 黄丽平
(1.广东医科大学附属第二医院,广东湛江 524001;2.岭南师范学院,广东湛江 524048)
高良姜,姜科植物高良姜Alpinia officinarumHance 的干燥根茎,又名南姜、蜜姜,具有温胃散寒、消食止痛的功效,主要治疗脘腹冷痛,胃寒呕吐,嗳气吞酸。但高良姜辛辣刺鼻,患者依从性差,而微囊是一种由聚合物壁壳和微型容器或包装物组成的载体,可以防止高良姜受到环境的影响,降低其毒性并掩盖其难闻的气味,提高药物稳定性和大众接受度。高良姜乙醇提取物作为一种天然黄酮类化合物,具有良好的生物安全性和药用价值,但其黄酮母核的平面结构造成了水溶性差的特点,严重影响了其在肠道内的代谢吸收,导致口服生物利用度较低,在一定程度上限制了药效作用的发挥。微囊通过用聚合物基质或壳包裹固体小颗粒、液体液滴或固体在液体中的分散体,制造粒径在1~1 000 µm 之间的微胶囊,能够有针对性地控制核心活性物质的释放,掩盖药物的不良口味和气味,减少胃肠道刺激和潜在毒性。以特定囊材制备微囊,可以做到定向给药,避免首过效应等破坏药效,有效提高了药物的活性和稳定性。因此,采用微囊包裹高良姜乙醇提取物,促进药物活性及稳定性,从而增强疗效,具有理论依据及研究前景。本研究以阿拉伯胶(GA)-壳聚糖(CS)为壁材,高良姜乙醇提取物为芯材,采用复合凝聚法制备高良姜乙醇提取物微囊,并优化制备工艺,进行表征分析,考察释放性能,以期为相关制剂的研究提供理论依据。现将研究结果报道如下。
1 材料
1.1 仪器AL104 电子天平(梅特勒-托利多仪器有限公司);SN-OES-100SH悬臂式电动搅拌器(上海尚普仪器设备有限公司);Nicolet6700 傅里叶转换红外光谱仪(美国Fisher Scientific 公司);XL-30扫描电子显微镜(荷兰PHILIPS 仪器有限公司);HH-6 数显恒温水浴锅(常州荣华仪器制造有限公司);80-2 电动离心机(常州澳华仪器有限公司);KQ-700E 超声波清洗器(昆山市超声仪器有限公司);1MA-70 制冰机(常熟市雪科电器有限公司);E200生物显微镜(尼康仪器有限公司);L600-1高效液相色谱(HPLC)仪(北京普析通用仪器有限公司)。
1.2 试药与试剂高良姜饮片由广东丰硒良姜有限公司提供,经岭南师范学院周中流教授鉴定,保存于天然药物化学实验室。高良姜乙醇提取物由课题组实验室制备。壳聚糖(CS)、阿拉伯胶(GA)、冰醋酸、氢氧化钠、吐温-80、甲醛、乙腈、磷酸、甲醇等试剂,均为分析纯,均购买于国药集团化学试剂有限公司。
2 方法与结果
2.1 高良姜乙醇提取物的制备方法取适量高良姜饮片粉碎成粗粉,脱脂24 h,挥干石油醚。依次加入40 倍量95%、60%乙醇,每次回流提取4 h,过滤,合并所得的滤液,减压浓缩,回收乙醇至无醇味。将粗提物加适量的水混匀,煮沸,加入1 mol·L-1氢氧化钠溶液调节pH 值至10~11,煮沸1 h,过滤,重复2次,合并滤液。滤液加入1 mol·L-1盐酸溶液调节pH 至1~2,水浴保温30 min,放置7 ~24 h。析出沉淀,离心,弃去上清液,沉淀用蒸馏水抽洗2~3 次,40 ℃真空干燥,即得高良姜乙醇提取物。
2.2 高良姜乙醇提取物微囊的制备方法准备浓度为0.05%、2%的阿拉伯胶水溶液,45 ℃恒温水浴,搅拌,待用。将高良姜乙醇提取物与80%的乙醇溶液以1∶10的比例进行计量混合(误差不超过0.1%),再与阿拉伯胶水溶液相结合,吐温-80(浓度为1.06~1.10 g/mL)用作乳化剂放入上述溶液中。将混合液放入45 ℃的恒温浴缸中,搅拌45 min,同时缓缓滴入壳聚糖溶液,得均匀的混合乳液[1-3]。用10%氢氧化钠溶液将其pH值调整到低于阿拉伯胶等电点(将系统pH 值调整到3.8~4.2),形成微囊。加入一倍体系量蒸馏水(蒸馏水提前置于水浴中,使蒸馏水温度与混合液温度相近),将烧杯从水浴锅中取出,自然冷却至30~35 ℃,后移至冰水浴(0~10 ℃)中搅拌,冷却至10 ℃。量取一定量的甲醛,用蒸馏水将甲醛稀释一倍,再缓慢滴加至上述溶液中。此后,将上述溶液pH 值调整到8 ~9,并搅拌2 h。12 h 预冻后,置于真空冻干器中烘干24 h即得高良姜乙醇提取物微囊[4-7]。
2.3 高良姜乙醇提取物微囊的单因素试验在制备过程中发现壁材比(GA/CS)、芯壁比、凝聚时间、固化剂用量、固化时间和pH 值等多种因素对高良姜乙醇提取物微囊载药量与包封率的影响,确定以壁材比、芯壁比、凝聚时间、固化剂用量为主要因素进行单因素试验。供试品溶液经0.45 µm 微孔滤膜滤过后检测微囊中高良姜乙醇提取物含量,根据公式1 和公式2 分别计算高良姜乙醇提取物微囊的载药量和包封率。
2.3.1 壁材比(GA/CS) 固定芯壁比为1∶5,壁材浓度分别为阿拉伯胶液2%、壳聚糖0.5%,设定壁材比分别为3∶1、4∶1、5∶1、6∶1和7∶1,测定载药量和包封率。
由图1可知,随着阿拉伯胶在壁材中的含量的增加,高良姜乙醇提取物微囊的药物含量即载药量先是上升,然后是略微下降,包封率亦是先逐渐上升再下降。这是由于当壁材比为4∶1时,该系统具有最小的自由基密度,不利于阿拉伯胶与壳聚糖间静电作用生成阿拉伯胶-壳聚糖;而当阿拉伯胶比增加时,系统的自由基密度增加,则有利于阿拉伯胶与壳聚糖间静电作用生成阿拉伯胶-壳聚糖复合物。当壁材比为7∶1时,因为阿拉伯胶具有增稠性能,在阿拉伯胶含量增加时,体系的黏度变大,影响阿拉伯胶-壳聚糖复合物的形成,因此,包封率有所降低。综合考虑高良姜乙醇提取物微囊的载药量和包封率,选择壁材比为6∶1 为最佳壁材比。
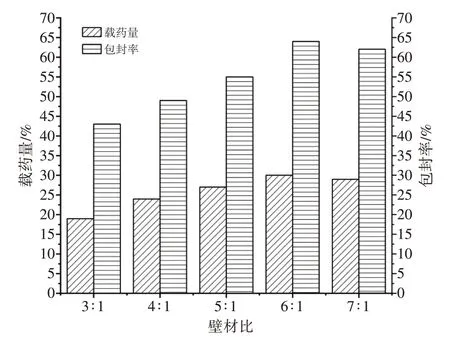
图1 壁材比(GA/CS)对高良姜乙醇提取物微囊载药量和包封率的影响Figure 1 Effect of wall material ratio(GA/CS)on drug loading and encapsulation efficiency of microcapsules of galangal ethanol extract
2.3.2 芯壁比 固定壁材比为3∶1,壁材浓度分别为阿拉伯胶液2%、壳聚糖0.5%,设定芯壁比分别为1∶3、1∶2、1∶1、2∶1,测定载药量和包封率。
由图2可知,随着芯壁比的增加,高良姜乙醇提取物微囊的载药量一直升高,包封率先逐渐升高后降低。这可能的原因是,当增加高良姜乙醇提取物的比例时,阿拉伯胶和壳聚糖包封高良姜乙醇提取物的概率增大,因此载药量一直升高。但随着芯材的比例增加,壁材的比例相对减少,阿拉伯胶和壳聚糖发生电荷相互作用形成微囊的壁变薄,当芯壁比增大到2∶1时,形成的微囊变得不稳定,可能使复合壁材破裂,原本包封的芯材释放出来,导致包封率反而有所降低。综合考虑载药量和包封率,选择芯壁比1∶1为最佳芯壁比。

图2 芯壁比对高良姜乙醇提取物微囊载药量和包封率的影响Figure 2 Effect of core to wall ratio on drug loading and encapsulation efficiency of microcapsules of galangal ethanol extract
2.3.3 凝聚时间 固定壁材比为3∶1,芯壁比为1∶3,壁材浓度分别为阿拉伯胶液2%、壳聚糖0.5%,设定凝聚时间分别为15、30、45、60 min,测定载药量和包封率。
由图3可知,随着凝聚时间的增加,高良姜乙醇提取物微囊的载药量先略微升高后又略微降低,包封率先逐渐升高后降低。可能是伴随着凝聚时间的增长,阿拉伯胶和壳聚糖发生电荷相互作用形成微囊增多,但凝聚时间达到45 min 后,伴随着凝聚时间的增长,溶液内微囊变多,原本包封的芯材和壁材相对变少,比例也相对减少,阿拉伯胶和壳聚糖发生电荷相互作用形成微囊变得不稳定,可能使复合壁材破裂,原本包封的芯材释放出来,导致载药量和包封率反而有所降低。综合考虑载药量和包封率,选择凝聚时间为45 min为最佳条件。

图3 凝聚时间对高良姜乙醇提取物微囊载药量和包封率的影响Figure 3 Effect of coacervation time on drug loading and encapsulation efficiency of microcapsules of galangal ethanol extract
2.3.4 固化剂用量 固定壁材比为3∶1,芯壁比为1∶3,壁材浓度分别为阿拉伯胶液2%、壳聚糖0.5%,设定固化剂用量分别为1.5、3、4.5、6 mL,测定载药量和包封率。
由图4可知,随着固化剂用量增加,高良姜乙醇提取物微囊的载药量先略微增高后基本保持稳定,包封率先增加后基本保持稳定。其主要原因是甲醛中的醛基与壳聚糖中氨基发生Schiff 碱作用,使其与壳聚糖分子间产生了化学交联,具有了较好的包封性。提高固化剂的用量,有利于微囊的形成。体系中氨基大部分已反应,因此继续增加固化剂用量对形成微囊的影响便不再显著。综合考虑载药量和包封率,选择固化剂用量3 mL为最佳条件。

图4 固化剂用量对高良姜乙醇提取物微囊载药量和包封率的影响Figure 4 Effect of curing agent dosage on drug loading and encapsulation efficiency of microcapsules of galangal ethanol extract
2.4 正交试验法探究高良姜乙醇提取物微囊的最佳制备工艺
2.4.1 正交试验设计 采用正交试验法探究复合凝聚法制备高良姜乙醇提取物微囊的最佳条件,确定影响微囊载药量和包封率的显著因素。综合前述的单因素试验结果,确定本次正交试验的模型为L9(34),即包括4 个因素[壁材比(A)、芯壁比(B)、凝聚时间(C)和固化剂用量(D)]和3 个水平,并选择载药量和包封率作为评价指标来安排试验,所选因素和水平见表1。

表1 复合凝聚法制备工艺的因素和水平Table 1 Factors and levels of preparation process of composite coacervation method
以载药量为评价指标,从表2 中极差R值大小可以看出,各因素作用主次均为A>B>C>D,对载药量的影响最小者为D项,所以把D项作为误差相处理,进行方差分析;以包封率为评价指标,从表2 中极差R值大小可以看出,各因素作用主次均为B>A>D>C,对包封率的影响最小者为C项,所以把C项作为误差相处理进行方差分析。
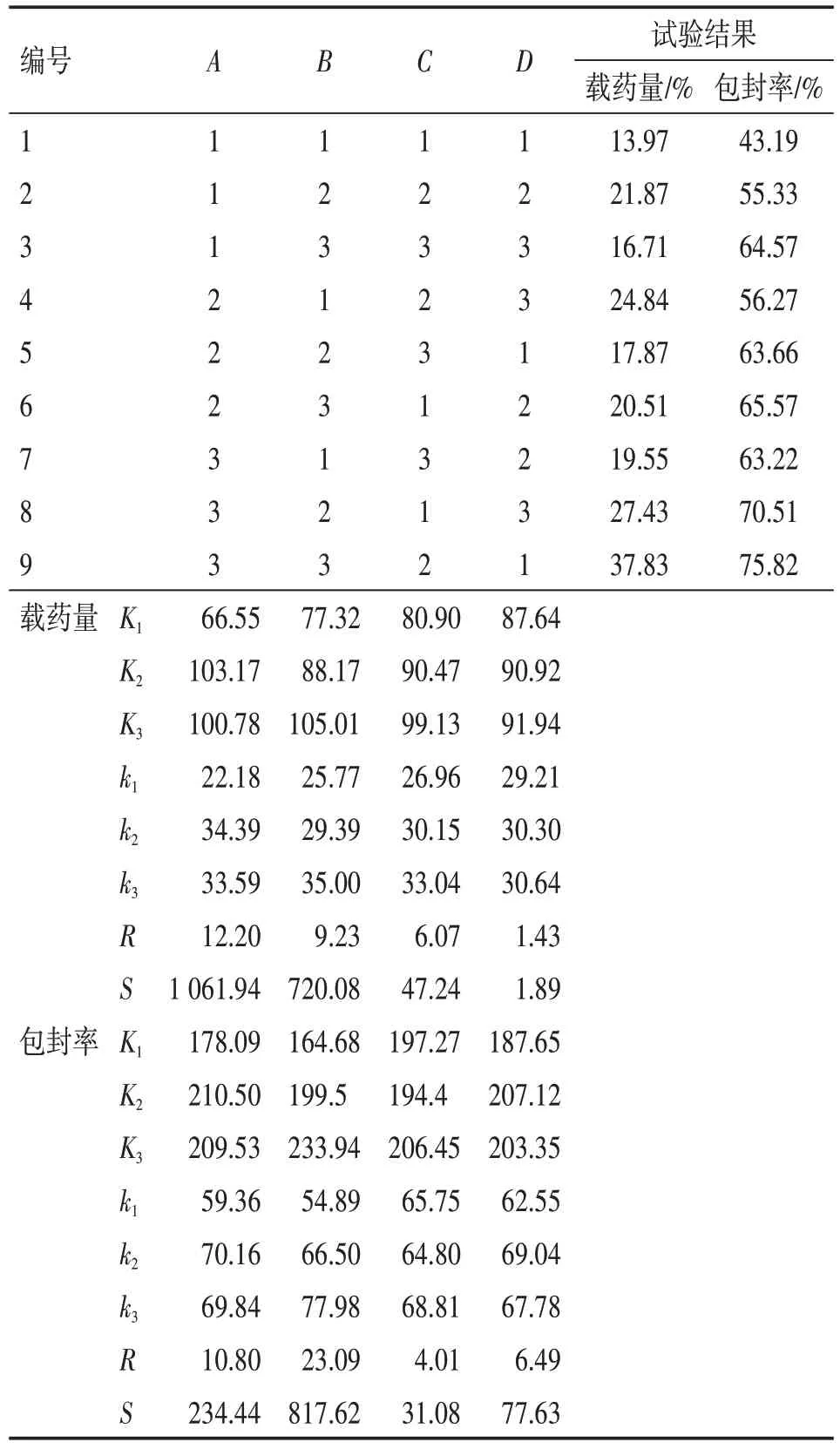
表2 正交试验法制备高良姜乙醇提取物微囊的试验结果及分析Table 2 The experimental results and analysis of the preparation of microcapsules of galangal ethanol extract by orthogonal test
从表3 可知,以载药量为评价指标时,A、B、C的P值均小于0.05,因此,A、B、C三个因素对高良姜乙醇提取物微囊的载药量影响均有显著性意义,以A3B3C3D2为最佳。以包封率为评价指标时B因素的P值小于0.05,因此,B因素对高良姜乙醇提取物微囊包封率的影响具有显著性意义,以A3B3C3D2为最佳。对药物的载药量和包封率进行全面分析,最终确定A3B3C3D2为最优制备条件。即壁材比为6∶1,芯壁比为1∶1,凝聚时间为45 min 和固化剂用量为3 mL。
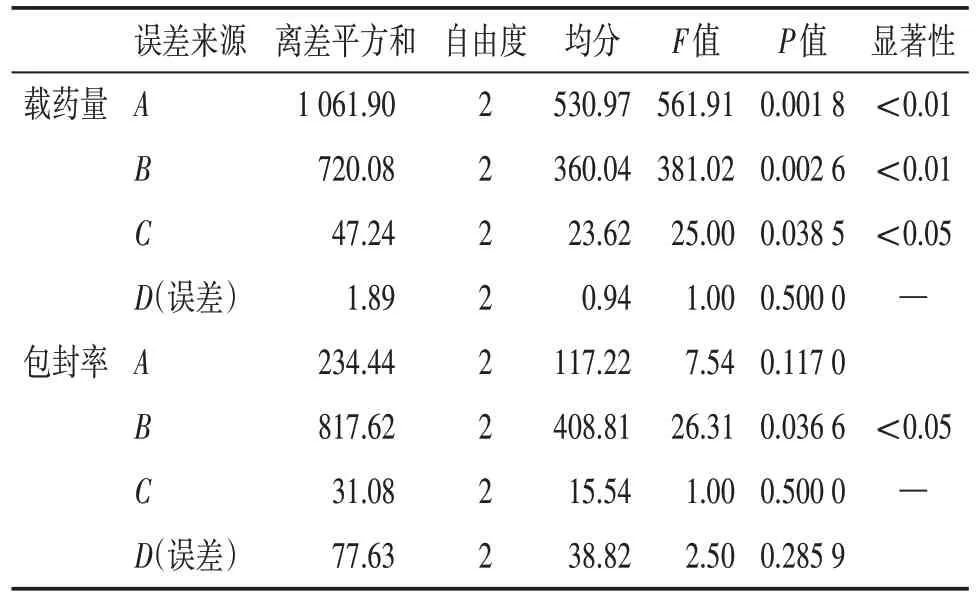
表3 正交试验法制备高良姜乙醇提取物微囊的方差分析Table 3 Analysis of variance of microcapsules of galangal ethanol extract prepared by orthogonal test
2.4.2 高良姜乙醇提取物微囊最优制备工艺的验证试验 根据正交试验所得数据进行分析,以高良姜乙醇提取物微囊的载药量和包封率为指标,筛选出最优工艺,根据该工艺平行制备3 组样品,以进一步验证最优工艺的准确性。由表4可知,本研究选取A3B3C3D2最佳制备工艺进行最佳制备工艺验证,载药量为27.17%(±2%),包封率80.07%(±2%),综合考虑包封率与载药量,最佳制备工艺条件下所制得高良姜乙醇提取物微囊的载药量与包封率均高于单因素试验与正交试验中的微囊。
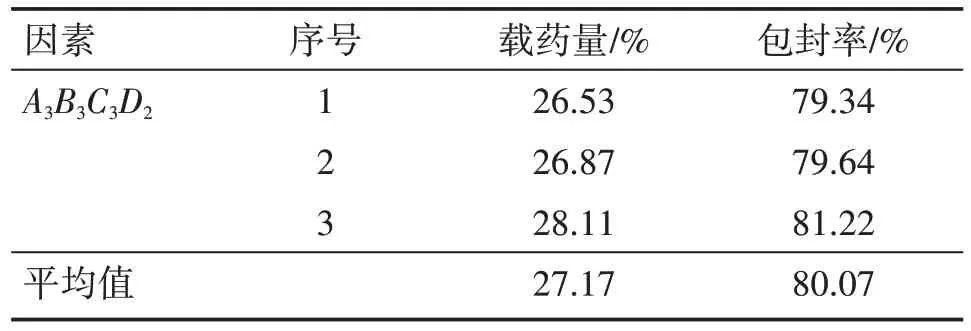
表4 高良姜乙醇提取物微囊的验证试验结果Table 4 The verification test results of microcapsules of galangal ethanol extract
2.5 高良姜乙醇提取物微囊的HPLC分析
2.5.1 色谱条件 色谱柱:Pgrandsil C18(250 mm×4.6 mm,5 µm);流动相:乙腈-0.2%磷酸溶液(57∶43);流速:1.0 mL/min;柱温:30 ℃;检测波长:254 nm;进样量:10µL。
2.5.2 对照品溶液的制备 精密称取高良姜乙醇提取物33.30 mg 置于10 mL 量瓶中,加入少量甲醇超声溶解后,定容。分别量取该溶液0.01、0.05、0.1、0.2、0.3、0.4、0.5 mL 并置于10 mL 容量瓶中,使用甲醇定容至刻度,摇匀,滤过,即得对照品溶液,避光冷藏备用。
2.5.3 供试品溶液的制备 准确称量0.1 g干燥高良姜乙醇提取物微囊置于10 mL容量瓶中,加入甲醇超声至微囊壁完全破裂,冷却后用甲醇补足定容,摇匀即得供试品溶液。
2.5.4 标准曲线的绘制 精密吸取对照品溶液10 µL 进样,测定其峰面积,根据测定结果建立以峰面积为纵坐标(y)、以溶液质量浓度为横坐标(x)的标准曲线,可得到回归方程为y=42 983x+4 827.3(R²=0.999 9)。结果表明,高良姜乙醇提取物的浓度在3.33 ~166.50µg/mL 时,其浓度与峰面积呈现良好的线性关系。见表5、图5。
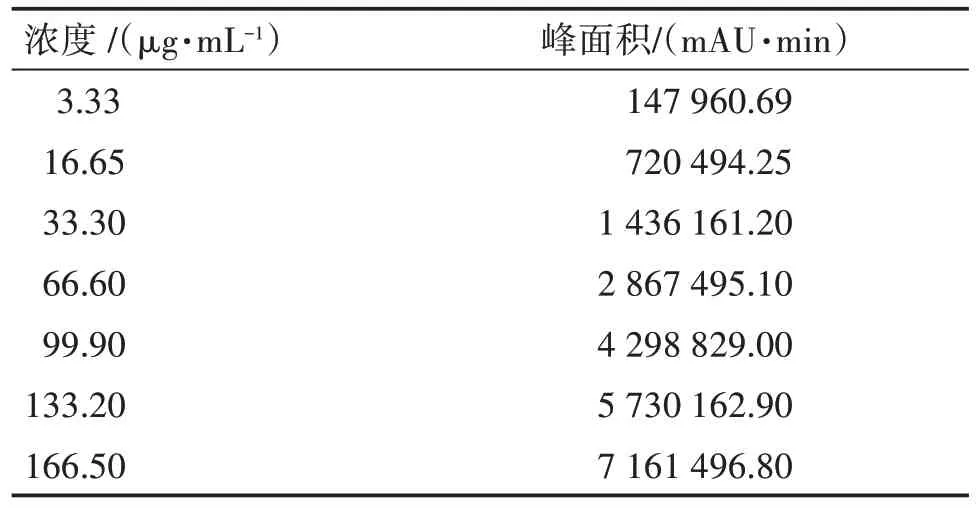
表5 高良姜乙醇提取物标准曲线数据Table 5 Standard curve data of galangal ethanol extract

图5 高良姜乙醇提取物的标准工作曲线Figure 5 Standard working curve of galangal ethanol extract
2.5.5 高良姜乙醇提取物微囊的HPLC分析 HPLC测定微囊中高良姜乙醇提取物有效成分含量,1 峰为高良姜素,结果表明:高良姜乙醇提取物微囊中有效成分和助剂等杂质完全分离,峰形对称,且保留时间较短,节约了分析时间。与标样色谱图对比,微囊包裹的高良姜乙醇提取物含量更高,证明高良姜乙醇提取物微囊的稳定性更佳。HPLC色谱图见图6。
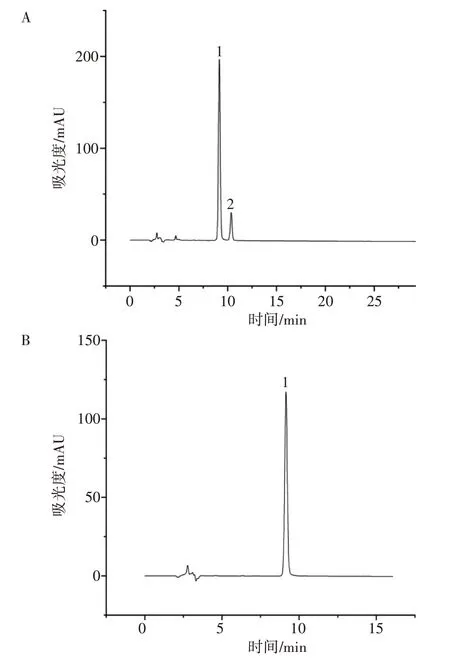
图6 高良姜乙醇提取物微囊(A)与标样(B)的HPLC色谱图Figure 6 HPLC chromatograms of microcapsules of galangal ethanol extract(A)and standard samples(B)
2.5.6 溶出度的测定 称取高良姜乙醇提取物微囊适量,置于溶出度测定仪,设定温度为(37 ±0.5)℃,溶出介质为磷酸盐缓冲液(PBS,pH6.8)[8]900 mL,以100 r/min 转速搅拌,分别在0.5、1、2、3、4、6、8、10、12 h 各取5 mL 溶出液(同时向溶出杯中补加5 mL PBS),用微孔滤膜滤过,取续滤液3 批(批号为样品A、样品B、样品C)在254 nm 波长处测定吸光度,按“2.5.4”项下标准曲线计算累积溶出度。
由图7可知,高良姜乙醇提取物微囊在试验开始的0.5 h 内未出现明显的突释现象,1 h 内囊壁中的药物与部分囊芯药物释放,1 ~12 h 囊芯药物释放较为平稳,避免了普通药物制剂的峰谷波动情况出现,说明此工艺条件下制备的高良姜乙醇提取物微囊具有一定的缓释性能。
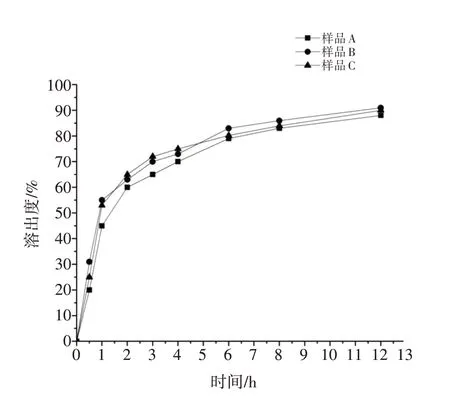
图7 高良姜乙醇提取物的溶出度曲线Figure 7 Dissolution profiles of galangal ethanol extract
2.6 方法学考察
2.6.1 稳定性 取同一份高良姜乙醇提取物微囊供试品溶液,分别于制备后0、2、4、8、12、24 h时进样,按“2.5.1”项下的色谱条件进行测定保留时间和峰面积。并计算峰面积的相对标准偏差(RSD)值。
表6可知,峰面积的RSD 为1.43%,结果表明该供试品在24 h内基本稳定。

表6 稳定性考察结果Table 6 Stability test results(n=6)
2.6.2 精密度 精密吸取某一浓度的对照品溶液,连续进样6次测定保留时间和峰面积,峰面积的RSD 为1.70%,结果表明该仪器的精密度良好。具体结果见表7。
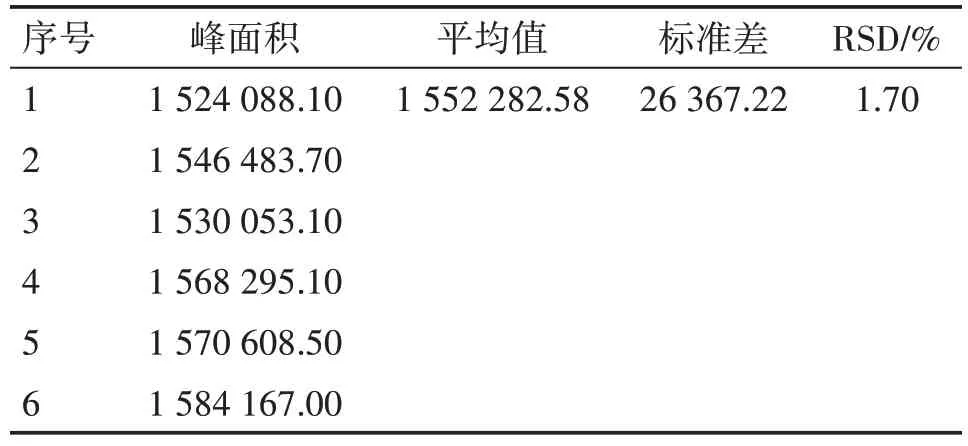
表7 精密度考察结果Table 7 Precision test results(n=6)
2.6.3 重复性 精密称取供试品溶液6 份,分别进样,测定保留时间和峰面积,峰面积的RSD 为0.81%,结果表明该方法具有良好的重复性。见表8。
表8 重复性考察结果Table 8 Repeatability examination results(n=6)
2.6.4 加样回收率 取已知含量的高良姜乙醇提取物6份,精密加入一定量的对照品,制备成供试品溶液,进样测定,计算加样回收率和RSD 值。由表9 可知回收率的RSD 为1.26%,结果说明加样回收率良好,方法可行。

表9 加样回收考察结果Table 9 Results of sample recovery
2.7 扫描电镜(SEM)分析由图8 SEM 结果显示,高良姜乙醇提取物微囊基本形状为光滑的球形,几乎不具有凹陷和不规则的表面以及不规则块状,未发现表面出现褶皱、裂缝的微囊,表明高良姜乙醇提取物已被较好地包覆在囊壁材料中[9-10]。

图8 高良姜乙醇提取物微囊扫描电镜图Figure 8 Scanning electron micrograph of microcapsules of galangal ethanol extract
2.8 高良姜乙醇提取物微囊的傅里叶红外光谱(FTIR)分析利用FTIR 光谱对阿拉伯胶(A)、壳聚糖(B)、高良姜素(C)、ABC 物理混合物(D)和高良姜乙醇提取物微囊(E)进行表征,结果如图9所示。
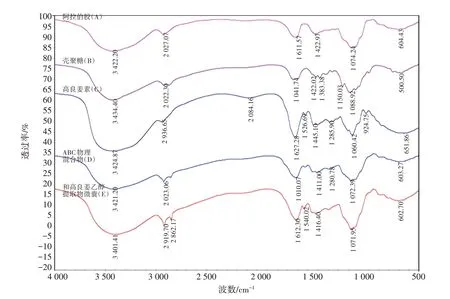
图9 阿拉伯胶(A)、壳聚糖(B)、高良姜素(C)、ABC物理混合物(D)和高良姜乙醇提取物微囊(E)的红外光谱分析Figure 9 Infrared spectrum analysis of gum arabic(A),chitosan(B),galangin(C),ABC physical mixture(D)and microcapsules of galangin ethanol extract(E)
从图9 中可以看到,ABC 物理混合物(D)的红外光谱和高良姜乙醇提取物微囊(E)的红外光谱有相似之处,如:与壳聚糖(B)相比,D 和E在1 525.69 cm-1处都有一个酰胺Ⅱ谱带(N-H)的吸收峰消失;而且与阿拉伯胶(A)相比,D 和E在1 611.57 cm-1处的-COO-对称伸缩振动和在1 422.97 cm-1处的非对称伸缩振动吸收峰也都消失。这明显表示阿拉伯胶中的-COO 和壳聚糖中的-NH2 之间发生了静电相互作用[11]。但两者又有明显的区别,在高良姜乙醇提取物微囊(E)的FTIR谱图中可观察到在1 540.02 cm-1处C=N 的伸缩振动吸收峰,这是因为加入甲醛后,甲醛中的醛基和壳聚糖中的氨基发生Schiff 碱反应,生成的C=N键。此外,在1 071.95 cm-1处存在的C-O的伸缩振动吸收峰明显增强,这是因为甲醛和壳聚糖反应,使得体系中的C-O 键增多。这证明了壳聚糖和甲醛已发生反应,表明甲醛成功对壳聚糖进行交联。
3 讨论
本研究采用单因素与正交设计法进行考察研究,因考虑到高良姜有效成分高良姜素不溶于水,而复合凝聚法具有不使用有机溶剂和化学交联剂的优势,还可以将非水溶性液体微囊化,产率较高,所以采用以阿拉伯胶、壳聚糖为囊壁材料。高良姜素为囊芯材料,采用复合凝胶法制备高良姜乙醇提取物微囊,并对高良姜乙醇提取物微囊的制备工艺进行优化研究。通过高效液相法进行含量测定发现2种工艺获得的最优工艺参数为:壁材比为6∶1,芯壁比为1∶1,凝聚时间为45 min,固化剂用量为3 mL。制备的高良姜乙醇提取物微囊,其载药率和包封率分别达到27.17%和80.07%。通过傅里叶红外光谱分析确定高良姜乙醇提取物微囊的囊材阿拉伯胶和壳聚糖在固化剂甲醇的交联固化作用下交联形成微囊,具有较好的包封性。
高良姜中含有多种有效成分,其中主要包括挥发油、黄酮类、姜油酮类、酚酸类、有机酸类等,对多种胃病的治疗和改善肠胃微循环具有很好的作用。但高良姜乙醇提取物是从单一的高良姜中药材中提取出来的,对其中活性单体的药效学研究较少[12]。复合凝聚法制备条件较为温和,生产效率高,制备的微囊具有较好的环境耐受性和可控释放能力,对高良姜乙醇提取物的质构和稳定性都具有重要的作用。因此,深入研究复合凝聚法微囊制备机理,可控制备不同特性的微囊化产品,对于中药复方的深入研究,尤其是其中的化学成分,以及对其进行分离鉴定和对中药复方的作用机理等方面的研究具有十分重要的理论意义和实践价值[13]。

