急性心肌梗死外周血单个核细胞中CUX1、CTSD表达水平及其对预后的诊断价值
宋宁 石杨 蔡建叶 张晓荷 靳蕊 张秀英 马培梁

基金项目 甘肃省卫生行业科研计划项目(No.GSWSKY-201920)
作者单位 1.中国人民解放军联勤保障部队第九四医院(兰州 730050);2.甘肃省人民医院(兰州 730000)
通讯作者 马培梁,E-mail:mpl1232@163.com
引用信息 宋宁,石杨,蔡建叶,等.急性心肌梗死外周血单个核细胞中CUX1、CTSD表达水平及其对预后的诊断价值[J].中西医结合心脑血管病杂志,2024,22(7):1296-1300.
摘要 目的:探讨急性心肌梗死(AMI)病人外周血单个核细胞(PBMC)中剪样同源盒1(CUT1)、组织蛋白酶D(CTSD)表达及两者对AMI预后的诊断价值。方法:选取2019年2月—2020年2月我院诊治的96例AMI病人为研究对象,根据随访1年内AMI病人是否发生主要不良心血管事件(MACE),将AMI病人分为预后不良组(32例)和预后良好组(64例)。以同期我院进行健康体检的60名健康者为对照组。应用荧光定量聚合酶链式反应(PCR)检测各组病人PBMC中CUX1、CTSD的表达。比较各组CUX1、CTSD水平、临床生化指标及心功能指标。采用Pearson相关分析法分析AMI病人CUX1、CTSD表达与临床生化指标及心功能的相关性。采用多因素Logistic回归分析AMI病人MACE发生的影响因素。受试者工作特征(ROC)曲线分析CUX1、CTSD对AMI病人MACE发生的诊断效能。结果:与对照组比较,AMI预后良好组及预后不良组病人PBMC中CUX1、CTSD表达明显升高,差异均有统计学意义(P<0.05)。与预后良好组比较,预后不良组AMI病人PBMC中CUX1、CTSD表达及超敏肌钙蛋白T(hs-cTnT)、N末端脑钠肽前体(NT-proBNP)明显升高,左室射血分数(LVEF)、左室短轴缩短率(LVFS)及心排血量(CO)明显降低,差异均有统计学意义(P<0.05)。AMI病人PBMC中CUX1、CTSD表达与hs-cTnT、NT-proBNP呈正相关,与LVEF、LVFS及CO呈负相关(P<0.05)。hs-cTnT升高、LVEF降低、CUX1升高及CTSD升高是AMI病人MACE发生的独立危险因素(P<0.05)。CUX1、CTSD及二者联合检测预测AMI病人MACE的曲线下面积(AUC)分别为0.776、0.874及0.910。二者联合检测预测AMI病人MACE的AUC显著高于单一指标检测。结论:AMI病人PBMC中CUX1、CTSD表达升高,是影响AMI病人不良预后的独立危险因素,两者联合检测有助于判断AMI病人临床预后。
关键词 急性心肌梗死;外周血单个核细胞;剪样同源盒1;组织蛋白酶D;预后
doi:10.12102/j.issn.1672-1349.2024.07.025
急性心肌梗死(acute myocardial infaction,AMI)是常见的心血管系统危急重症。我国AMI的发病率为45/10万,死亡率为32/10万,且AMI发病呈年轻化趋势[1]。AMI可引起乳头肌功能失调、心力衰竭、恶性心律失常及心源性死亡等并发症,导致病人预后不良。深入研究AMI的疾病机制,寻找能够评估AMI的预后标志物,积极采取个体化的防治措施,对改善病人预后意义重大。剪样同源盒1(cut like homeobox 1,CUX1)编码基因位于7号染色体,编码蛋白属于DNA结合蛋白同源域家族成员,在调节基因表达、细胞形态发生和分化及细胞周期进程中发挥重要作用[2]。有研究对AMI病人外周血单个核细胞(peripheral blood mononuclear cells,PBMC)基因表达进行高通量筛选,发现CUX1表达上调可能是预测AMI后发生心力衰竭的潜在生物标志物[3]。组织蛋白酶D(cathepsin D,CTSD)是多肽酶A1家族的成员,成熟的CTSD能够蛋白水解激素和生长因子等多种蛋白质产物,参与恶性肿瘤及神经退行性疾病等的发生发展过程[4-5]。研究发现,CTSD表达能够通过激活心肌细胞自噬,促进心脏结构重塑,与ST段抬高型心肌梗死(STEM)病人早期发生心功能障碍密切相关[6]。因此,本研究通过检测AMI病人PBMC中CUX1、CTSD的表达,分析两者与AMI预后的关系。
1 对象与方法
1.1 研究对象
选取2019年2月—2020年2月我院诊治的96例AMI病人为研究对象。纳入标准:1)AMI的诊断结合病人临床表现、心电图检查、心肌损伤标志物及冠状动脉造影等。STEMI的诊断符合2019年中华医学会心血管病学分会制定的《急性ST 段抬高型心肌梗死诊断和治疗指南(2019)》[7],非STEMI的诊断符合2016年制定的《非ST段抬高型急性冠状动脉综合征诊断和治疗指南(2016)》[8]。2)临床及实验室检查资料完整。3)病人及家属对本研究知情同意,能够配合相关检查及随訪。排除标准:1)伴有先天性心脏病或心肌炎等疾病;2)伴有恶性肿瘤、肝肾功能障碍等疾病;3)伴有自身免疫性疾病或感染性疾病。以同期进行健康体检的60名健康者作为对照组。本研究经本院伦理委员会审核批准。
1.2 随访及预后分组
所有AMI病人确诊后开始进行随访,每个月随访1次,连续随访1年,随访内容为主要不良心血管事件(major adverse cardiovascular events,MACE)的发生情况,包括心力衰竭、心源性死亡、再发性心肌梗死及靶血管血运重建。发生MACE的AMI病人纳入预后不良组(32例),未发生MACE的AMI病人纳入预后良好组(64例)。
1.3 研究方法
1.3.1 资料收集
1)收集研究对象的临床资料,包括性别、年龄、体质指数、高血压病史、糖尿病病史、吸烟史。2)收集实验室检查指标及心肌损伤指标,包括肌酸激酶同工酶(CK-MB)、超敏肌钙蛋白T(hs-cTnT)、N-末端脑钠肽前体(NT-proBNP)、三酰甘油、总胆固醇、高密度脂蛋白胆固醇和低密度脂蛋白胆固醇。收集心脏彩超检查结果包括左室射血分数(LVEF)、左室短轴缩短率(LVFS)及心排血量(CO)。
1.3.2 PBMC中CUX1、CTSD表达检测
收集研究对象入院后静脉血5mL,肝素抗凝,2 500 r/min离心5 min,将下层血细胞转入15 mL无菌离心管,加入外周血淋巴细胞分离液3 mL(购自上海爱必信公司,货号abs930),梯度密度离心法进行离心,2000 r/min,离心20min,吸取中间PBMC层细胞。应用Trizol法提取PBMC中的总RNA。采用NaroDrop1000(美国赛默飞公司)检测总RNA的浓度和纯度,OD260/OD280比值为1.8~2.1。应用逆转录试剂盒(日本TAKARA公司)将总RNA逆转录为cDNA。然后进行实时荧光定量聚合酶链式反应(qRT-PCR)。引物由上海生工公司设计合成。CUX1正向引物为5′-GAAGAACCAAGCCGAAACCAT-3′,反向引物为5′- AGGCTCTGAACCTTATGCTCA-3′;CTSD正向引物为5′-TGCAAAGGCCGACGAGATT-3′,反向引物为5′-GGTCTCCGCCTCTCTCTGAG-3′;以甘油醛-3-磷酸脱氢酶(GAPDH)为内参,正向引物为5′-TGCTCAAGAACTACATGGACGC-3′ ,反向引物为5′-CGAAGACGACTGTGAAGCACT-3′。反应体系包括cDNA 2 μL,正反向引物2 μL和SYBR Premix 10 μL,双蒸水6 μL。反应条件:95 ℃ 5 min,95 ℃ 15 s,62 ℃ 5 s,70 ℃ 10 s,重复40个循环。PBMC中CUX1、CTSD的相对表达量采用2-ΔΔCT法表示。
1.4 统计学处理
应用SPSS 22.0统计软件进行数据分析。定量资料经K-S正态性检验,符合正态分布的定量资料以均数±标准差(x±s)表示,两组间比较采用两独立样本t检验,3组比较采用单因素方差分析,组间两两比较采用SNK-q检验。定性资料以例数、百分比(%)表示,组间比较采用χ2检验。采用Pearson相关分析法分析指标之间的相关性。多因素Logistic回归分析影响AMI病人MACE发生的因素。采用受试者工作特征(ROC)曲线分析CUX1、CTSD对AMI病人MACE发生的诊断效能。以P<0.05为差异有统计学意义。
2 结 果
2.1 3组PBMC中CUX1、CTSD表达比较
与对照组比较,预后良好组及预后不良组PBMC中CUX1、CTSD表达明显升高,差异均有统计学意义(P<0.05)。与预后良好组比较,预后不良组AMI病人PBMC中CUX1、CTSD表达明显升高,差异均有统计学意义(P<0.05)。详见表1。
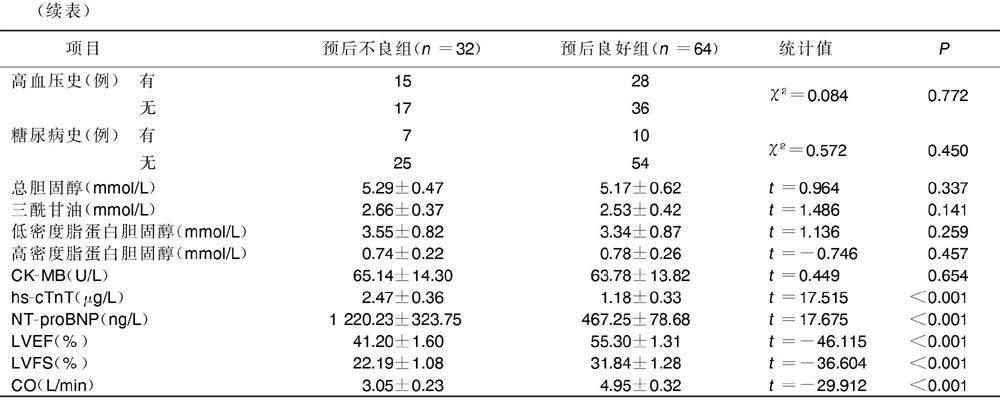
2.2 不同预后AMI病人一般资料、临床生化指标及心功能指标比较
预后良好组与预后不良组AMI病人年龄、性别、体质指数、吸烟史、高血压史、糖尿病史、三酰甘油、总胆固醇、低密度脂蛋白胆固醇、高密度脂蛋白胆固醇及CK-MB比较,差异均无统计学意义(P>0.05)。与预后良好组比较,预后不良组hs-cTnT、NT-proBNP水平明显升高,LVEF、LVFS及CO明显降低,差异均有统计学意义(P<0.05)。详见表2。
2.3 AMI病人PBMC中CUX1、CTSD表达与临床生化指标及心功能指标的相关性
AMI病人PBMC中CUX1、CTSD表达与hs-cTnT、NT-proBNP呈正相关,与LVEF、LVFS及CO呈负相关,与CK-MB无明显相关性。详见表3。
以AMI病人是否发生MACE为因变量(发生MACE=1,未发生MACE=0),将hs-cTnT、NT-proBNP、LVEF、LVFS、CO、CUX1及CTSD作为自变量,进行多因素Logistic回归分析。结果显示:hs-cTnT升高、LVEF降低、CUX1升高及CTSD升高是AMI病人MACE发生的独立危险因素(P<0.05)。详见表4。
2.5 AMI病人PBMC中CUX1、CTSD表达对MACE的预测价值
ROC曲线显示,PBMC中CUX1、CTSD及二者联合检测预测AMI病人MACE的曲线下面积(AUC)分别为0.776(0.705,0.846)、0.874(0.827,0.921)及0.910(0.879,0.941)。二者联合检测预测AMI病人MACE的AUC显著高于单一指标(Z值分别为4.186,3.469,P均<0.001)。详见表5、图1。
3 讨 论
早期识别具有较高MACE风险的AMI病人是改善病人临床预后的有效策略。近年来,有學者报道,检测外周血血小板、缺血修饰白蛋白
等有助于判断AMI后心力衰竭等MACE的发生[9-10]。但目前临床尚无有效的早期生物标志物用于预测AMI病人的临床预后。PBMC的主要细胞成分为单核细胞,是AMI后心脏重塑的重要调节因子[11]。研究表明,在心肌损伤后数小时以内,单核细胞能够迅速从骨髓和脾脏转移到外周血中并浸润心肌梗死区域,参与炎症反应,虽然单核细胞有利于促进新生血管生成,但单核细胞/巨噬细胞能够激活心肌细胞心脏重塑相关基因的表达,引起心脏重塑[12],还可加重斑块负荷,降低斑块稳定性。因此,通过检测PBMC中基因表达可能有助于早期识别MACE风险较高的AMI病人,并作为新的判断AMI病人预后的生物标志物。
CUX1作为一种转录因子,具有DNA结合结构域,能够促进DNA糖基化酶-1的表达。研究表明,CUX1的表达缺失会导致细胞DNA损伤修复延迟并增强辐射敏感性,在肿瘤中发挥肿瘤抑制因子的作用[13]。研究发现,CUX1表达异常下调抑制心肌细胞分化过程,与先天性心脏病埃博斯坦畸形的发生有关[14]。近年来,有学者利用高通量二代测序发现,CUX1在AMI继发心力衰竭病人PBMC中表达明显升高,可能是一种新的提示AMI病人预后的生物标志物[3]。本研究发现,AMI病人PBMC中CUX1表达明显升高,并且其表达水平与心肌损伤指标hs-cTnT、NT-proBNP呈正相关,与心功能指标LVEF、LVFS及CO呈负相关,提示CUX1表达升高可能加重AMI心肌损伤,降低病人心功能。分析其原因,与CUX1对炎症微环境的调节有关。研究表明,CUX1的表达能够通过结合IκBζ,促进巨噬细胞中肿瘤坏死因子和白细胞介素17A等细胞因子及趋化因子如趋化因子配体1(CXCL1)、趋化因子配体2(CXCL2)等的表达,招募中性粒细胞及单核巨噬细胞的募集,促进局部组织的炎症损伤反应,并激活基质成纤维细胞,促进心肌重塑[14]。本研究中,CUX1升高是AMI病人MACE发生的独立危险因素,提示检测CUX1有助于预测AMI病人不良心血管事件的发生。研究发现,CUX1的表达上调能够激活Jacus相关激酶2/信号传导和转录激活因子3通路,誘导心肌细胞肥大[15]。因此,PBMC中CUX1的表达升高可通过加重AMI病人的心肌损害,降低斑块稳定性,导致AMI后缺血事件和再梗死事件的发生。
CTSD编码蛋白是一种溶酶体天冬氨酰蛋白酶,参与蛋白质的代谢分解。CTSD不仅参与生长因子、激素和酶前体的激活、抗原的加工和细胞凋亡的调节等多种生理过程,还参与包括动脉粥样硬化、癌症、心血管疾病等的发生过程[16-17]。本研究结果显示,AMI病人PBMC中CTSD表达明显升高。分析其原因,AMI发生后单核/巨噬细胞聚集到动脉粥样硬化斑块区域,在氧化的低密度脂蛋白或7β-羟基胆固醇作用下,巨噬细胞发生细胞凋亡,同时氧化的脂质会导致溶酶体不稳定,溶酶体酶CTSD渗漏到细胞质中,引起CTSD表达水平明显增加[18]。本研究中,CTSD的表达与hs-cTnT、NT-proBNP呈正相关,与LVEF、LVFS及CO呈负相关,提示CTSD的表达与AMI的疾病严重程度有关。研究表明,缺血再灌注损伤后心肌细胞CTSD表达升高,诱导心肌细胞自噬的发生,细胞内磷脂酰肌醇3激酶/自噬基因BeclinⅠ途径显著激活,加重心肌细胞的损伤和心肌重塑,促进AMI的进展[19-20]。本研究结果显示,CTSD升高是AMI病人MACE发生的独立危险因素,表明CTSD有助于预测AMI病人不良心血管事件的发生。其原因一方面是CTSD可通过诱导巨噬细胞凋亡,进而增加动脉粥样硬化斑块易损性[18];另一方面,CTSD表达水平升高能够直接降解纤维帽的细胞外基质蛋白成分,增加AMI病人再次发生急性冠脉综合征的风险[21]。
本研究进一步利用ROC曲线分析发现,PBMC中CUX1、CTSD及二者联合检测预测AMI病人MACE发生的AUC显著高于单一指标,二者联合诊断的敏感度和特异度分别为0.831,0.802。表明二者联合检测对AMI病人MACE具有较高的预测价值,可能是新的预后判断的生物标志物。临床医师可根据PBMC中CUX1、CTSD水平,对AMI病人的预后进行评估,以采取相应的诊治措施,改善AMI病人的临床预后。
综上所述, AMI病人PBMC中CUX1、CTSD表达升高,两者表达与心肌损伤指标hs-cTnT、NT-proBNP呈正相关,与心功能指标LVEF、LVFS及CO呈负相关,是AMI病人MACE预后的独立危险因素。CUX1、CTSD联合检测对AMI病人MACE具有较高的诊断效能。但由于本研究样本量有限,未能对AMI病人进行分层分析,有待今后设计多中心的临床试验扩大样本量,深入评估CUX1、CTSD在AMI诊断及预后评估中的临床应用价值。
参考文献:
[1] 中国心血管健康与疾病报告编写组.中国心血管健康与疾病报告2020概要[J].中国循环杂志,2021,36(6):521-545.
[2] DERMAWAN J K,WENSEL C,VISCONTE V,et al.Clinically significant CUX1 mutations are frequently subclonal and common in myeloid disorders with a high number of co-mutated genes and dysplastic features[J].American Journal of Clinical Pathology,2022,157(4):586-594.
[3] CHEN Q X,YIN Q J,SONG J X,et al.Identification of monocyte-associated genes as predictive biomarkers of heart failure after acute myocardial infarction[J].BMC Medical Genomics,2021,14(1):44.
[4] SECOMANDI E,SALWA A,VIDONI C,et al.High expression of the lysosomal protease cathepsin D confers better prognosis in neuroblastoma patients by contrasting EGF-induced neuroblastoma cell growth[J].International Journal of Molecular Sciences,2022,23(9):4782.
[5] BUNK J,PRIETO HUARCAYA S,DROBNY A,et al.Cathepsin D variants associated with neurodegenerative diseases show dysregulated functionality and modified α-synuclein degradation properties[J].Frontiers in Cell and Developmental Biology,2021,9:581805.
[6] YAMAC A H,SEVGILI E,KUCUKBUZCU S,et al.Role of cathepsin D activation in major adverse cardiovascular events and new-onset heart failure after STEMI[J].Herz,2015,40(6):912-920.
[7] 中華医学会心血管病学分会,中华心血管病杂志编辑委员会.急性ST段抬高型心肌梗死诊断和治疗指南(2019)[J].中华心血管病杂志,2019,47(10):766-783.
[8] 中华医学会心血管病学分会,中华心血管病杂志编辑委员会.非ST段抬高型急性冠状动脉综合征诊断和治疗指南(2016)[J].中华心血管病杂志,2017,45(5):359-376.
[9] 闫洁,袁森.急性心肌梗死PCI术后近期MACE的危险因素及血小板功能参数的预测作用[J].中国动脉硬化杂志,2020,28(12):1065-1072.
[10] 郑志远,张从艳,郑志霞.血清IMA、miR-1联合HEART评分对急性心肌梗死病人诊断及PCI术后预后评估的价值[J].中西医结合心脑血管病杂志,2022,20(11):2037-2040.
[11] ZIMMER A,BAGCHI A K,VINAYAK K,et al.Innate immune response in the pathogenesis of heart failure in survivors of myocardial infarction[J].American Journal of Physiology Heart and Circulatory Physiology,2019,316(3):H435-H445.
[12] SAGER H B,KESSLER T,SCHUNKERT H.Monocytes and macrophages in cardiac injury and repair[J].Journal of Thoracic Disease,2017,9(Suppl 1):S30-S35.
[13] ALY M,RAMDZAN Z M,NAGATA Y,et al.Distinct clinical and biological implications of CUX1 in myeloid neoplasms[J].Blood Advances,2019,3(14):2164-2178.
[14] SLOWIKOWSKI K,NGUYEN H N,NOSS E H,et al.CUX1 and IκBζ (NFKBIZ) mediate the synergistic inflammatory response to TNF and IL-17A in stromal fibroblasts[J].Proceedings of the National Academy of Sciences of the United States of America,2020,117(10):5532-5541.
[15] GAN X T,ZHAO G J,HUANG C X,et al.Identification of fat mass and obesity associated(FTO) protein expression in cardiomyocytes:regulation by leptin and its contribution to leptin-induced hypertrophy[J].PLoS One,2013,8(9):e74235.
[16] LIU L,DORAY B.Elevated mRNA expression and defective processing of cathepsin D in HeLa cells lacking the mannose 6-phosphate pathway[J].FEBS Open Bio,2021,11(6):1695-1703.
[17] DI Y Q,HAN X L,KANG X L,et al.Autophagy triggers CTSD(cathepsin D) maturation and localization inside cells to promote apoptosis[J].Autophagy,2021,17(5):1170-1192.
[18] LI W,YUAN X M.Increased expression and translocation of lysosomal cathepsins contribute to macrophage apoptosis in atherogenesis[J].Annals of the New York Academy of Sciences,2004,1030:427-433.
[19] ZHANG X,WEI M P,FAN J H,et al.Ischemia-induced upregulation of autophagy preludes dysfunctional lysosomal storage and associated synaptic impairments in neurons[J].Autophagy,2021,17(6):1519-1542.
[20] BA L N,GAO J Q,CHEN Y P,et al.Allicin attenuates pathological cardiac hypertrophy by inhibiting autophagy via activation of PI3K/Akt/mTOR and MAPK/ERK/mTOR signaling pathways[J].Phytomedicine,2019,58:152765.
[21] GONALVES I,HULTMAN K,DUNR P,et al.High levels of cathepsin D and cystatin B are associated with increased risk of coronary events[J].Open Heart,2016,3(1):e000353.
(收稿日期:2022-08-26)
(本文编辑王丽)

