花青素调节JAK2/STAT3信号通路对自身免疫性心肌炎大鼠Th17/Treg平衡的影响
胡孝鹏 纪晓 陈喜 龚芳 刘娟

摘要 目的:探討花青素对自身免疫性心肌炎(AE)大鼠T细胞17/调节性T细胞(Th17/Treg)平衡及Janus激酶2/信号转导和转录激活因子3(JAK2/STAT3)信号通路的影响。方法:将60只SD大鼠分为对照(NC)组、模型(Model)组、花青素组(50 mg/kg花青素)、STAT3激活剂Colivelin组(1 mg/kg Colivelin)、花青素+Colivelin组(50 mg/kg花青素+1 mg/kg Colivelin),每组12只。采用酶联免疫吸附实验(ELISA)检测血清炎性因子水平;苏木素-伊红(HE)染色检测心肌病理变化;末端脱氧核苷酸转移酶介导的dUTP缺口末端标记(TUNEL)染色检测心肌细胞凋亡;实时荧光定量聚合酶链式反应(RT-qPCR)检测脾脏维甲酸相关孤儿受体γt(RORγt)、叉头蛋白p3(Foxp3)mRNA表达情况;蛋白质免疫印迹法(Western Blot)检测心肌JAK2/STAT3通路相关蛋白表达。结果:Model组心肌明显坏死和水肿,大量炎性细胞浸润;花青素组心肌无明显的坏死和细胞肿胀;Colivelin组心肌损伤加重;与花青素组相比,花青素+Colivelin组大鼠炎性细胞浸润现象增加。与NC组相比,Model组白细胞介素(IL)-17、IL-23水平、RORγt mRNA水平、Th17细胞水平、Th17/Treg比例、心肌细胞凋亡率及磷酸化STAT3(p-STAT3)/STAT3、磷酸化JAK2(p-JAK2)/JAK2比例明显升高(P<0.05),IL-10、IL-4水平、Treg细胞水平、Foxp3 mRNA水平明显下降(P<0.05);与Model组比较,花青素组IL-17、IL-23水平、RORγt mRNA水平、Th17细胞水平、Th17/Treg比例、心肌细胞凋亡率以及p-STAT3/STAT3、p-JAK2/JAK2比例明显下降(P<0.05),IL-10、IL-4水平、Treg细胞水平、Foxp3 mRNA水平明显升高(P<0.05);Colivelin组对应指标呈相反趋势(P<0.05);与花青素组相比,花青素+Colivelin组IL-17、IL-23水平、RORγt mRNA水平、Th17细胞水平、Th17/Treg比例、心肌细胞凋亡率及p-STAT3/STAT3、p-JAK2/JAK2比例明显升高(P<0.05),IL-10、IL-4水平、Treg细胞水平、脾脏Foxp3 mRNA水平明显下降(P<0.05)。结论:花青素可能通过抑制JAK2/STAT3通路,恢复Th17/Treg平衡,实现对AE大鼠心肌的保护作用。
关键词 自身免疫性心肌炎;花青素;Janus激酶2/信号转导和转录激活因子3信号通路;T细胞17/调节性T细胞平衡;炎症反应;实验研究
doi:10.12102/j.issn.1672-1349.2024.07.012
Influence of Anthocyanins on Th17/Treg Balance in Autoimmune Myocarditis Rats by Regulating JAK2/STAT3 Signaling Pathway
HU Xiaopeng, JI Xiao, CHEN Xi, GONG Fang, LIU Juan
Huangshi Fifth Hospital, Huangshi 435000, Hubei, China
Corresponding Author LIU Juan, E-mail: liujuan1980@sina.com
Abstract Objective:To investigate the influences of anthocyanins on T helper-17 cells(Thl7)/regulatory T cell(Treg) balance and Janus kinase 2/signal transducer and activator of transcription 3(JAK2/STAT3) signaling pathway in autoimmune myocarditis(AE) rats.Methods:Sixty SD rats were randomly grouped into control(NC) group,Model group,anthocyanin group(50 mg/kg anthocyanin),STAT3 activator Colivelin group(1 mg/kg Colivelin),anthocyanin+Colivelin group(50 mg/kg anthocyanin+1 mg/kg Colivelin),with 12 rats in each group.Enzyme linked immunosorbent assay(ELISA) was used to detect the level of serum inflammatory factor.Hematoxylin-eosin(HE) staining was applied to detect myocardial pathological changes.Terminal-deoxynucleoitidyl Transferase Mediated Nick End Labeling(TUNEL) staining was applied to detect cardiomyocyte apoptosis.Real-time quantitative polymerasechain reaction(RT-qPCR) was applied to detect the expression of retinoid-related orphan receptorγt(RORγt) and fork-head box protein(Foxp3) mRNA in spleen.Western Blot was used to detect the expression of JAK2/STAT3 pathway related proteins in the myocardium.Results: In the Model group,myocardial necrosis and edema were obvious,and a large number of inflammatory cells were infiltrated;the myocardium in the anthocyanin group showed no evident necrosis or cell swelling;the myocardial injury was aggravated in the Colivelin group; inflammatory cell infiltration increased in the anthocyanin+Colivelin group.Compared with NC group,the levels of interleukin(IL)-17,IL-23,RORyt mRNA,Th17 cells,ratio of Th17/Treg,cardiomyocyte apoptosis rate,and ratios of p-STAT3/STAT3 and p-JAK2/JAK2 in Model group were greatly increased(P<0.05),the levels of IL-10,IL-4,Treg cells and FoxP3 mRNA were greatly decreased(P<0.05).Compared with the Model group,the levels of IL-17,IL-23,RORγt mRNA,Th17 cells,ratio of Th17/Treg,cardiomyocyte apoptosis rate,and ratios of p-STAT3/STAT3 and p-JAK2/JAK2 in anthocyanin group decreased(P<0.05),the levels of IL-10,IL-4,Treg cells and Foxp3 mRNA increased(P<0.05);the corresponding indicators in the Colivelin group showed the opposite trends(P<0.05).Compared with anthocyanin group,the levels of IL-17,IL-23,RORγt mRNA,Th17 cells,ratio of Th17/Treg,cardiomyocyte apoptosis rate,and ratios of p-STAT3/STAT3 and p-JAK2/JAK2 in anthocyanin+Colivelin group increased(P<0.05),the levels of IL-10,IL-4,Treg cells and Foxp3 mRNA decreased (P<0.05).Conclusion:Anthocyanins may restore the balance of Th17/Treg by inhibiting the JAK2/STAT3 pathway and achieve the protective effect on the myocardium of AE rats.
Keywords autoimmune myocarditis; anthocyanins; Janus kinase 2/signal transducer and activator of transcription 3 signaling pathway; T helper-17 cells/regulatory T cell balance; inflammatory response; experimental study
基金项目 湖北省科技厅项目(No.2016CFB344)
作者单位 1.黄石市第五医院(湖北黄石 435000);2.湖北文理学院附属医院,襄阳市中心医院(湖北襄阳 441021)
通讯作者 刘娟,E-mail:liujuan1980@sina.com
引用信息 胡孝鹏,纪晓,陈喜,等.花青素调节JAK2/STAT3信号通路对自身免疫性心肌炎大鼠Th17/Treg平衡的影响[J].中西医结合心脑血管病杂志,2024,22(7):1234-1239.
心肌炎是一种炎症性心脏疾病,主要由病毒或细菌感染和自身免疫性疾病引起[1-2]。自身免疫性心肌炎(autoimmune myocarditis,AE)会导致心脏组织重塑、纤维化和功能丧失,发展为扩张型心肌病,危及生命[3]。因此,避免心肌炎发展为扩张型心肌病是临床急需解决的问题之一。研究发现,T细胞17/调节性T细胞(Th17/Treg)平衡与AE的发病机制密切相关,调节Th17/Treg平衡可改善实验性AE[4]。花青素是类黄酮的重要亚科,具有抗菌、抗氧化、抗炎和抗突变的特性,常用于代谢紊乱、癌症、眼部疾病和心血管疾病等多种慢性疾病的预防和治疗[5]。研究发现,原花青素可改善病毒性心肌炎大鼠心肌损伤[6],然而机制不明确。而关于花青素对AE大鼠Th17/Treg平衡的影响报道较少。因此,本研究主要探究花青素对AE大鼠Th17/Treg平衡的影响及其作用机制。
1 材料与方法
1.1 实验动物
60只无特定病原体(SPF)级8周龄雄性SD大鼠,体质量280~300 g,购自广州锐格生物科技有限公司,生产许可证号:SCXK(粤)2021-0059。本研究已获得医院动物伦理委员会的批准。
1.2 主要试剂与仪器
花青素(货号:abs42015971)购自爱必信(上海)生物科技有限公司;信號转导和转录激活因子3(STAT3)激活剂Colivelin(货号:HY-P1061)购自美国MCE公司;白细胞介素(interleukin,IL)-10(货号:CSB-E07454r-1)、IL-17 酶联免疫吸附实验(ELISA)试剂盒(货号:CSB-E07451r-1)购自上海恒斐生物科技有限公司;IL-4(货号:FY-A014252)、IL-23 ELISA试剂盒(货号:FY-A014430)购自上海富雨生物科技有限公司;STAT3(货号:ab68153)、磷酸化STAT3(p-STAT3,货号:ab267373)、Janus激酶2(JAK2,货号:ab108596)、磷酸化JAK2(p-JAK2,货号:ab32101)、 甘油醛-3-磷酸脱氢酶(GAPDH)兔多克隆抗体(货号:ab9485)、IL-17-PE抗体(货号:ab108596)、CD4-APC(货号:ab252152)均购自英国Abcam公司;叉头蛋白p3(Foxp3)-FITC(货号:orb15626)购自英国Biorbyt公司。荧光显微镜购自日本Olympus公司;ELX800多功能酶标仪购自美国Biotek公司;实时荧光定量聚合酶链式反应(RT-qPCR)仪购自美国Bio-Rad公司。
1.3 AE大鼠模型构建及实验分组
参照相关文献[7]进行AE大鼠模型的构建。将猪心肌球蛋白加入磷酸缓冲盐溶液(PBS)稀释到2 mg/mL,然后将猪心肌球蛋白溶液与完全弗氏佐剂进行1∶1混合得到浑浊乳液。所有造模大鼠通过腹腔注射0.1 mL乳浊液。此外,将PBS与完全弗氏佐剂1∶1混合,在对照(NC)组大鼠腹部同一位置等剂量注射。所有大鼠共注射14 d。将造模成功的48只SD大鼠随机分为模型(Model)组、花青素组、STAT3激活剂Colivelin组、花青素+Colivelin组,每组12只。花青素组按照50 mg/kg的剂量腹腔注射花青素[4];Colivelin组腹腔注射1 mg/kg Colivelin[8];花青素+Colivelin组在花青素组基础上腹腔注射1 mg/kg Colivelin;NC组和Model组腹腔注射2 mL/kg生理盐水,每日2次,持续14 d。
1.4 标本采集
最后1次腹腔注射药物后,尾静脉采血、静置、分离得到血清,置于-20 ℃保存以备后续实验使用。麻醉大鼠后处死,分离脾脏组织和心肌组织,6只大鼠的心肌组织固定于4%多聚甲醛中,脾脏组织用于分离淋巴细胞;剩余6只大鼠的心肌组织和脾脏组织储存于-80 ℃中以备后续实验使用。
1.5 心肌组织形态观察
取心肌组织置于4%多聚甲醛溶液中,经常规脱水、浸蜡、包埋、切片、制片等过程,用苏木精和伊红染色后,在光学显微镜下观察心肌组织的形态。
1.6 心肌细胞凋亡情况
取1.5中心肌组织切片,按照末端脱氧核苷酸转移酶介导的dUTP缺口末端标记(TUNEL)试剂盒操作过程,并用4′,6-二脒基-2-苯基吲哚(DAPI)染色细胞核。TUNEL阳性细胞核呈绿色荧光,即凋亡细胞。在荧光显微镜下观察,细胞凋亡率为TUNEL阳性细胞/DAPI染色细胞×100%。
1.7 血清炎性因子检测
取1.4中冷冻保存的血清,按照ELISA试剂盒说明书检测大鼠血清炎性因子IL-10、IL-4、IL-17以及IL-23β水平。
1.8 流式细胞术检测脾脏Th17/Treg细胞表达
分离脾脏组织的淋巴细胞,加入缓冲液细胞悬浮液,使每孔细胞浓度稀释到1×106个/mL,与CD4-APC、IL-17-PE避光孵育20 min,上机检测Th17细胞数量,另外与CD4-APC、Foxp3-FITC避光孵育20 min,检测Treg细胞数量。
1.9 RT-qPCR检测脾脏组织维甲酸相关孤儿受体γt(RORγt)、Foxp3mRNA表达情况
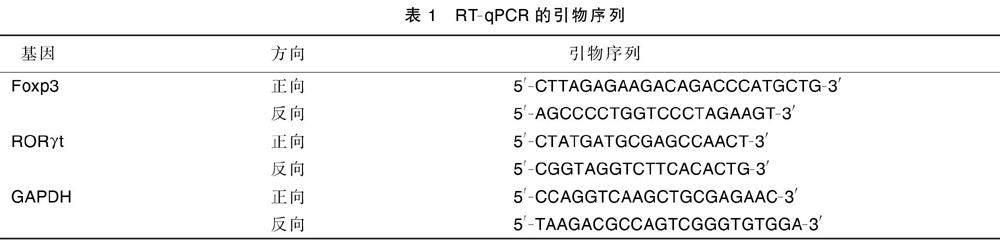
提取大鼠脾脏组织总RNA,根据反转录试剂盒将总RNA反转录为cDNA,采用RT-qPCR测定RORγt、Foxp3 mRNA表达量,反应条件为:预变性95 ℃/30 s,40个循环(95 ℃/5 s,60 ℃/30 s);以GAPDH为内参基因,引物由NCBI在线软件设计。详见表1。
1.10 免疫印迹法(Western Blot)检测JAK2/STAT3通路相关蛋白表达
取大鼠心肌组织匀浆,用RIPA裂解缓冲液提取总蛋白,将蛋白质进行变性、定量、电泳、转膜,将膜室温封闭3 h后分别加入一抗JAK2(1∶1 000)、p-JAK2(1∶1 000)、STAT3(1∶2 000)、p-STAT3(1∶2 000)和GAPDH抗体(1∶1 000),4 ℃孵育过夜;加入辣根过氧化物酶(HRP)标记的山羊抗兔二抗(1∶4 000),室温孵育3 h,加入增强型化学发光试剂(ECL)显影后。使用Image LabTM软件分析目标蛋白的灰度值。
1.11 统计学处理
采用SPSS 25.0统计软件进行数据统计分析。符合正态分析的定量资料以均数±标准差(x±s)表示,多组间比较采用单因素方差分析(ANOVA)。以P<0.05为差异有统计学意义。
2 结 果
2.1 花青素对大鼠心肌组织的影响
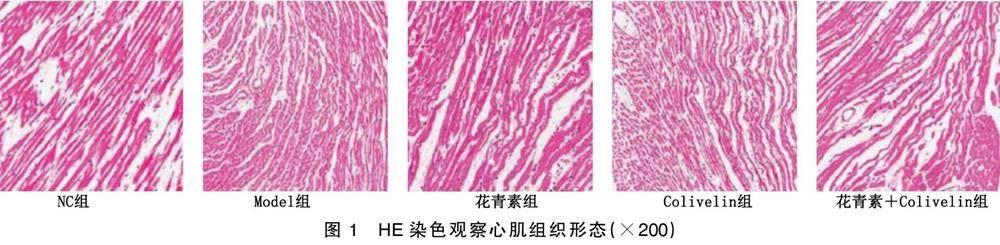
NC组大鼠心肌组织结构正常,未见明显的坏死和水肿现象;与NC组相比,Model组大鼠心肌组织出现明显的坏死和水肿现象,大量炎性细胞浸润;与Model组比较,花青素组大鼠心肌组织形态结构与NC组相似,Colivelin组大鼠炎性细胞浸润现象增加;与花青素组相比,花青素+Colivelin组心肌组织水肿和坏死现象加重。详见图1。
2.2 花青素對大鼠心肌细胞凋亡的影响
与NC组相比,Model组大鼠心肌细胞凋亡率明显升高(P<0.05);与Model组相比,花青素组大鼠心肌细胞凋亡率明显降低(P<0.05),Colivelin组大鼠心肌细胞凋亡率明显升高(P<0.05);与花青素组相比,花青素+Colivelin组大鼠心肌细胞凋亡率明显升高(P<0.05)。详见图2、表2。
2.3 花青素对大鼠血清炎性因子的影响
与NC组相比,Model组大鼠IL-17和IL-23水平明显升高(P<0.05),IL-10和IL-4水平明显降低(P<0.05),与Model组相比,花青素组大鼠IL-17和IL-23水平明显降低(P<0.05),IL-10和IL-4水平明显升高(P<0.05);Colivelin组大鼠IL-17和IL-23水平明显升高(P<0.05),IL-10和IL-4水平明显降低(P<0.05)。与花青素组相比,花青素+Colivelin组大鼠IL-17和IL-23水平明显升高(P<0.05),IL-10和IL-4水平明显降低(P<0.05)。详见表3。
2.4 花青素对大鼠脾脏Th17/Treg细胞水平的影响
与NC组相比,Model组脾脏Th17细胞水平以及Th17/Treg比例明显升高(P<0.05),Treg水平明显降低(P<0.05)。与Model组相比,花青素组脾脏Th17水平以及Th17/Treg比例明显降低(P<0.05),Treg水平明显升高(P<0.05);Colivelin组脾脏Th17水平以及Th17/Treg比例明显升高(P<0.05),Treg水平明显降低(P<0.05)。与花青素组相比,花青素+Colivelin组脾脏Th17水平以及Th17/Treg比例明显升高(P<0.05),Treg细胞水平明显降低(P<0.05)。详见表4。
2.5 花青素对大鼠脾脏组织RORγt、Foxp3mRNA水平的影响
与NC组相比,Model组脾脏组织RORγt mRNA水平明显升高,Foxp3mRNA水平明显降低(P<0.05);与Model组相比,花青素组脾脏组织RORγt mRNA水平明显降低,Foxp3mRNA水平明显升高(P<0.05),Colivelin组脾脏组织RORγtmRNA水平明显升高,Foxp3mRNA水平明显降低(P<0.05);与花青素组相比,花青素+Colivelin组脾脏组织RORγt mRNA水平明显升高,Foxp3mRNA水平明显降低(P<0.05)。详见表5。
2.6 花青素对大鼠心肌组织JAK2、STAT3蛋白表达水平的影响
与NC组相比,Model组心肌组织p-STAT3/STAT3、p-JAK2/JAK2比例明显升高(P<0.05);与Model组相比,花青素组心肌组织p-STAT3/STAT3、p-JAK2/JAK2比例明显降低(P<0.05),Colivelin组心肌组织p-STAT3/STAT3、p-JAK2/JAK2比例明显升高(P<0.05);与花青素组相比,花青素+Colivelin组心肌组织p-STAT3/STAT3、p-JAK2/JAK2比例明显升高(P<0.05)。详见图3、表6。
3 讨 论
AE是一种炎症性疾病,其可发展为心力衰竭、心源性休克、心律失常和猝死。AE病人在患病的过程中,释放大量的炎性因子,从而造成心肌组织发生炎症损伤,促使心肌纤维化,最终损害心脏功能[9-11]。本研究通过构建AE大鼠模型,结果发现,与NC组相比,Model组大鼠心肌出现明显的坏死和水肿现象,大量炎性细胞浸润,心肌细胞凋亡率明显升高,提示AE大鼠模型构建成功。花青素已被广泛应用于抗氧化、抗菌、抗炎、抗糖尿病、血管生成和心脏保护等方面[12]。研究发现,花青素可以通过改善小鼠炎症改善高脂饮食诱导的胰岛素抵抗[13],还可以通过改善心肌组织炎症改善脓毒症大鼠心功能[14]。本研究结果显示,与Model组比较,花青素组大鼠心肌无明显坏死和细胞肿胀,且心肌细胞凋亡率明显下降,提示花青素可能对AE大鼠心肌起到一定的保护作用。
炎症是决定心肌炎发展成扩张型心肌病的主要有害因素,减轻炎症可对心肌炎发挥保护作用[15-16]。Th17细胞受RORγt调控产生IL-17、IL-22和IL-23,募集中性粒细胞,并促进感染部位的炎症;而Treg细胞受Foxp3调控产生IL-10和IL-4,抑制多种免疫细胞的活性,从而抑制免疫反应[17-18]。RORγt与Foxp3的水平可反映Th17细胞和Treg细胞活化情况[18]。本研究发现,与NC组相比,Model组大鼠体内Th17/Treg平衡被打破,花青素干预则可明显降低大鼠血清IL-17、IL-23水平及脾脏RORγt mRNA水平,升高血清IL-10、IL-4水平及脾脏Foxp3 mRNA水平,提示花青素可能通过调节Th17/Treg平衡减弱AE大鼠心肌炎症反应。
JAK2是蛋白酪氨酸激酶家族的成员,在炎症反应以及细胞增殖和分化过程中起着重要作用[19]。JAK2可以通过调节STAT3磷酸化影响机体炎症水平[20]。研究表明,抑制JAK/STAT通路能够调控Th17/Treg平衡,改善神经元炎性损伤和凋亡[18]。本研究发现,与NC组相比,Model组大鼠心肌p-STAT3/STAT3、p-JAK2/JAK2比例明显升高,推测JAK2/STAT3通路可能参与了AE大鼠Th17/Treg平衡的破坏。与Model组比较,花青素组大鼠心肌p-STAT3/STAT3、p-JAK2/JAK2比例明显降低,推测花青素可能通过抑制JAK2/STAT3通路恢复AE大鼠的Th17/Treg平衡。本研究采用STAT3激活剂Colivelin干预发现,与花青素组相比,花青素+Colivelin组心肌炎性细胞浸润现象增加,IL-17、IL-23、RORγt mRNA水平、心肌细胞凋亡率及p-STAT3/STAT3、p-JAK2/JAK2比例明显升高,IL-10、IL-4、Foxp3 mRNA水平明显降低,表明Colivelin可减弱花青素对AE大鼠Th17/Treg平衡和心肌损伤的改善作用。
综上所述,花青素可能通过抑制JAK2/STAT3通路,恢复AE大鼠的Th17/Treg平衡,改善AE大鼠心肌损伤。然而,花青素的作用靶点可能涉及其他通路,有待后续进一步探究。
参考文献:
[1] TSCHPE C,AMMIRATI E,BOZKURT B,et al.Myocarditis and inflammatory cardiomyopathy:current evidence and future directions[J].Nature Reviews Cardiology,2021,18(3):169-193.
[2] HU J R,FLORIDO R,LIPSON E J,et al.Cardiovascular toxicities associated with immune checkpoint inhibitors[J].Cardiovascular Research,2019,115(5):854-868.
[3] BRACAMONTE-BARAN W,IHKOV D.Cardiac autoimmunity:myocarditis[J].Advances in Experimental Medicine and Biology,2017,1003:187-221.
[4] 张晶晶,刘婕,杨占峰,等.慢病毒介导Fg12基因沉默技术对自身免疫性心肌炎大鼠Th1/Th2漂移及Th17/Treg平衡的影响[J].中国比较医学杂志,2020,30(7):38-44.
[5] FONTES J A,BARIN J G,TALOR M V,et al.Complete Freund′s adjuvant induces experimental autoimmune myocarditis by enhancing IL-6 production during initiation of the immune response[J].Immunity,Inflammation and Disease,2017,5(2):163-176.
[6] LEE Y M,YOON Y,YOON H,et al.Dietary anthocyanins against obesity and inflammation[J].Nutrients,2017,9(10):1089.
[7] 周雪.基于Bcl-2/Bax/Caspase-3信號通路探讨三七总皂苷对自身免疫性心肌炎模型大鼠心肌凋亡影响的研究[J].陕西中医,2021,42(11):1504-1510.
[8] ZHAO H,FENG Y,WEI C J,et al.Colivelin rescues ischemic neuron and axons involving JAK/STAT3 signaling pathway[J].Neuroscience,2019,416:198-206.
[9] ZHANG C F,QI W Y,LI Y,et al.Discovery of 3-(4-(2-((1 H-indol-5-yl)amino)-5-fluoropyrimidin-4-yl)-1 H-pyrazol-1-yl)propanenitrile derivatives as selective TYK2 inhibitors for the treatment of inflammatory bowel disease[J].Journal of Medicinal Chemistry,2021,64(4):1966-1988.
[10] BLYSZCZUK P,MLLER-EDENBORN B,VALENTA T,et al.Transforming growth factor-β-dependent Wnt secretion controls myofibroblast formation and myocardial fibrosis progression in experimental autoimmune myocarditis[J].European Heart Journal,2017,38(18):1413-1425.
[11] DERANGEON M,MONTNACH J,CERPA C O,et al.Transforming growth factor β receptor inhibition prevents ventricular fibrosis in a mouse model of progressive cardiac conduction disease[J].Cardiovascular Research,2017,113(5):464-474.
[12] TSAKIROGLOU P,VANDENAKKER N E,DEL BO′ C,et al.Role of berry anthocyanins and phenolic acids on cell migration and angiogenesis:an updated overview[J].Nutrients,2019,11(5):1075.
[13] TIAN B M,ZHAO J H,XIE X Q,et al.Correction:Anthocyanins from the fruits of Lycium ruthenicum Murray improve high-fat diet-induced insulin resistance by ameliorating inflammation and oxidative stress in mice[J].Food & Function,2021,12(15):7092.
[14] 陳亚峥,陈伟文,曾海文,等.原花青素B2对脓毒症大鼠心肌损伤的作用[J].中国临床药理学杂志,2021,37(20):2826-2829.
[15] JAN R I,FERNNDEZ-VELASCO M,TERRN V,et al.BML-111 treatment prevents cardiac apoptosis and oxidative stress in a mouse model of autoimmune myocarditis[J].FASEB Journal,2020,34(8):10531-10546.
[16] DI FLORIO D N,SIN J,CORONADO M J,et al.Sex differences in inflammation,redox biology,mitochondria and autoimmunity[J].Redox Biology,2020,31:101482.
[17] LEE G R.The balance of Th17 versus treg cells in autoimmunity[J].Int J Mol Sci,2018,19(3):730-743.
[18] 何俊伟,薛丽虹,张一攀.骨髓间充质干细胞移植通过JAK/STAT通路对缺血性脑梗死大鼠Th17/Treg平衡以及神经元炎性和凋亡的影响[J].免疫学杂志,2021,37(12):1029-1036.
[19] ZHU H,JIAN Z H,ZHONG Y,et al.Janus kinase inhibition ameliorates ischemic stroke injury and neuroinflammation through reducing NLRP3 inflammasome activation via JAK2/STAT3 pathway inhibition[J].Frontiers in Immunology,2021,12:714943.
[20] 谈欣怡,谭奚扬,曹左媛,等.“自身清”双向调节JAK2/STATs信号通路抑制系统性红斑狼疮小鼠肺间质病变的研究[J].中国中医基础医学杂志,2022,28(2):213-217.
(收稿日期:2022-08-02)
(本文编辑王丽)

