湖北巴东县野生茶树种质资源遗传多样性及种群结构亲缘关系分析
崔清梅 梁金波 马会杰 胡双玲 陈清华 吴立赟 何梦迪 王留彬 谭立才 张强 王丽鸳
摘要:野生茶樹种质资源具有较高的遗传多样性,是开展茶树品种选育的优质基因库。收集了来自湖北省巴东县的26份野生茶树资源,利用简单重复序列(Simple sequence repeat,SSR)分子标记并结合对照栽培型茶树品种对野生茶树资源的遗传多样性及种群结构等进行分析。结果如下:(1)16对引物在供试材料中共扩增得到82个等位位点,每对引物扩增所得的等位基因范围为3~8个,平均检测出等位位点5.12个,有效位点数量3.65个,香农多样性指数平均值1.378。(2)从16对引物中筛选出6个核心引物位点,可对26份野生茶树进行有效检测并鉴别。(3)UPGMA进化树将48份材料分为7个类别,野生茶树与栽培型茶树能通过SSR标记进行有效划分;进一步种群遗传结构分析发现26份野生茶树可分为2个亚群。(4)依据生化成分含量,筛选得出2份高EGCG含量的茶树种质资源及2份适制红茶的茶树种质资源。研究结果显示,巴东野生茶树多样性丰富,种群内部遗传变异高,为进一步保护、开发和利用巴东野生茶树种质资源奠定了基础。
关键词:野生茶树;多样性;简单重复序列;亲缘关系
中图分类号:S571.1;S324 文献标识码:A 文章编号:1000-369X(2024)02-193-14
Genetic Diversity and Population Structure Relationship Analysis of Wild Tea Germplasm Resources in Badong County, Hubei Province
CUI Qingmei1, LIANG Jinbo1, MA Huijie1, HU Shuangling1, CHEN Qinghua1, WU Liyun2,
HE Mengdi2, WANG Liubin2, TAN Licai3, ZHANG Qiang1*, WANG Liyuan2*
1. Enshi Tujia and Miao Autonomous Prefecture Academy of Agricultural Sciences, Enshi 445000, China;
2. Tea Research Institute of Chinese Academy of Agricultural Sciences, Hangzhou 310008, China;
3. Hubei Zhengshantang Badong Black Tea Co., Ltd., Hubei Province, Badong 444300, China
Abstract: Wild tea germplasm resources have high genetic diversity and are also a high-quality source for the breeding and utilization of local tea cultivars. In this study, 26 resources of wild tea plants from Badong County, Hubei Province, were collected and the genetic diversity and population structure of wild tea plants were analyzed using SSR molecular markers with the normal tea cultivars as the control. The results are as follows: (1) 16 pairs of primers detected an average of 5.12 alleles and 3.65 effective loci in the test materials. A total of 82 alleles were amplified, with each pair of primers amplifying a range of 3-8 labeled alleles. The average Shannon diversity index was 1.378. (2) Six core primer sites were selected from 16 pairs of primers, which can effectively detect and identify 26 materials in this study. (3) UPGMA evolutionary map of individual samples could divide all 48 materials into 7 categories. Wild tea plants and cultivated tea plants could be effectively divided through SSR detection. Population genetic structure analysis suggests that 26 wild tea samples could be divided into 2 subgroups. (4) Based on biochemical components, two samples with high EGCG content and two tea germplasms suitable for making black tea were selected. Results of this research show that diversity level of wild tea resources in Badong was high, with high genetic variation within the population. This study laid a foundation for further protection, development and utilization of wild tea germplasm resources in Badong.
Keywords: wild tea plant, diversity, SSR, genetic relationship
巴东县位于湖北省西南部,临近我国西南地区茶树起源地[1]。巴东茶树种植历史悠久[2-3],当地现存的野生茶树种质资源丰富[4-5]。野生古树具有重要的文化、生态及保护与开发等多方面研究价值[6]。野生茶树拥有丰富的遗传多样性[7],具有重要的开发利用价值[8-10],是重要的初级种质资源[11-12]。开展茶树种质资源遗传多样性研究,对野生茶树鉴定与评价等具有重要意义。同时也是开展地方茶树种质资源普查评价、筛选开发利用茶树新品种,以及发掘与地方茶叶生产紧密相关优异品种资源的重要基础。
简单重复序列(Simple sequence repeat,SSR)分子标记作为一种优良的共显性遗传检测工具,一般包含2~6个寡聚核苷酸,长度在200 bp以下,具有试验结果重复性好、多态性高[13],适用于整个基因组等优点,被广泛应用于茶树及其他物种的遗传分析研究[14-16]。
本研究从湖北省巴东县境内考察采集了26份野生茶树样本,以来源广泛的22份栽培型茶树品种为对照,采用SSR分子标记手段检测分析巴东县境内野生茶树的遗传资源多样性及种群间与种群内变异情况,并对野生茶树的生化成分差异进行分析评价,从而阐明巴东县野生茶树的遗传多样性和地理分布特点,以期为巴东县野生茶树种质资源的保护及开发提供研究基础。
1 材料与方法
1.1 材料
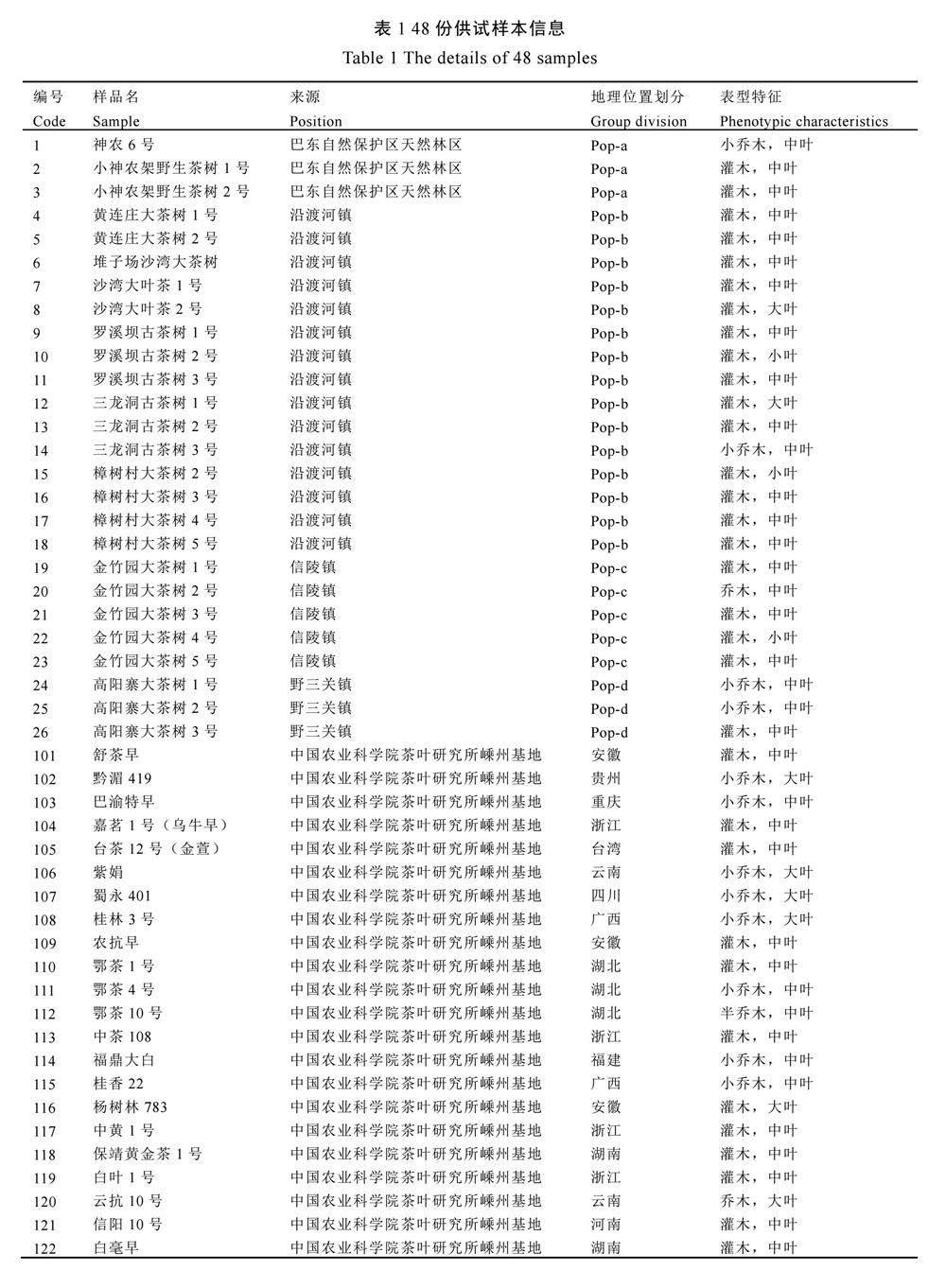
在湖北省恩施州巴东县自然保护区天然林区(Pop-a)、沿渡河镇(Pop-b)、信陵镇(Pop-c)、野三关镇(Pop-d)4个野生茶树分布集中区域进行考察,共采集26份野生茶树样本,分别编号1~26。样本采集时间为2022年5月和6月,灌木型茶树采集嫩叶新梢,乔木型茶树采集成熟叶片。野外样本采集后,立即放入便携式低温冰箱保存,返回实验室后立即置于﹣80 ℃冰箱保存,样本具体信息见表1。另选取22个种植于中国农业科学院茶叶研究所嵊州基地的无性系栽培茶树品种作为对照,编号为101~122,所有供试样本品种及信息详见表1。
1.2 DNA提取及检测
DNA的提取使用植物基因组提取试剂盒[DP350天根生化科技(北京)有限公司],提取方法及操作参照说明书。基因组提取后,使用超微量分光光度计(NanoDrop 1000,赛默飞世尔)测定DNA的浓度和纯度。根据样本DNA的浓度,将每个样品DNA稀释到20 ng·μL-1,﹣20 ℃冰箱保存备用。
1.3 候选SSR引物的PCR扩增
参考文献[17],本研究从中挑选多态性 高、条带清晰的16对SSR引物(表2)用于试验。
PCR反应体系参照徐礼羿等[18]的方法并稍作修改:Reaction Mix(含DNA Polymerase、2×PCR Buffer、MgCl2和dNTP)5.0 μL,模板DNA 4.0 μL,正反向引物(10 ng·μL-1)各0.2 μL,加ddH2O至10 μL。PCR反应参数:94 ℃预变性4 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s,共计35个循环;72 ℃延伸10 min;4 ℃保存。
1.4 扩增产物的PAGE电泳和银染显色
扩增产物加入1.5 μL 6×Loading Buffer混匀,进行10%聚丙烯酰胺凝胶电泳(Polyac-rylamide gel electrophoresis,PAGE),每100 mL的10% PAGE按如下比例配制:46 mL ddH2O、20 mL 5×TBE、33 mL 30% A/B溶液、1 mL10%过硫酸铵和100 μL TEMED溶液。电泳在CBS MGV-202-33型垂直电泳仪上进行,电泳结束后进行银染显色,并用Bio-Rad Gel Doc2000凝胶成像仪拍照,然后用保鲜膜将凝胶置于冰箱保存。
1.5 生化成分检测
咖啡碱检测采用GB/T 8312—2013高效液相色谱(High performance liquid chrom-atography,HPLC)法,氨基酸组分、儿茶素组分含量检测分别按照GB/T 30987—2014和GB/T 8313—2018的HPLC法。
1.6 数据处理
SSR试验结果采用人工读带的方法,将电泳图上的目的片段范围内清晰的条带按照分子量大小,从大到小依次记作A、B、C、D……,单一条带为纯合基因型,两条条带为杂合基因型,因条带的大小不同分别记录为AA、AB、BB、AC、AD、CD等,条带缺失记为“0”。将数据导入Excel,建立起原始基因型数据矩阵。茶叶生化成分统计分析用Excel 2010分析,適制性茶类采用茶多酚与氨基酸比值进行评价筛选,酚氨比小于8的预判适宜制绿茶,酚氨比大于8的预判适宜制红茶等类别[19]。
SSR结果分析时,先将26个巴东野生茶树样本和22个无性系栽培种茶树样本分为2个种群。采用GenAlEx 6.5.0.3软件[20]进行一系列标记鉴别力、杂合度、基因频率、遗传多态信息量和香农指数等参数的运算。将原始基因型数据矩阵转换为软件所需的格式,Excel的第一行分别填写位点数、样本数、种群数及各个种群所含有的样本数;Excel第一列为样本编号,第二列为样本对应的种群名,第3列起为标记列,每个标记占2列,将等位位点分列,并将基因型A、B、C…替换为数字形式的1、2、3…,缺失位点用“0”表示。按照供试样本的基因型数据,将其转换成PowerMarker v3.25软件[21]要求的数据格式。基于“Nei.1983”计算样本间的遗传距离并进行非加权组平均法(Unweighted pair-group method with arithmetic means,UPGMA)进化树构建。供试样本按照邻接法(Neighbor-joining)得到结果并导入在线工具ITOL(https://itol.embl.de)进行进化树美化。种群结构分析使用Structure软件[22],Structure软件采用马尔科夫链蒙特卡洛方法(Markov Chain Monte Carlo,MCMC)开始的不作数迭代(Length of burn-in period),参数设置为10 000,迭代后的MCMC重复数次为50 000;K值范围:1~7,每个K值重复验算5次,结果导出至在线分析工具Structure Harvester[23]确定最佳K值,并依据最佳K值作图。
2 结果与分析
2.1 SSR标记遗传多态性
由表3可知,本研究使用的16对引物在26份巴东野生茶树种质资源样本表现出较高水平的多态性。16对SSR引物共得到等位位点(Na)数量为82个,扩增得到的等位基因范围3~8个,平均每个引物扩增出等位位点5.12个,平均有效位点(Ne)数量3.65个。有5对引物(CsFM1715、CsFM1622、CsFM1585、CsFM1125、CsFM1131)得到的有效位点数量超过4个;观测杂合度(Ho)范围为0.385~0.885,平均觀测杂合度为0.650;期望杂合度(He)范围为0.557~0.830,平均值期望杂合度为0.707,说明这些引物在26个巴东野生茶树中扩增多态性较好。结合香农多样性指数(I)来看,16对SSR引物香农多样性指数范围为1.023~1.903,香农多样性指数平均值达到1.378,说明本研究选用的SSR引物多态性较好。
2.2 标记引物的鉴别能力
将基因型数据导入到GenAlEx软件,进行16对引物复合位点组合增加同一性概率(Probability of identity at a locus,PI)和PIsibs(Probability of identity for sibs at a locus)值分析,得出16对试验标记引物非同一概率值如表4所示。16个SSR位点的PI值范围在0.049 9~0.246 8,平均值为0.140 9。所有位点独立分离的情况下,16个SSR位点组合后2个随机样本存在同一种基因型组合的概率(PI for increasing locus combinations)为4.8×10-15。所有位点未独立分离的情况下,从群体中找到2个具有同一种基因型组合的概率(PIsibs for increasing locus combinations)为1.3×10-6。PI值最小为0.049 9,PIsibs值最小的为0.347 7,对应引物均为CsFM1715,说明该引物对任意2个样本鉴定为同一基因型的概率值最小,表明该引物鉴别能力最强。
16对SSR标记对26份野生茶树扩增位点的非同一概率值作图,如图1所示,随着SSR位点从1个增加到16个,样本组随机2个个体具有同一种基因型组合的概率PI从0.2降到4.8×10-15,PIsibs从0.48降到1.3×10-6。选用6个引物组合时,在这26份巴东野生茶树资源中任意两份资源具有相同基因型的概率几乎为零,当选择6个核心SSR标记组合时,PI和PIsibs分别为1.0×10-5和7.7×10-3(图1)。结合表4中16对引物PI和PIsibs的最小值,可以选取CsFM1715、CsFM1131、CsFM1585、CsFM1125、CsFM1622、CsFM1390这6个核心引物作为后期构建26份巴东野生茶树品种的分子指纹图谱。
2.3 48份茶树种质样本个体间的聚类分析
近年来,野生茶树种质资源在多个产茶区受到关注[24-26],为探究巴东县野生茶树与常见栽培型茶树的区别,以及推测巴东县境内野生茶树遗传进化途径,将26份巴东野生茶树种质作为试验群体,以22个栽培型茶树品种作为对照,基于Neis遗传距离,采用UPGMA法聚类得到48份茶树种质个体间聚类图(图2)。结果表明,48份茶树资源大致分为7个类群。类群1共5个样本,包含2个巴东野生茶树和3个无性系茶树种质;类群2的3个样本均为巴东县野生茶树,分别为巴东县信陵镇和沿渡河镇的野生茶树。类群3共10个样本,除了中茶108、桂林3号2个栽培种茶树,另外8个为巴东县沿渡河镇和信陵镇样本。类群4共有7个样本,主要为巴东野生茶树种质,仅有1个栽培种保靖黄金茶1号,推测该6个巴东野生茶树与湖南保靖黄金茶遗传进化来源相近,结合地理位置分析,保靖黄金茶1号属于湖南省湘西州,与巴东县所属恩施州毗邻,因此这6个巴东野生茶树与保靖黄金茶栽培种的来源接近。类群5包含3个栽培种茶树,1个来自安徽的农抗早和2个来自浙江的白叶1号和中黄1号。类群6共9个样本,其中鄂茶4号、鄂茶10号2个栽培型茶树品种与其余7个巴东野生茶树聚类一类,推测这7个野生茶树种质与湖北省栽培型茶树品种遗传背景较为相近;类群7全部11个样本均为栽培型茶树品种。
2.4 巴东县野生茶树种群结构及亲缘关系分析
为进一步了解巴东县野生茶树种群内部遗传结构及亲缘距离,以地理位置为种群划分,基于种群间遗传距离,得出巴东野生茶树与栽培种茶树种群之间的聚类结果如图3所示。栽培型茶树种群、野三关镇种群各自为一个类别,沿渡河镇种群与巴东自然保护区天然林区种群、信陵镇种群遗传距离较为接近聚为一类。种群间遗传距离指数表明(表5),巴东野生茶树中,巴东自然保护区天然林区与沿渡河镇、信陵镇之间种群距离分别达到0.379和0.391,小于巴东自然保护区天然林区与栽培型茶树种群遗传距离(0.543),远小于与野三关镇的遗传距离(0.889)。沿渡河镇与信陵镇种群之间遗传距离(0.183)小于其与栽培型茶树种群之间的遗传距离(0.216),也小于与野三关镇的遗传距离(0.288)。信陵镇与栽培型茶树群体和野三关镇的遗传距离与上述结果相同。这说明巴东自然保护区天然林区与沿渡河镇、信陵镇这3个组合的亲缘关系相比于它们与栽培型茶树品种种群要更为接近。而野三关镇茶树种群与其他3个种群的遗传距离甚至超过与栽培型茶树种群的遗传距离。
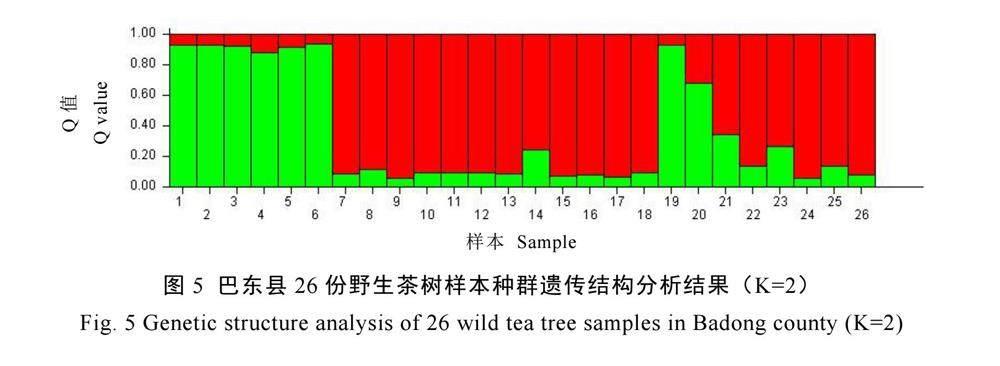
为有效区分26份野生茶树资源内部之间种群,首先根据巴东野生茶树和栽培型茶树分为2个类群进行分子方差分析(Analysis of molecular variance,AMOVA),结果显示(图4),16个SSR位点的基因型频率在样本中的分子变异表现出组间(4%)<组内(8%)<个体间(88%)。说明初步按照野生茶树和栽培型茶树2个类群进行样本分群划分,48份供试样本的分子遗传变异主要源于个体间,根据2种不同类型茶树种群进行分组的方式仅能解释4%的组间变异。表明巴东县26份野生茶树种质资源的分子变异主要源于个体变异,不能单独作为1个巴东野生茶树群体进行亚型分类。基于此,利用Structure软件开展26份巴东野生茶树种群遗传结构分析,当K值等于2时,L(K)值达到峰值,选取该点为最佳分群的K值,即表示来自4个乡镇区域的26份巴东野生茶树样本应分为2个亚群。
图5可以看出,巴东野生茶树种质资源样本中,总体上1~6号6个野生茶树样本可以归为一个亚群,7~26号20个样本归为另一个亚群。Structure分类结果显示,少数沿渡河镇和巴东自然保护区天然林区样本被归为一个亚群,多数沿渡河镇和野三关镇等区域的样本被分为一个亚群。结合4个采样区域分析发现,1~6号样本亚群分类总体位于沿渡河镇北端,7~26号亚群位于沿渡河镇南端和巴东县南端的信陵镇、野三关镇。以上结果说明巴东野生茶树种质资源遗传背景清晰,2个亚群分类基本围绕沿渡河镇南北两端展开,亲缘关系较为单一。
2.5 野生茶树样本内含物质成分评价
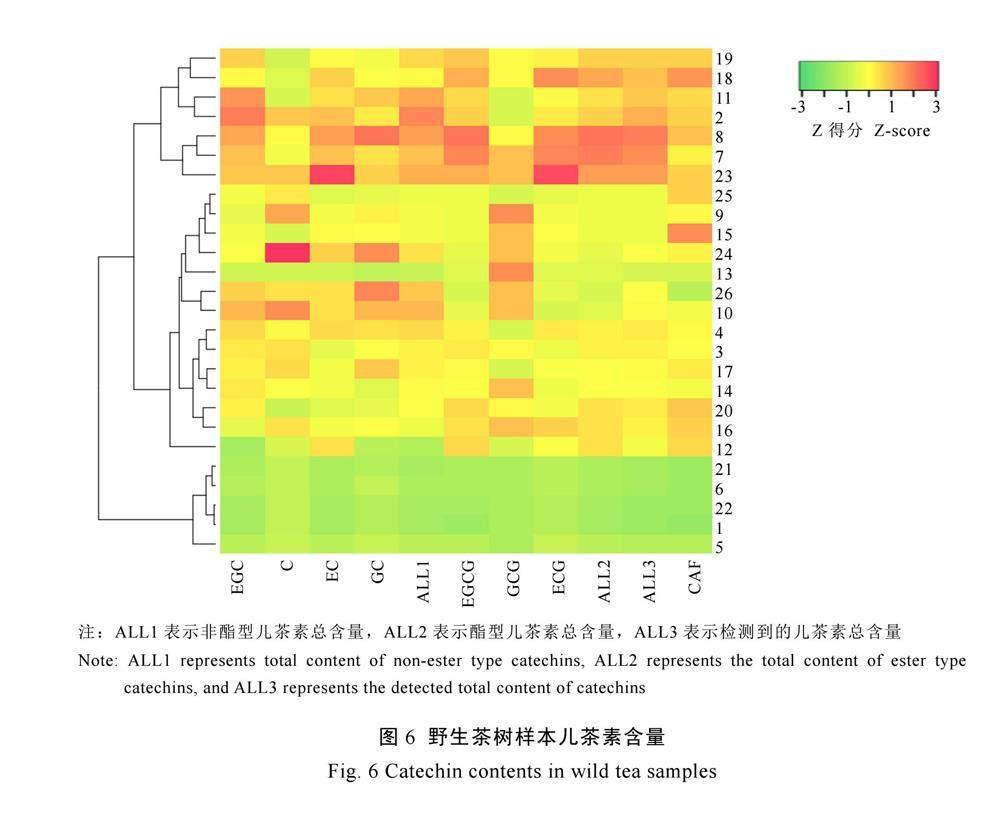
对26份巴东野生茶树样本进行HPLC法检测,样品儿茶素组分、氨基酸组分含量结果分别如图6和图7所示。
巴东野生茶树共检测了7种儿茶素组分,包括EGC、C、EC和GC 4种非酯型儿茶素,以及CG、GCG、ECG 3种酯型儿茶素。儿茶素总量含量范围在0.14%~19.17%,差异范围较大。26份野生茶树样本非酯型儿茶素总含量范围在0.03%~7.09%,酯型儿茶素总量范围在0.11%~12.93%。非酯型儿茶素C、EC和GC在26份野生茶树中含量范围较低,C含量范围为0.01%~0.64%,平均含量0.19%;EC含量范围为0.01%~1.24%,平均含量0.44%,GC含量范围为0.03%~0.56%,平均含量为0.25%。EGC含量范围为0.03%~5.84%,其中EGC含量大于5%的野生茶树样本为小神农架野生茶树1号和罗溪坝古茶树3号。酯型儿茶素方面,EGCG含量范围为0.09%~11.19%,GCG含量范围为0.01%~0.04%,ECG含量范围0.01%~2.27%。酯型儿茶素总量大于10%的有4个样本,分别是沙湾大叶茶1号、沙湾大叶茶2号、樟树村大茶树5号和金竹园大茶树5号,其中沙湾大叶茶1号和沙湾大叶茶2号分别达到12.29%、12.93%。
26份巴东野生茶树共检测了19种氨基酸组分。氨基酸平均含量前3为茶氨酸(Thea)、谷氨酸(Glu)、天冬氨酸(Asp),其次为谷氨酰胺(Gln)、丝氨酸(Ser)、缬氨酸(Val)、酪氨酸(Tyr)。组氨酸(His)、脯氨酸(Pro)、半胱氨酸(Cys)和亮氨酸(Leu)4种氨基酸在巴东野生茶树中含量较低。氨基酸总量方面,26份巴东野生茶树样本氨基酸总量范围为0.41%~2.25%,氨基酸总量较高的有神农6号、樟树村大茶树4号、樟树村大茶树5号、金竹园大茶树1号、金竹园大茶树2号、金竹园大茶树4号共5个样本。
参照《农作物优异种质资源评价规范 茶树》(NY/T 2031—2011)[27]相关指标,结合图6和图7结果可以得出,巴东县野生茶树样本中低咖啡碱含量样本4份,高EGCE样本2份。
为将采集到的地方野生茶树样本有效利用,对野生茶树样本进行归类及评价,得出本研究儿茶素总量方面潜在优良资源(儿茶素总量在15%~20%)4份,其他类种质资源如酯型儿茶素>120 mg·g-1共2份,非酯型儿茶素总量占比大于50%共2份,富含EGC(>5%)共2份。此外,结合表6可知,小神农架野生茶树1号为高儿茶素含量样本,富含EGC;沙湾大叶茶1号、沙湾大叶茶2号为高EGCG、高酯型儿茶素的样本。将野生茶树样本根据酚氨比进行初步适制茶类筛选,发现26份样本资源酚氨比范围在2.29~11.53,其中堆子场沙
湾大茶树、金竹园大茶树2号、金竹园大茶树4号、高阳寨大茶树2号4个样本酚氨比小于8,为适制绿茶类茶树资源。小神农架野生茶树1号、罗溪坝古茶树3号、樟树村大茶树2号、樟树村大茶树5号4个样本酚氨比大于8,其中小神农架野生茶树1号、罗溪坝古茶树3号分别达到10.07、10.54,均大于10,可初步判断作为当地适制红茶样本资源。
3 讨论
3.1 SSR分子标记的检测能力
本研究选取16个SSR标记进行多样性分析,筛选出其中6个核心标记引物,可准确地检测区分26份巴东县野生茶树种质资源。研究使用的16对SSR分子标记引物来源于Tan等[17]开发的SSR引物序列,该类型引物对中小叶种茶树效果明显,也可有效用于多种不同类型茶树种质[28-29]。本研究结果显示,巴东县野生茶树遗传多样性结果中,共有6个SSR标记香农多样性指数值大于1.5,16个SSR标记的香农多样性指数均大于1.0,最小的达到1.023。说明本研究选取的16个标记整体多态性较好,符合此类中小叶种野生茶树资源的检测要求。
3.2 巴东县野生茶树种质资源结构及亲缘关系
本研究的48份材料依据遗传距离可分为7个类别,26份巴东野生茶树样本被划分到其中的5个类别。类群1分组中野三关镇高阳寨大茶树1号、高阳寨大茶树2号和3个栽培型茶树品种亲缘关系接近。由于高阳寨大茶树1号、高阳寨大茶树2号均位于同一村寨,且两个样本表型相似,均为小乔木,推测两个样本亲缘关系较近。类群2分组为3个巴东野生茶树,而在该分组类别中金竹园大茶树2号和金竹园大茶树3号又被划分为其中一个小的分类,而罗溪坝古茶树3号为沿渡河镇罗溪坝村古茶树,结合3者遗传分类及地理特点,推测罗溪坝村古茶树3号有可能是由信陵镇金竹园村附近引种而来。类群3分组包含3个小的类别共10个样本,其中两个无性系茶树品种桂林3号、中茶108被划分在其中1个小的类别,推测该分组的8个巴东野生茶树与中茶108等相关无性系茶树品种亲缘关系相近。类群4中栽培型茶树保靖黄金茶1号和其他6个巴东野生茶树聚在一起,表明它們之间存在相关亲缘关系。类群6中鄂茶4号、鄂茶10号同为湖北省主栽茶树品种,与其他7个巴东野生茶树聚在一起,说明它们之间亲缘关系接近。类群7及类群5全部为栽培型茶树品种,这两个栽培型茶树分组与其他包含野生茶树的5个分组有明显区别。说明本次SSR遗传多样性试验结果能有效地将两种不同类型茶树种质资源进行划分。同时表明野生茶树与栽培型茶树遗传多样性具有不同的特点。
按照地理位置划分进行种群聚类分析时,巴东县3个乡镇野生茶树群体组合之间遗传距离小于它们和栽培种茶树之间遗传距离,说明这3个乡镇野生茶树群体之间亲缘关系更为接近。聚类分析及Structure分析表明,巴东县野生茶树样本中地理位置相似的样本基本都能被划为一类,这表明不同样本间存在明显地理位置特点。AMOVA分析显示,巴东县野生茶树来自种群内个体解释量达到88%,这说明种群内遗传变异高。样本的UPGMA聚类显示,巴东县野生茶树样本大多数表现为各自聚为一个类别,而栽培型茶树聚为另一个类别,这表明多数野生茶树内部遗传分化小。综上表明,巴东野生茶树遗传背景清晰,亲缘关系简单,具有较高的种质资源开发潜力。
3.3 野生茶树生化成分分析
儿茶素组分及其总量是茶叶生化成分常规指标之一,也是茶叶品质的重要代表,儿茶素在茶叶品质中主要呈现在茶汤的苦涩味方面[30]。前人研究表明,非酯型儿茶素含量占儿茶素总量比例超过50%的茶树相对进化程度低,且野生茶树有高茶多酚向低茶多酚进化趋势[31-32];本研究中,罗溪坝古茶树2号和高阳寨大茶树3号2个样本的非酯型儿茶素占比大于50%,与其研究结果相一致。本研究将酚氨比作为初步判断适制绿茶、红茶标准[33-34],共筛选8份适制类茶树资源,其中4份酚氨比小于8的适制绿茶类样本,4份酚氨比大于8的适制红茶类样本,其中小神农架野生茶树1号和罗溪坝古茶树3号2份种质资源为酚氨比大于10的样本,可为后续选育红茶品种提供一定的参考。
咖啡碱和氨基酸是茶树区别于其他植物的特殊成分,本研究中巴东县野生茶树有4份样本的咖啡碱含量≤1.5%[27],可为低咖啡碱茶树品种的选育提供原始种质资源。但本研究中多数野生茶树氨基酸总量偏低,部分结果表现与前人研究不一致,可能是由于本研究样本多为夏秋季成熟叶或野生茶树下端定型叶,试验样本原料成熟度偏高所致。
4 结论
本研究利用16对SSR引物,分析了湖北巴东县境内26份野生茶树种质资源的遗传多样性及种群亲缘关系,筛选出了6对核心标记引物,同时检测了巴东县野生茶树儿茶素、氨基酸等生化成分含量,并进行了初步评价及筛选,研究结果为巴东县野生茶树种质资源保护及发掘利用提供了重要的研究基础。
参考文献
[1] 虞富莲. 论茶树原产地和起源中心[J]. 茶叶科学, 1986, 6(1): 1-8.
Yu F L. Diseussion on the originating place and the originating center of tea plant [J]. Journal of Tea Science, 1986, 6(1): 1-8.
[2] 冯祖祥, 周重想. 古代巴人与茶文化[J]. 农业考古, 2000(4): 270-271, 273.
Feng Z X, Zhou C X. Ancient Ba people and tea culture [J]. Agricultural Archaeology, 2000(4): 270-271, 273.
[3] 贾济东. 试论湖北“巴东真香茗”[J]. 湖北大学学报(哲学社会科学版), 1993(5): 86-88.
Jia J D. Trying to discuss the "Badong true fragrant tea" in Hubei [J]. Journal of Hubei University (Philosophy and Social Science), 1993(5): 86-88.
[4] 蒋会兵, 唐一春, 陈林波, 等. 云南省古茶树资源调查与分析[J]. 植物遗传资源学报, 2020, 21(2): 296-307.
Jiang H B, Tang Y C, Chen L B, et al. Survey and analysis of ancient tea plant resources in Yunnan Province, China [J]. Journal of Plant Genetic Resources, 2020, 21(2): 296-307.
[5] 虞富莲. 中国古茶树[M]. 昆明: 云南科技出版社, 2016.
Yu F L. Ancient tea plants in China [M]. Kunming: Yunnan Science and Technology Press, 2016.
[6] 王沛然, 游桂璇, 诸葛名名, 等. 湖北省巴东县古树资源组成及其空间分布特征研究[J/OL]. 中国园林, 2023: 1-8. [2024-04-15].http://kns.cnki.net/kcms/detail/11.2165.TU.20231027.1834.004.html..
Wang P R, You G X, Zhuge M M, et al. Study on the composition and spatial distribution of ancient tree resources in Badong County, Hubei Province [J/OL]. Chinese Landscape Architecture, 2023: 1-8. [2024-04-15].http://kns.cnki.net/kcms/detail/11.2165.TU.20231027.1834.004.html.
[7] 王平盛, 虞富蓮. 中国野生大茶树的地理分布、多样性及其利用价值[J]. 茶叶科学, 2002, 22(2): 105-108.
Wang P S, Yu F L. The geographic distribution, diversity and utilization of wild tea Camellias in China [J]. Journal of Tea Science 2002, 22(2): 105-108.
[8] 黄亚辉, 谢曼卫, 郭满华, 等. 优质红茶种群——英德野生茶树的生化成分研究[J]. 茶叶通讯, 2020, 47(1): 25-31.
Huang Y H, Xie M W, Guo M H, et al. Study on biochemical components of high quality black tea population: wild tea germplasm resources in Yingde [J]. Journal of Tea Communication, 2020, 47(1): 25-31.
[9] 陈亮, 虞富莲, 杨亚军, 等. 茶树种质资源与遗传改良[M]. 北京: 中国农业科学技术出版社, 2006.
Chen L, Yu F L, Yang Y J, et al. Germplasm and genetic improvement of tea plant [M]. Beijing: China Agricultural Science and Technology Press, 2006.
[10] 唐一春, 杨盛美, 季鹏章, 等. 云南野生茶树资源的多样性、利用价值及其保护研究[J]. 西南农业学报, 2009, 22(2): 518-521.
Tang Y C, Yang S M, Ji P Z, et al. Study on the diversity, utilization and protection of wild tea germplasm in Yunnan [J]. Southwest China Journal of Agricultural Sciences, 2009, 22(2): 518-521.
[11] 何露, 閔庆文, 袁正. 澜沧江中下游古茶树资源、价值及农业文化遗产特征[J]. 资源科学, 2011, 33(6): 1060-1065.
He L, Min Q W, Yuan Z. Resources, value and agricultural heritage characteristics of the ancient tea plant in the middle and lower reaches of the Lancang river [J]. Resources Science, 2011, 33(6): 1060-1065.
[12] 周斌, 王留彬, 徐新涛, 等. 雷波野生茶树遗传多样性及亲缘关系分析[J]. 云南农业大学学报(自然科学), 2020, 35(1): 122-129.
Zhou B, Wang L B, Xu X T, et al. Analysis of genetic diversity and genetic relationship of Leibo wild tea resources [J]. Journal of Yunnan Agricultural University (Natural Science), 2020, 35(1): 122-129.
[13] 罗冉, 吴委林, 张旸, 等. SSR分子标记在作物遗传育种中的应用[J]. 基因组学与应用生物学, 2010, 29(1): 137-143.
Luo R, Wu W L, Zhang Y, et al. SSR marker and its application to crop genetics and breeding [J]. Genomics and Applied Biology, 2010, 29(1): 137-143.
[14] Taniguchi F, Kimura K, Saba T, et al. World-wide core collections of tea (Camellia sinensis) based on SSR markers [J]. Tree Genetics and Genomes, 2014, 10(6): 1555-1565.
[15] Fang W, Cheng H, Duan Y, et al. Genetic diversity and relationship of clonal tea (Camellia sinensis) cultivars in China as revealed by SSR markers [J]. Plant Systematics and Evolution, 2012, 298(2): 469-483.
[16] Zhao D W, Yang J B, Yang S X, et al. Genetic diversity and domestication origin of tea plant Camellia taliensis (Theaceae) as revealed by microsatellite markers [J]. BMC Plant Biology, 2014, 14(1): 14. doi: 10.1186/1471-2229-14-
14.
[17] Tan L Q, Wang L Y, Xu L Y, et al. SSR-based genetic mapping and QTL analysis for timing of spring bud flush, young shoot color, and mature leaf size in tea plant (Camellia sinensis) [J].Tree Genetics & Genomes, 2016, 12(3): 52. doi: 10.1007/s11295-016-1008-9.
[18] 徐礼羿, 王丽鸳, 苏静静, 等. 云南双江勐库大叶种茶树基因型和种群结构分析[J]. 植物遗传资源学报, 2019, 20(4): 1052-1064.
Xu L Y, Wang L Y, Su J J, et al. Genotyping and genetic structure analysis for 235 tea plant (Camellia sinensis var. assamica ‘Mengku-dayecha) in Shuangjiang of Yunnan Province [J]. Journal of Plant Genetic Resources, 2019, 20(4): 1052-1064.
[19] 丁世宇, 刘金鑫, 李晓洁, 等. 海拔与树龄对五峰县茶叶生化成分的影响[J]. 食品安全质量检测学报, 2023, 14(21): 236-243.
Ding S Y, Liu J X, Li X J, et al. Effects of altitude and tree age on the biochemical composition of tea leaves in Wufeng County [J]. Journal of Food Safety and Quality, 2023, 14(21): 236-243.
[20] Smouse P E, Whitehead M R, Peakall R. An informational diversity framework, illustrated with sexually deceptive orchids in early stages of speciation [J]. Molecular Ecology Resources, 2015, 15(6): 1375-1384.
[21] Liu K, Muse S V. PowerMarker: an integrated analysis environment for genetic marker analysis [J]. Bioinformatics, 2005, 21(9): 2128-2129.
[22] Pritchard J K, Stephens M, Donnelly P. Inference of population structure using multilocus genotype data [J]. Genetics, 2000, 155(2): 945-959.
[23] Earl D A, Vonholdt B M. STRUCTURE HARVESTER: a website and program for visualizing STRUCTURE output and implementing the Evanno method [J]. Conservation Genetics Resources, 2012, 4(2): 359-361.
[24] 陳潇敏, 赵峰, 王淑燕, 等. 福建野生茶树资源嘌呤生物碱构成评价及特异资源筛选[J]. 茶叶科学, 2022, 42(1): 18-28.
Chen X M, Zhao F, Wang S Y, et al. Purine alkaloid evaluation and excellent resources screening of Fujian wild tea [J]. Journal of Tea Science, 2022, 42(1): 18-28.
[25] 侯孟月, 王菲, 陈铭, 等. 千家寨野生型茶树与栽培型茶树叶片解剖结构及生理特性[J]. 生态学杂志, 2023, 42(5): 1074-1082.
Hou M Y, Wang F, Chen M, et al. Leaf anatomical structure and physiological characteristics of wild and cultivated tea trees in Qianjiazhai [J]. Chinese Journal of Ecology, 42(5): 1074-1082.
[26] 刘声传, 段学艺, 赵华富, 等. 贵州野生茶树种质资源生化多样性分析[J]. 植物遗传资源学报, 2014, 15(6): 1255-1261.
Liu S C, D X Y, Zhao H F, et al. Biochemical diversity analysis of wild tea germplasms in Guizhou [J]. Journal of Plant Genetic Resources, 2014, 15(6): 1255-1261.
[27] 中华人民共和国农业部. 农作物优异种质资源评价规范 茶树: NY/T 2031—2011[S]. 北京: 中国农业出版社, 2011.
Ministry of Agriculture and Rural Affairs of the People's Republic of China. Evaluating standards for elite and rare germplasm resources: tea plant (Camellia sinensis (L.) O. Kuntze): NY/T 2031—2011 [S]. Beijing: China Agriculture Press, 2011.
[28] 余书平, 徐礼羿, 吴荣梅, 等. 浙江开化县茶树种质资源的遗传多样性及亲缘关系分析[J]. 茶叶科学, 2020, 40(3): 341-351.
Yu S P, Xu L Y, Wu R M, et al. Genetic and phylogenetic analysis for resources of Camellia sinensis from Kaihua County in Zhejiang Province [J]. Journal of Tea Science, 2020, 40(3): 341-351.
[29] 王留彬, 黄丽蕴, 滕翠琴, 等. 梧州茶树种质资源的遗传多样性及亲缘关系分析[J]. 茶叶科学, 2022, 42(5): 601-609.
Wang L B, Huang L Y, Teng C Q, et al. Genetic and phylogenetic analysis for germplasm resources of Camellia sinensis from Wuzhou City [J]. Journal of Tea Science, 2022, 42(5): 601-609.
[30] 宛晓春. 茶叶生物化学[M]. 北京: 中国农业出版社, 2003.
Wan X C. Tea Biochemistry [M]. Beijing: China Agriculture Press, 2003.
[31] 中国农业科学院茶叶研究所. 中国茶树栽培学[M]. 上海: 上海科学技术出版社, 1986: 24-28.
Tea Research Institute, Chinese Academy of Agricultural Sciences. Chinese tea tree cultivation [M]. Shanghai: Shanghai Scientific & Technical Publishers, 1986: 24-28.
[32] 王新超, 陈亮, 杨亚军. 广西茶树资源生化成分多样性分析[J]. 植物遗传资源学报, 2010, 11(3): 309-314, 319.
Wang X C, Chen L, Yang Y J. Biochemical diversity analysis of tea germplasms in Guangxi [J]. Journal of Plant Genetic Resources, 2010, 11(3): 309-314, 319.
[33] Hilton P J, Palmer-Jones R. Relationship between flavonol composition of fresh tea and theaflavins content of manufactured tea [J]. Journal of Science and Food Agriculture, 1973, 24(7): 813-818.
[34] 趙华富, 高秀兵, 刘晓霞, 等. 贵州高茶多酚茶树品种多酚品质分析评价[J]. 中国农学通报, 2016, 32(16): 149-154.
Zhao H F, Gao X B, Liu X X, et al. Analysis and evaluation of polyphenols quality of high polyphenols content tea varieties in Guizhou [J]. Chinese Agricultural Science Bulletin, 2016, 32(16): 149-154.

