氟处理下茶树根系的组织细胞形态差异及蜡质合成相关基因WSD1的表达分析
宋博 贾培凝 叶文祺 吴俊 孙威江 薛志慧

摘要:茶樹是一种氟含量较高的植物,具有聚氟性。基于扫描电镜技术,探究不同质量浓度(10 mg·L-1和50 mg·L-1)及不同时间(1 d和16 d)氟处理下,氟高富集茶树品种黄棪和氟低富集茶树品种佛手根系吸收富集氟的特性差异,并对前期转录组数据筛选出氟处理下茶树蜡质合成的差异基因WSD1进行分析。结果显示,50 mg·L-1氟处理后,黄棪根部表皮细胞表面覆盖的蜡质稍有增多,细胞排列较为疏松,而佛手根部表皮细胞界限模糊,覆盖蜡质明显增多,细胞壁出现扭曲断裂等氟不耐受症状。蜡质合成相关基因WSD1荧光定量结果显示,WSD1经外源氟处理后,其对茶树根部的蜡质有较为明显的上调作用;WSD1蛋白互作网络预测结果及相关性分析显示,WSD1受CSS0041298、CSS0012327及CSS0049082的负调控。本研究从茶树与蜡质合成互作角度探究茶树缓解氟胁迫的响应机制,为深入探究茶树氟吸收调控和耐氟茶树品种的选育提供科学依据。
关键词:茶树;氟;SEM;蜡质合成基因
中图分类号:S571.1;Q52 文献标识码:A 文章编号:1000-369X(2024)02-219-12
Physiological Differences and Expression Analysis of Wax Synthesis Related Gene WSD1 in Tea Roots Treated with Fluorine
SONG Bo1,3, JIA Peining1,3, YE Wenqi1,3, WU Jun1,3, SUN Weijiang1,3*, XUE Zhihui2,3*
1. College of Horticulture, Fujian Agriculture and Forestry University, Fuzhou 350002, China;
2. Anxi College of Tea Science, Fujian Agriculture and Forestry University, Anxi 362406, China;
3. Tea Industry Engineering Technology Research Center of Fujian Province, Fuzhou 350002, China
Abstract: Tea plant, as one of the plants with high fluorine contents, has fluoride-polymerizing property. In this paper, based on scanning electron microscopy, the roots of ‘Huangdan and ‘Foshou were treated with different fluoride concentrations (10 mg·L-1 and 50 mg·L-1) and different time periods (1 d and 16 d). The differentially expressed gene WSD1 of tea wax synthesis under fluoride treatment was screened from the transcriptome data of our research group. The results show that under 50 mg·L-1 fluoride treatment, the epidermal cells of ‘Huangdan root had slightly more wax on the surface and relatively loose cell arrangement, while the epidermal cells of ‘Foshou root had blurred boundaries, significantly more wax on the surface, and fluorine intolerance symptoms such as cell wall distortion and breakage. Quantitative fluorescence results of WSD1 related to wax synthesis show that WSD1 had a significant up-regulation effect on the wax content of tea root under exogenous fluoride treatment. The prediction results of WSD1 protein interaction network and correlation analysis show that WSD1 was negatively regulated by CSS0041298, CSS0012327 and CSS0049082. This study provided a theoretical reference for alleviating fluorine stress in tea plants from the perspective of the interaction between tea plants and wax synthesis, and provided a scientific basis for further exploring the regulation of fluorine absorption in tea plants and the breeding of fluorine-tolerant tea cultivars.
Keywords: tea plant, fluorine, SEM, wax synthetic genes
茶树[Camellia sinensis (L.) O. Kuntze]是氟超富集植物,通过土壤、水及空气吸收并积累氟化物[1-2]。研究表明,在水溶性氟质量浓度低于1.0 mg·L-1的土壤中,茶树新梢可富集氟100~300 mg·kg-1,成熟叶和老叶可富集氟1 000~3 000 mg·kg-1,且茶树仍能正常生长,不表现受害症状[3]。富集系数(Bioaccumulation factor,BF)表示培养介质-植物体系中元素迁移的难易程度,富集系数越高,表明植物吸收能力越强[4-5]。通常将富集系数>1作为衡量超富集植物的判断指标[3]。研究表明,黄棪与毛蟹是高积累氟的茶树品种;佛手与肉桂是低富集氟的茶树品种[6]。贾培凝[7]研究发现,在同一土培环境下,佛手氟含量显著低于其他品种,黄棪氟含量显著高于肉桂、水仙和佛手,是佛手的2.65倍。茶树根系极易吸收土壤中的氟,大多数氟最终被运输并聚集至叶片中[8-9]。氟元素并非茶树生长发育的必需营养元素[10],低浓度氟能在一定程度上促进茶树生长,而高浓度氟则会抑制茶树正常生长,使茶树表现出受胁迫毒害症状[11-14]。彭传燚[15]研究表明,当水培溶液中氟的质量浓度小于50 mg·L-1时,茶树基本处于正常发育状态,且较低浓度的氟能促进茶树生长;当水培溶液中氟的质量浓度达到50 mg·L-1时,6 d后茶树根系出现发黑的情况,受胁迫症状随处理时间延长而加重;当水培溶液中氟质量浓度超过50 mg·L-1,则对茶树根系产生明显负效应。
植物表皮细胞有一层蜡封的角质层,主要是由一些C20~C34超长链脂肪酸(Very long chain fatty acids,VLCFAs)及其衍生物组成的疏水有机混合物[16-17]。植物表皮蜡质作为植物应对外界环境变化的最外层屏障,在响应外界非生物胁迫和生物胁迫等方面起着重要作用[18]。植物表皮蜡质的酰基合成途径中,VLCFAs被还原成初级醇,初级醇再经蜡酯合成酶(Ws)的催化,发生缩合反应生成烷基酯[19]。WSD1在蜡质合成过程中扮演着十分重要的角色,其主要编码蜡酯合成酶,拟南芥中的AtWSD1具有较高水平的蜡酯合成酶活性[20]。此外,WSD1还编码了二酰基甘油酰基转移酶[21]。研究表明,外源氟浓度超标会引起植物脂肪酸的过氧化,而脂肪酸作为茶树蜡质层的主要成分,使得表皮细胞的蜡质合成受到氧化变质影响,进而引发细胞损伤[22],因此研究茶树表皮蜡质合成途径中相关基因在不同浓度氟处理下的表达情况十分必要。
以往研究较多集中于氟在茶树亚细胞的分布,对于氟处理对不同品种茶树细胞超微结构影响的对比研究鲜有报道。本课题组前期研究发现,黄棪和佛手分别为氟高富集和氟低富集茶树品种,本研究以黄棪与佛手为试验材料,对不同氟富集茶树品种根系进行不同氟浓度和不同时间的交叉处理,采用扫描电镜(Scanning electron microscope,SEM)技术[23]探究2个品种的根系表面结构对氟响应的差异,并结合前期课题组茶树根系氟处理转录组结果进行深层挖掘,旨在为深入研究不同氟富集茶树品种根系的组织细胞形态差异提供试验依据,并为耐氟茶树品种分子育种提供参考。
1 材料与方法
1.1 试验材料
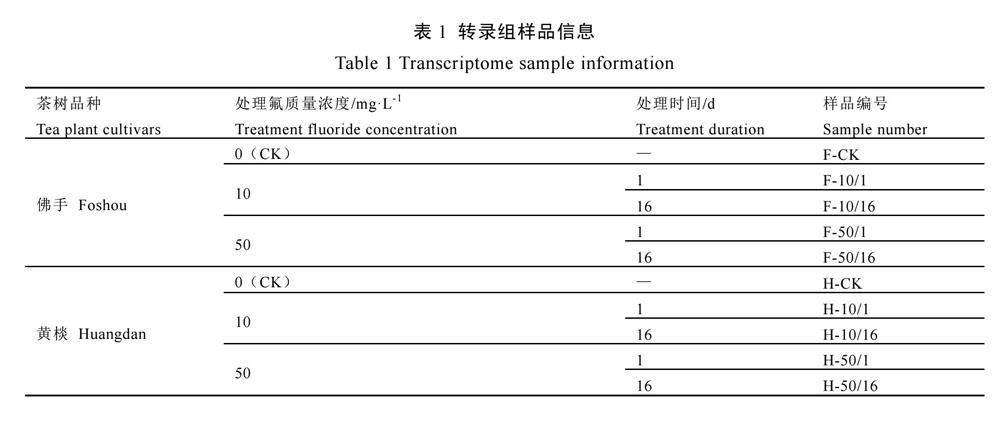
于2022年10月28日选取长势一致的黄棪和佛手的1年生扦插茶苗作为试验材料。对供试茶苗饥饿培养3 d后,转入全营养液培养1~2周。氟处理氟的质量浓度分别为10 mg·L-1和50 mg·L-1(氟以氟化鈉形式加入),处理时间为1 d和16 d,以不加氟元素的溶液作为空白对照。营养液pH为4.8~5.2,每4 d更换1次,24 h提供泵氧。人工气候培养室光照周期及温度设置为白天28 ℃ 16 h,夜晚20 ℃ 8 h,湿度为75%。分别在处理1 d和16 d后,取各处理组佛手和黄棪的根系样品,3个生物学重复,编号如表1所示。
选取实验室前期外源氟处理下佛手和黄棪空白对照组和50 mg·L-1处理组的转录组测序结果,用于验证分析。
1.2 氟含量及氟富集系数测定方法
选取两个品种茶树根系样品于110 ℃恒温干燥箱中干燥10 min,70 ℃烘至足干,再使用磨样机将样品磨碎后置于﹣20 ℃冰箱保存备用。氟含量测定参考GB/T 5009.18—2003中氟离子选择电极法。氟富集系数测定参考文献[5],其数值为茶树氟含量与培养介质全氟含量之比,数值越大表明茶树对氟的富集能力越强,反之越弱。
1.3 SEM观察的材料制备
参考文献[23]中的方法,选取根尖部分,切割成小于2 cm的组织块。使用5%的戊二醛固定样品4 h,磷酸缓冲液清洗样品3遍,1%锇酸固定4 h,蒸馏水清洗3遍,50%、70%、80%、90%、100%乙醇逐级脱水。脱水后环氧丙烷置换2遍,然后进行临界点干燥(日立HCP-2临界点干燥仪),再上台喷金(EIKO IB-5离子镀膜仪),最后用JSM6380LV扫描电子显微镜(日本电子株式会社)进行扫描电镜观察,拍照。
1.4 茶树总RNA提取和质量检测
选用RNAprep Pure多糖多酚植物总RNA提取试剂盒[天根生化科技(北京)有限公司]提取茶苗根部的总RNA,使用超微量紫外可见分光光度计(赛默飞世尔科技)测定RNA浓度,通过1%琼脂糖凝胶电泳检测RNA的完整性。
1.5 实时荧光定量PCR验证
选取与蜡质合成途径相关的WSD1差异表达基因进行实时荧光定量PCR测定,使用DNAMAN软件设计差异基因特异性引物,正向引物序列为TACCGTGTCCACCACTCCA,反向引物序列为ACGAAGTCGCCACATACAA。选择CsGAPDH作为内参基因,反应体系10 μL,SYBR Green qPCR Master Mix 5 μL,ddH2O 3 μL,上下游引物各0.5 μL,模板1 μL。反应程序为95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,35个循环。
1.6 WSD1蛋白亚细胞定位及蛋白互作网络预测
以HBT质粒作为空载体,将经测序比对所得的正确重组质粒通过冻融法转入农杆菌GV3101中,于LB液体培养基中摇至菌液浓度OD600介于0.6~0.8,6 000 r·min-1离心5 min收集菌体,室温静置4 h后将侵染液注射到本氏烟草叶片,黑暗培养12 h后正常培养12 h,进行激光共聚焦观察荧光。将WSD1蛋白序列导入String在线数据库(https://cn.string-db.org),获得WSD1蛋白互作网络。将WSD1蛋白启动子上游1 000 bp序列导入PlantTFDB在线数据库(http://planttfdb.gaolab.org),设置P<1E-7,预测转录因子调控网络,将蛋白互作网络和转录因子调控网络导入Cytoscape 3.8.2绘制WSD1蛋白互作网络图。
1.7 数据统计与分析
采用Excel 2010软件进行数据处理,采用SPSS 25.0软件Duncan法(P<0.05)进行显著性分析,采用GraphPad Prism 8.0软件进行统计分析和绘图,使用Tbtools软件进行相关性分析[24]。
2 结果与分析
2.1 不同氟富集茶树品种根系富集氟的差异
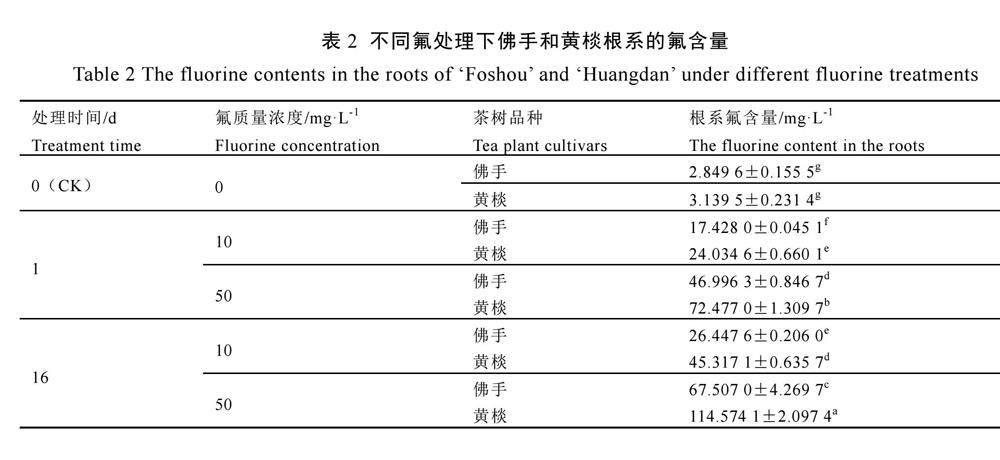
由表2可知,两个茶树品种根系氟含量均随营养液中氟浓度升高而升高,黄棪根系的氟含量在同一浓度和同一时间氟处理下均高于佛手,表明两个茶树品种根系对于不同氟浓度处理的响应程度不同,黄棪的响应更剧烈。在10 mg·L-1和50 mg·L-1氟处理下,两个品种第16天的氟含量均显著高于第1天。
由表3可知,不同浓度氟处理1 d后,茶树根部富集系数均大于1,说明两个茶树品种根系均具备植物氟超富集特性;同一茶树品种在不同浓度氟处理下,低浓度处理组的根部富集系数均近2倍高于高浓度处理组。第16天高浓度氟处理下佛手根部富集系数小于1。
2.2 不同氟富集茶树根系的扫描电镜差异
由图1A可知,佛手茶树根系在50 μm视野下,氟处理前根表皮细胞分布有少量蜡质,根部横切面显示,维管束细胞排列较为密集,而氟处理后根表皮细胞有受损现象,细胞凸凹交替,似波浪状起伏,皱脊模糊,排列无规则,根表皮细胞表面分布有较多蜡质,蜡质颗粒更为细碎。氟处理前,佛手根系的中柱鞘由多层细胞组成多列,中柱鞘细胞横切面较为扁平,中柱维管束组织由木质部和韧皮部排列组成,木质部为外始式生长,从中柱鞘向根部中心进行分化,原生木质部靠近中柱鞘,管胞较细且发育较早,后生木质部靠近中心且不断增大,氟处理后佛手的木质部导管管径减小,但差异不大。
由图1B可知,黄棪茶树根系在50 μm视野下,氟处理前的根表皮细胞饱满完整无破裂,分布有少量蜡质,细胞间排列紧密齐匀,氟处理后根表皮细胞表面呈现轻微干裂的状态,细胞排列较为疏松,覆盖的蜡质稍有增多。与氟处理前的根部横切面形态相比,氟处理后根系的皮层管状细胞直径明显扩大,中柱与中柱鞘的间距明显增大,空隙面积随之增大,呈半月形。
比较发现,氟处理前佛手根表皮细胞表面覆盖的蜡质明显多于黄棪,黄棪根表皮细胞的表面更为平滑,且细胞间排列更整齐紧密(图1A1和图1B1),氟处理后佛手根表皮细胞表面覆盖的蜡质仍显著多于黄棪,且佛手的细胞排列较为杂乱拥挤,皱脊模糊(图1A3和图1B3)。根部横切面显示,氟处理前佛手的维管束细胞排列较为密集(图1A2),而黄棪则较为疏松(图1B2);氟处理后,黄棪的中柱细胞间隙较佛手更大,且中柱细胞的管径更为开阔(图1B4)。
2.3 WSD1表达分析及其亚细胞定位
本研究基于前期转录组数据筛选得到的1个根系角质和蜡质生物合成途径中的关键基因WSD1。转录组和荧光定量结果显示,WSD1基因FPKM值趋势与荧光定量验证结果趋势一致(图2)。亚细胞定位分析结果显示,其发光部位位于质膜(图3),与亚细胞定位预测结果一致。
根部WSD1的表达量如图4所示,在佛手组中,氟处理后根系WSD1的相对表达量急剧增长,其中50 mg·L-1氟处理1 d的根系(F-50/1)相对表达量最高;在黄棪组中,氟处理后根系WSD1的相对表达量同样大幅增长,其中50 mg·L-1氟处理16 d的样品(H-50/16)的相对表达量最高。
2.4 WSD1蛋白互作调控网络的预测及分析
通过String数据库和PlantTFDB在线网站对WSD1蛋白互作网络和转录因子调控网络进行预测,结果表明,有9个功能基因和3个转录因子可能与WSD1蛋白存在互作关系(图5和表4)。将蛋白互作预测结果与转录组FPKM值进行相关性分析,结果显示基因CSS0041298(相关系数为﹣0.58)、CSS0012327(相关系数为﹣0.59)、CSS0049082(相关系数为﹣0.54)与WSD1基因呈显著负相关(图6)。
3 讨论
3.1 不同茶树品种根系生长及氟富集差异
茶树具备氟富集的能力,并且不同茶树品种表现出不同的氟富集能力。根系富集结果表明,茶树根系对于氟环境的适应具有选择性,更适应低浓度的氟环境,在高浓度的氟环境下也具备一定程度的富集能力。在不同氟浓度处理下,黄棪根系氟富集系数均高于佛手,表明其氟富集能力较强,这与氟富集茶树品种的差异特性相互印证。佛手的氟富集能力较弱,在高氟处理下受胁迫严重,处理16 d后其富集系数<1,推测是由于佛手根系吸收的氟在更短的时间内向地上部转运,故此时根系富集系数相对较低。研究表明[25],新鲜蔬菜中氟含量一般较低;在同一条件下生长的红松、大叶黄杨、柏、桑樹和杉等木本植物含氟量分别为12、8.0、6.0、24、14 mg·kg-1。佛手茶树品种相较于其他植物仍具有较高的氟富集能力,说明茶树对氟的富集能力与耐受性之间存在互相独立、彼此区别的特点。耐受性可能仅受某个主效基因所调控,而多基因调控氟的超量吸收[26]。
3.2 不同氟富集茶树品种根系组织细胞形态差异
根系作为茶树吸收氟的重要器官,在高浓度氟环境下会受到一定程度的毒害,不仅会损伤根尖细胞,还会影响细胞壁、线粒体等细胞器。本研究通过SEM技术分析发现,不同氟富集茶树品种的根系在经过氟处理后其表面结构和亚细胞结构均受到了不同程度的影响。黄棪根部表皮细胞经过50 mg·L-1氟处理后仅表现出表面轻微干裂,而佛手的根部表皮细胞则十分敏感,细胞界限模糊,覆盖蜡质明显增多,表现出对氟不耐受的症状。两个品种茶树经高氟处理后,根部蜡质范围均有所扩增,可能是由于高氟环境迫使茶树根系启动响应逆境胁迫的保护机制,合成更多蜡质来保护茶树根系表皮细胞。与黄棪相比,佛手在氟处理后根系蜡质更多,推测是由于佛手作为氟低富集品种,对于氟富集的饱和程度趋近临界,因此表现更为不耐受,机体通过合成更多蜡质的方式减轻氟对根系造成的生理胁迫[22,27]。本研究表明,高氟环境均会不同程度地抑制不同氟富集茶树根系的正常生长;氟低富集茶树品种佛手的根系在高氟环境下受胁迫严重;氟高富集茶树品种黄棪的根系在高氟环境下虽受到胁迫,但仍耐受。
3.3 调控茶树合成蜡质相关基因
蜡质作为角质层的一部分,可以抵御环境压力,保护植物免受水分流失和紫外线辐射,是植物的一层天然屏障。在花花柴(Karelinia caspia)表皮蜡质的合成途径中,KcP-450-77A和KcHHT共同参与角质、软木脂和蜡质的合成[28-29]。拟南芥ERF13负调控KCS16的表达,KCS16编码一种参与VLCFAs生物合成的脂肪酸延伸酶[30],过表达KCS16和外源施加VLCFAs可以弥补ERF过表达株系中侧根出现的缺陷[31]。转录因子MdERF2通过调控苹果表皮蜡质合成关键基因的表达,改变蜡质的形态和组分含量,参与表皮蜡质合成的调控,推测可能进一步影响果实表皮蜡质的功能[32]。Park等[33]研究表明,AP2/ERF类转录因子WRI4可以正向调节LACS1、KCS1和WSD1的表达。WAX INDUCER(WIN)/SHINE(SHN)是AP2家族的一類重要成员,作为转录因子参与调控蜡质合成的同时,其自身的表达也受到其他转录因子的负调控[34]。在不同植物中,在蜡质合成途径中WSD1受到不同基因的调控。本研究通过蛋白互作调控网络预测,鉴定到细胞色素P450蛋白(CSS0041298)、多药及毒性化合物排出转运体蛋白(CSS0012327)和AP2/ERF家族转录因子(CSS0049082),并通过相关性分析发现其与WSD1显著负相关,因此推测CSS0041298、CSS0012327、CSS0049082可能通过负调控WSD1的表达,影响氟处理下茶树根部蜡质的合成。蜡质的化学成分与植物-病原体的相互作用有关。因此,经氟处理后,WSD1的大量诱导可能预示其在防御氟胁迫方面的重要作用[35]。50 mg·L-1氟处理16 d后的扫描电镜结果显示,佛手根系比黄棪更不耐受,其表面蜡质合成量细碎密集,推测是由于酶基因活性的提高促进了茶树根表面蜡质的形成和积累,增强抵御高浓度、长时间氟胁迫环境的能力,是茶树根系应对逆境胁迫的一种自我保护机制[36-38]。
目前,对于外源氟处理下调控茶树根系蜡质合成相关基因的研究仍较为浅显,还需要进行深入挖掘,进一步验证其基因功能。另外,还可以研究代谢途径,探究不同关键基因协调作用的模式,构建完整的茶树氟吸收富集模型,并将研究结果充分应用到实践中,为氟低富集茶树品种的选育提供技术手段。
参考文献
[1] Shu W S, Zhang Z Q, Lan C Y, et al. Fluoride and aluminium concentrations of tea plants and tea products from Sichuan Province, PR China [J]. Chemosphere, 2003, 52(9): 1475-1482.
[2] 邢安琪, 武子辰, 徐晓寒, 等. 茶树富集氟的特点及其机制的研究进展[J]. 茶叶科学, 2022, 42(3): 301-315.
Xing A Q, Wu Z C, Xu X H, et al. Research advances of fluoride accumulation mechanisms in tea plants (Camellia sinensis) [J]. Journal of Tea Science, 2022, 42(3): 301-315.
[3] 刘艳丽, 金孝芳, 曹丹, 等. 茶树铝、氟富集研究进展[J]. 植物科学学报, 2016, 34(6): 972-977.
Liu Y L, Jin X F, Cao D, et al. Current progress in aluminum and fluoride accumulation in the tea plant [J]. Plant Science Journal, 2016, 34(6): 972-977.
[4] Zhang W H, Cai Y, Tu C, et al. Arsenic speciation and distribution in an arsenic hyperaccumulating plant [J]. The Science of the Total Environment, 2002, 300(1/2/3): 167-177.
[5] Salt D E, Blaylock M, Kumar N P, et al. Phytoremediation: a novel strategy for the removal of toxic metals from the environment using plants [J]. Biotechnology, 1995, 13(5): 468-474.
[6] 王琼琼. 茶树稀土和氟铝元素积累特性及基因型差异研究[D]. 福州: 福建农林大学, 2015.
Wang Q Q. Study on accumulation characteristics and genotypic differences of rare earth and aluminum fluoride in tea plants [D]. Fuzhou: Fujian Agriculture and Forestry University, 2015.
[7] 贾培凝. 氟高低富集茶树响应氟处理的生理差异及转录组分析[D]. 福州: 福建农林大学, 2021.
Jia P N. Physiological differences and transcriptome analysis of tea plants enriched with high and low fluoride in response to fluoride treatment [D]. Fuzhou: Fujian Agriculture and Forestry University, 2021.
[8] 李春雷. 氟对茶树幼苗生理生化的影响及其作用机制研究[D]. 武汉: 华中农业大学, 2011.
Li C L. Study on the effect and mechanism of fluoride in the physiology and biochemistry of tea seedings [D]. Wuhan: Huazhong Agricultural University, 2011.
[9] Zhang L, Li Q, Ma L F, et al. Characterization of fluoride uptake by roots of tea plants (Camellia sinensis (L.) O. Kuntze) [J]. Plant & Soil, 2013, 366(1/2): 659-669.
[10] 向勤锃, 刘德华. 氟对人体的作用及茶树富氟的研究进展与展望[J]. 茶叶通讯, 2002(2): 34-37.
Xiang Q Z, Liu D H. Progress and prospect of fluorine on human body and research of fluorine rich in tea tree [J]. Journal of Tea Communication, 2002(2): 34-37.
[11] 唐茜, 赵先明, 杜晓, 等. 氟对茶树生长, 叶片生理生化指标与茶叶品质的影响[J]. 植物营养与肥料学报, 2011, 17(1): 186-194.
Tang Q, Zhao X M, Du X, et al. Effects of fluorine stress on growth, physiological-biochemical characteristics and quality of tea leaves [J]. Journal of Plant Nutrition and Fertilizer, 2011, 17(1): 186-194.
[12] 杨晓, 张月华, 余志, 等. 氟对茶树生理的影响及茶树耐氟机制研究进展[J]. 华中农业大学学报, 2015, 34(3): 142-146.
Yang X, Zhang Y H, Yu Z, et al. Physiological effects of fluoride on tea plant and fluoride-resistant mechanism of tea [J]. Journal of Huazhong Agricultural University, 2015, 34(3): 142-146.
[13] Li C L, Ni D J. Effect of fluoride on chemical constituents of tea leaves [J]. Fluoride, 2009, 42(3): 237-243.
[14] 方興汉, 吴采. 茶树某些矿质元素缺乏症和过量症的研究[J]. 中国茶叶, 1984, 6(2): 19-21, 41.
Fang X H, Wu C. Study of certain mineral deficiency and excess elements in tea trees [J]. China Tea, 1984, 6(2): 19-21, 41.
[15] 彭传燚. 茶树氟富集规律、亚细胞分布及在叶片表面存在形态的研究[D]. 合肥: 安徽农业大学, 2011.
Peng C Y. Study on fluoride accumulation, subcellular distribution of tea plant and its chemical form in leaf surface [D]. Hefei: Anhui Agricultural University, 2011.
[16] Li C, Zheng Y, Zhou J, et al. Changes of leaf antioxidant system, photosynthesis and ultrastructure in tea plant under the stress of fluorine [J]. Biologia Plantarum, 2011, 55(3): 563-566.
[17] 杨贤鹏, 王宙雅, 高翔, 等. 植物表皮蜡质生物合成及调控[J]. 中国生物工程杂志, 2016, 36(9): 75-80.
Yang X P, Wang Z Y, Gao X, et al. Research progress in plant cuticular wax biosynthesize and regulation [J]. Journal of Chinese Biotechnology, 2016, 36(9): 75-80.
[18] Kim M S, Shim K B, Park S H, et al. Changes in cuticular waxes of developing leaves in sesame (Sesamum indicum L.) [J]. Journal of Crop Science & Biotechnology, 2009, 12(3): 161-167.
[19] Kunst L, Samuels L. Plant cuticles shine: advances in wax biosynthesis and export [J]. Current Opinion in Plant Biology, 2009, 12(6): 721-727.
[20] Li F L, Wu X M, Lam P, et al. Identification of the wax ester synthase/acyl-coenzyme A: diacylglycerol acyltransferase WSD1 required for stem wax ester biosynthesis in Arabidopsis [J]. Plant Physiology, 2008, 148(1): 97-107.
[21] Rowland O, Zheng H Q, Hepworth S R, et al. CER4 encodes an alcohol-forming fatty acyl-coenzyme A reductase involved in cuticular wax production in Arabidopsis [J]. Plant Physiology, 2006, 142(3): 866-877.
[22] 王丽霞. 茶树对氟的富集及其生理响应机制研究[D]. 杨凌: 西北农林科技大学, 2014.
Wang L X. Study on the enrichment of fluoride in tea plant and its physiological response mechanism [D]. Yangling: Northwest A&F University, 2014.
[23] 郭素枝. 扫描电镜技术及其应用[M]. 厦门: 厦门大学出版社, 2006.
Guo S Z. Scanning electron microscopy and its application [M]. Xiamen: Xiamen University Press, 2006.
[24] Chen C J, Chen H, Zhang Y, et al. TBtools: an integrative toolkit developed for interactive analyses of big biological data [J]. Molecular Plant, 2020, 13(8): 1194-1202.
[25] 吴代赦, 吴铁, 董瑞斌, 等. 植物对土壤中氟吸收、富集的研究进展[J]. 南昌大学学报(工科版), 2008(2): 103-111.
Wu D S, Wu T, Dong R B, et al. Advances in absorption and enrichment of soil fluoride by plants [J]. Journal of Nanchang University (Engineering & Technology), 2008(2): 103-111.
[26] Mao B G, Cheng Z J, Lei C L, et al. Wax crystal-sparse leaf2, a rice homologue of WAX2/GL1, is involved in synthesis of leaf cuticular wax [J]. Planta, 2011, 235(1): 39-52.
[27] 李春雷. 氟對茶树幼苗生理生化的影响及其作用机制研究[D]. 武汉: 华中农业大学, 2011.
Li C L. Effects of fluoride on physiology and biochemistry of tea seedlings and its mechanism [D]. Wuhan: Huazhong Agricultural University, 2011.
[28] 张进献, 李冬杰, 李宏杰. 果实软化过程中细胞壁结构和组分及细胞壁酶的变化[J]. 河北林果研究, 2007, 22(2): 180-182.
Zhang J X, Li D J, Li H J. Changes of cell wall structure, composition and hydrolytic enzymes in fruit softening process [J]. Forestry and Ecological Sciences, 2007, 22(2): 180-182.
[29] 许疆维, 王彦芹. 花花柴蜡质合成相关基因的克隆及分析[J]. 基因组学与应用生物学, 2021, 40(s3): 3199-3208.
Xu J W, Wang Y Q. Cloning and analysis of genes related to waxy synthesis in Karelinia caspia [J]. Genomics and Applied Biology, 2021, 40(s3): 3199-3208.
[30] 悦曼芳, 张春, 吴忠义. 植物转录因子AP2/ERF家族蛋白结构和功能的研究进展[J]. 生物技术通报, 2022, 38(12): 11-26.
Yue M F, Zhang C, Wu Z Y. Advances in structure and function of plant transcription factor AP2/ERF family proteins [J]. Biotechnology Bulletin, 2022, 38(12): 11-26.
[31] Lü B S, Wei K J, Hu K Q, et al. MPK14-mediated auxin signaling controls lateral root development via ERF13-regulated very-long-chain fatty acid biosynthesis [J]. Molecular Plant, 2021, 14(2): 285-297.
[32] 孙英杰. MdERF2在苹果表皮蜡质合成中的作用研究[D]. 淄博: 山东理工大学, 2021.
Sun Y J. Effect of MdERF2 on waxy synthesis of apple epidermis [D]. Zibo: Shandong University of Technology, 2021.
[33] Park C S, Go Y S, Suh M C. Cuticular wax biosynthesis is positively regulated by WRINKLED 4, an AP2/ERF-type transcription factor, in Arabidopsis stems [J]. The Plant Journal, 2016, 88(2): 257-270.
[34] Lisso J, Schr?der F, Schippers J H M, et al. NFXL2 modifies cuticle properties in Arabidopsis [J]. Plant Signaling & Behavior, 2012, 7(5): 551-555.
[35] Bernard A, Joubès J. Arabidopsis cuticular waxes: advances in synthesis, exportand regulation [J]. Progress in Lipid Research, 2013, 52(1): 110-129.
[36] 徐劼. 茶樹(Camellia sinensis L.)对铅的吸收累积及耐性机制研究[D]. 杭州: 浙江大学, 2011.
Xu J. Mechanisms of lead uptake/accumulation and tolerance in tea plant (Camellia sinensis L.) [D]. Hangzhou: Zhejiang University, 2011.
[37] 段瑞君, 王爱东, 陈国雄. 植物角质层基因研究进展[J]. 植物学报, 2017, 52(5): 637-651.
Duan R J, Wang A D, Chen G X. Advances in study of plant cuticle genes [J]. Chinese Bulletin of Botany, 2017, 52(5): 637-651.
[38] 张弋. 茶树叶片角质层蜡质组成特征与角质蒸腾的关系研究[D]. 福州: 福建农林大学, 2020.
Zhang Y. Study on the correlation between cuticular wax composition and cuticular transpiration in Camellia sinensis leaves [D]. Fuzhou: Fujian Agriculture and Forestry University, 2020.

