基于PGIP基因的蔷薇科植物分子进化树构建与分析
朱佩佩++李艳梅++侯泳志++杨英军


摘要:从NCBI网站筛选到97条蔷薇科植物PGIP基因序列,用邻位相接法构建系统进化树,分析他们之间的亲缘关系。结果表明,蔷薇科植物PGIP基因可聚为17个类群,这与传统的分类结果基本一致,初步探讨了吐根树、耆叶梅、Cercocarpus ledifolius、Purshia tridentate、Horkelia cuueata和卡塔林硬木的亲缘关系,对进一步研究蔷薇科植物之间进化与亲缘关系提供参考。
关键词:蔷薇科植物;PGIP基因;分子进化树;亲缘关系
中图分类号:Q78 文献标识码:A 文章编号:0439-8114(2016)21-5672-05
DOI:10.14088/j.cnki.issn0439-8114.2016.21.059
Construction and Analysis of Molecular Phylogenetic Tree of
Rosaceae plants Based on PGIP gene
ZHU Pei-pei, LI Yan-mei, HOU Yong-zhi, YANG Ying-jun
(College of Forestry, Henan University of Science and Technology, Luoyang 471003, Henan,China)
Abstract: 133 PGIP genes of Rosaceae family from the NCBI web site were obtained, 97 complete available sequences were screened for using to analyse the evolutionary relationship. Molecular dendrograms were constructed by using MEGA6 methods. Phylogenetic tree analysis showed that PGIP genes can be mainly divided into 17 groups,and the classification results were the same as the based on traditional ways. The PGIP genes evolutionary relationship from Porteranthus trifoliatus,Chamaebatiaria millefolium,Cercocarpus ledifolius,Purshia tridentate、Horkelia cuueata and Lyonothamnus floribundus had the closest relationships. The study provided theoretical basis for the genetic evolution of Rosaceae plants.
Key words: Rosaceae;PGIP genes;molecular phylogenetic tree;genetic relationship
薔薇科(Rosaceae)是一类重要的植物种类,目前全世界约有124属,3 300余种,主要分布于北半球温带地区。中国共有51属,1 000余种。本科植物中大多数种类果实含丰富的维生素、糖和有机酸等,有许多是重要的水果和干果,也是一些重要的食品与医药的加工原料。
植物在自然界中受到各种病菌侵害的危险。病菌菌丝侵染植物细胞壁时,能分泌多种水解细胞壁的酶,如多聚半乳糖醛酸酶(Polygalacturonase,PG)、果胶甲基酯酶(Pectin methylesterase,PME)、果胶裂解酶(Pectate lyase)等[1]。其中多聚半乳糖醛酸酶可以降解植物细胞壁中的果胶、破坏细胞的完整性[2,3]。植物在抵御病原菌的进化中,也步形成了一系列自卫防御机制,如生成多聚半乳糖醛酸酶抑制蛋白(Polyga-lacturonase inhibiting protein,PGIP)。PGIP是一种特异性结合和抑制真菌内切PG活性的植物防御蛋白,能专一性、可逆地与真菌多聚半乳糖酶结合,竞争性抑制病原菌PG酶的活性,阻断病原菌的侵染和抑制相应病害的发生[1,4]。此外,PGIP在与PG的相互作用使植物细胞壁形成有生物活性的寡聚半乳糖醛酸(Oligogalacturonide,OG),能有效地激活植物体内的防御系统,从而诱导植物的抗病性响应,植物获得系统抗病性[5]。在植物免疫方面,PG-PGIP的互作方式已成为蛋白质识别的模式系统[6]。另有报道, PGIP还与花器官发育[7,8]、种子萌发[9]、胁迫反应、果实冷藏和果实的病虫害响应有关[10]。因而,PGIP的研究已成为抗病基因工程和果实耐贮藏基因工程研究的热点。研究人员已经克隆了多种植物PGIP基因[11-18]。
目前,世界主要的数据库已经收录了多种植物 PGIP基因序列信息,本研究对蔷薇科植物PGIP基因序列进行筛选、整理,经过比对、分析,探讨蔷薇科植物各属各种之间的进化与演化关系,为蔷薇科植物分类、鉴定和新品种选育奠定基础。
1 材料与方法
1.1 数据来源与获得
所有序列信息主要来自美国NCBI(The National Center for Biotechn-ology Information)网站,进入NCBI主页(http://www.ncbi.nlm.nih.gov),选择下载序列。
1.2 方法
1.2.1 数据甄别与筛选 打开下载的基因序列,查看序列信息,将非PGIP基因、长度极短序列全部排除,整理筛选序列,备用。
1.2.2 数据分析 运用MEGA6软件进行多序列比对,并用邻接法(Neighbor-Joining)构建N-J进化树,并采用Bootstrap 1 000检验分子系统树各分支的置信度。
2 结果与分析
2.1 基因序列搜索
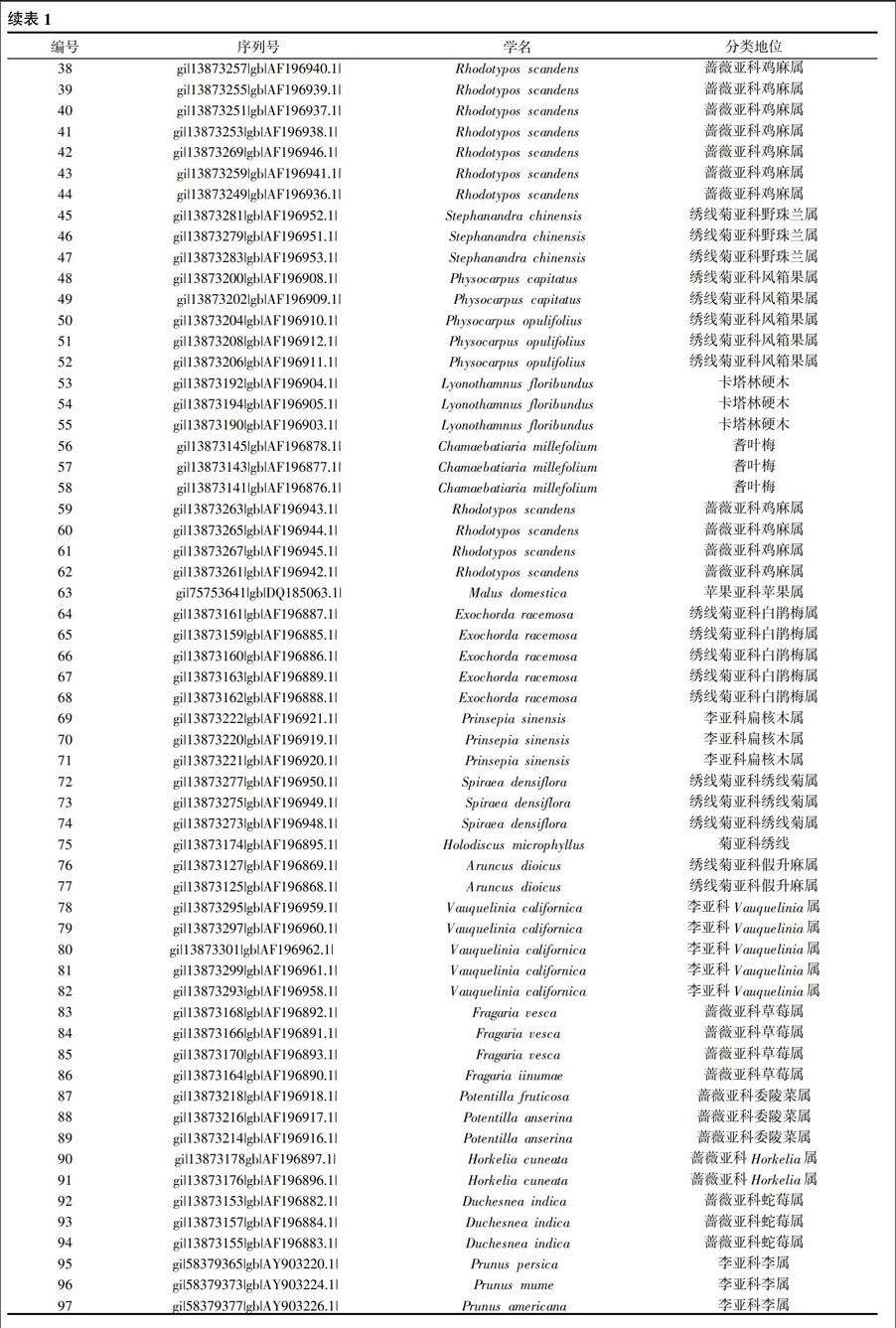
至2014年5月30日,在NCBI数据库中搜索可以得到蔷薇科植物PGIP基因序列共计133条。经过进一步筛选,共得到97条准确可用的基因序列(表1)。
2.2 聚类分析
2.2.1 系统发育分析 对97条基因序列运用MEGA6软件进行比对,并用邻接法构建分子进化树(图1)。
通过对进化树的分析,可见蔷薇科植物的97条PGIP基因序列大致可以分为十七个类群(表2),其中属于苹果亚科的植物23个,被分在3个群中,蔷薇亚科的植物28个,分在4个群中,绣线菊亚科植物19个分在3个群中,李亚科植物6个分在2个群中,还有一个群中含有蔷薇亚科、李亚科两个亚科,有4个群的植物分类地位没有确定。各群所含有的植物数量不同,但这些植物的PGIP基因序列在或远或近的距离内先后聚类到一起,说明PGIP基因在这些植物的某方面存在类似的特征或特性。
3 小结与讨论
植物病菌菌丝侵染植物时,会释放出PG破坏植物的细胞壁。PGIP作为细胞壁结合的特异性蛋白质能够与病原菌PGs专一地、可逆地结合,形成一种高亲和的复合物抑制endo-PG活性,激活包括PGIPs在内的一系列防卫相关基因,增强植物的抗病性以抵御病原真菌的侵入[4,5]。据初步统计,国内外已先后从蔷薇科的许多植物中克隆了PGIP基因,并对其基因序列和氨基酸序列、蛋白质的高级结构和组织特异性表达、PGIP在植物抗病中的作用以及在抗病育种中的应用进行了深入研究[12,16]。
本研究在Genebak上搜索得到有关蔷薇科植物PGIP基因序列共计133条,除去长度过长或过短的序列,以及非DNA序列,一共得到97个物种的97条可以使用的序列。通过MEGA软件对PGIP基因序列进行系统进化分析,绘制同源进化树。
在PGIP基因序列聚类分析中,蔷薇科的4个亚科植物按照PGIP基因序列相似性程度的高低,基本依照传统的种属亲缘关系先后聚类在不同的群中,表明根据基因序列进行物种的演化分析是可行的。PGIP基因序列的相似性越高,则越先聚在一起。其中也有一些属于同一亚科的植物却聚在不同的聚群中,这可能與序列所属的物种的种属亲缘关系较远或者是PGIP的相似性差异较大。
吐根树、耆叶梅(蕨叶属的一种)、蕨叶属、Cercocarpus ledifolius、Purshia tridentate、Horkelia cuueata和卡塔林硬木等都是原产于北美山区的灌丛、林地或森林野生植物,它们物种的分类地位不够明确。本研究聚类结果表明,吐根树、Cercocarpus ledifolius、耆叶梅、蕨叶属和Purshia tridentate的PGIP基因序列在较近的距离内相聚,可能表明其亲缘关系可能较近,卡塔林硬木与绣线菊亚科和蔷薇亚科植物并列,显示了他们之间较远的亲缘关系。Horkelia cuueata是原产于美洲的蔷薇科植物,目前尚未确定其分类地位,聚类结果显示,其PGIP基因序列与委陵菜属植物和蛇莓属植物在较近的距离内相聚,表明他们之间的亲缘关系可能较近。这些结果为进一步研究蔷薇科各亚科植物的起源、演化与亲缘关系了提供参考。
参考文献:
[1] JUGE N. Plant protein inhibitors of cell wall degrading enzymes[J].Trends Plant Sci,2006,11:359-367.
[2] HAMANN T.Plant cell wall integrity maintenance as an essential component of biotic stress response mechanisms[J].Front Plant Sci,2012,3:1-5.
[3] ESQUERRE-TUGAYE M T,BOUDARD G,DUMAS B.Cell wall degrading enzymes, inhibitory proteins, and oligosaccharides participate in the molecular dialogue between plants and pathogens[J].Plant Physiol Biochem,2000,38:157-163.
[4] DE LORENZO G,DOVIDIO R,CERVONE F.The role of polygalactu-ronase-inhibiting proteins(PGIPs) in defense against pathogenic fungi[J].Annu Rev Phytopathol,2001,39:313-335.
[5] DOVIDIO R,MATTEI B,ROBERTIA S,et al. Polygalactu-ronases,polygalacturonase-inhibiting proteins and pectic oligomers in plant-pathogen interactions[J].Biochim Biophys Acta,2004, 1696:237-244.
[6] MISAS-VILLAMIL J C,VAN DER HOORN R A.Enzyme-inhibitor inter-actions at the plant-pathogen interface[J].Curr Opin Plant Biol,2008,11:380-388.
[7] HUANG L,LIU Y,YU X L,et al.A polygalacturonase inhibitory protein gene(BcMF19) expressed during pollen development in Chinese cabbage-pak-choi[J].Mol Biol Rep,2011,38:545-552.
[8] Shi H Y,Zhu L,Zhou Y,et al.A cotton gene encoding a polygalacturonase inhibitor-like protein is specifically expressed in petals[J].Acta Biochim Biophys Sin,2009,41:316-324.
[9] KANAI M,NISHIMURA M,HAYASHI M. A peroxisomal ABC transporter promotes seed germination by inducing pectin degradation under the control of ABI5[J].Plant J,2010,62:936-947.
[10] YAO C,CONWAY W S,REN R,et al. Gene encoding polygalacturonase inhibitor in apple fruit is developmentally regulated and activated by wounding and fungal infection[J]. Plant Mol Biol,1999,39:1231-1241.
[11] DI C X,LI M,LONG F,et al. Molecular cloning,functional analysis and localization of a novel gene encoding polygalacturonase-inhibiting protein in Chorispora bungeana[J].Planta, 2009,231:169-178.
[12] YAO C L,CONWAY W S. Purification and characterization of a polygalacturonase-inhibiting protein from apple fruit[J]. Biochem Cell Biol,1995,85:1373-1377.
[13] DEO A,SHASTRI N V. Purification and characterization of polygalacturonase-inhibitory proteins from Psidium guajava Linn.(Guava) fruit[J].Plant Sci,2003,164:147-156.
[14] MACHINANDIARENA M F,OLIVIERI F P,DALEO G R. Isolation and characterization of a polygalacturonase-inhibiting protein from potato leaves. Accumulation in response to salicylic acid,wounding and infection[J].Plant Physiol Biochem, 2001,39:129-136.
[15] FISH W W,DAVIS A R. The purification, physical/chemical characterization,and cDNA sequence of cantaloupe fruit polygalacturonase-inhibiting protein[J].Phytopathology,2004,94:337-344.
[16] STOTZ H U,POWELL A L,DAMON S E,et al. Molecular characterization of a polygalacturonase inhibitor from Pyrus communis L. cv. Bartlett[J].Plant Physiol,1993,102:133-138.
[17] 武彥霞,田建保,曹秋芬,等.扁桃PGIP基因的克隆及其序列分析[J].果树学报,2008(25):54-59.
[18] 罗 娅,汤浩茹,张 勇,等.草莓多聚半乳糖醛酸酶抑制蛋白基因(PGIP)的克隆及组织特异性表达[J].农业生物技术学报,2010,18(3):424-430.

