子痫前期患者胎盘组织中缺氧诱导因子-1α表达及其与血管生成的关系
李静亚,蔡素霞,张广裕
(洛阳市妇幼保健院 a.病理科;b.产房,河南 洛阳 471099)
子痫前期为妊娠期特发的高血压疾病,以妊娠20周后新发高血压及蛋白尿为主要特点,病情可持续进展,甚至引起凝血功能障碍和终末器官功能障碍[1]。研究表明,血管内皮细胞受损、子宫-胎盘血管结构异常及炎症免疫的过度激活均可能与子痫前期的发生有关[2-3]。胎盘组织中的血管可给予胎儿足够的营养物质和氧气,若血管生成存在异常,会导致胎儿无法正常发育。因此,需要分析与胎盘组织血管生成有关的指标,根据相关指标对子痫前期患者作出治疗的指导干预,从而促进良性妊娠结局。缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)为介导细胞参与缺氧反应的重要转录调控因子,通过对下游多种靶基因调控可参与细胞增殖和迁移、机体血管生成及细胞凋亡等过程[4]。因此,推测胎盘组织中HIF-1α的表达可能与子痫前期血管生成有关。
1 资料与方法
1.1 一般资料
前瞻性选取2019年1月至2023年1月于洛阳市妇幼保健院接受治疗并成功分娩的80例子痫前期患者,另外选取50例同期健康孕妇为对照组。所有孕妇及其家属均签署知情同意书,本研究经医院医学伦理委员会审核批准。
参照第9版《妇产科学》[5]中重度子痫前期的相关内容:(1)血小板减少,血小板<100×109·L-1;(2)收缩压≥160 mmHg(1 mmHg=0.133 kPa)或舒张压≥110 mmHg;(3)肾功能损害;(4)出现持续性上腹或右上腹严重疼痛,肝功能损害,无法用其他疾病解释或二者均存在;(5)新发生的视觉障碍或中枢神经系统异常;(6)肺水肿。将符合上述任何一种表现的患者纳入重症组,其余患者纳入轻症组。
轻症组共纳入48例患者,年龄25~35岁,平均(30.15±2.36)岁;体重51~73 kg,平均(62.43±5.74)kg;确诊孕周24~32周,平均(28.47±1.95)周。重症组共纳入32例患者,年龄23~34岁,平均(29.05±2.17)岁;体重50~72 kg,平均(62.51±4.84)kg;确诊孕周25~33周,平均(29.36±2.04)周。对照组年龄26~33岁,平均(29.54±2.44)岁;体重52~74 kg,平均(63.54±5.83)kg;确诊孕周 25~31周,平均(28.37±2.13)周。3组一般资料比较,差异无统计学意义(P>0.05)。
纳入标准:子痫前期孕妇符合子痫前期诊断标准[6];单胎妊娠;交流能力正常;依从性良好,可配合完成此次研究。排除标准:患有其他妊娠并发症,如异位妊娠、妊娠急性脂肪肝等;患有传染性疾病;患有精神病或交流障碍;患有心脏病。
1.2 胎盘组织标本准备
于孕妇分娩后,避开梗死和钙化区,在胎盘中心母体面取约2 cm×2 cm×2 cm全层胎盘组织为标本,标本获取后用生理盐水冲洗分为2份,其中一份使用体积分数为4%的甲醛水溶液固定,用免疫组化检测,并通过CD34双标法检测胎盘组织的微血管密度。另一份置于RNA酶灭活冻存管中,使用液氮速冻,随后保存在-80 ℃的密闭环境。
1.3 免疫组化检测
用石蜡将体积分数为4%的甲醛水溶液固定的胎盘组织标本脱水后包埋并切片,行免疫组化染色,检测HIF-1α水平(链霉菌抗生物素蛋白-过氧化物酶连接法),试剂盒由上海酶联生物科技公司提供。应用不同高倍视野分别观察组织切片,阳性标准为细胞中出现较清晰的棕黄色颗粒。判定染色强度分值:3分为细胞中出现大量棕黄色颗粒,2分为细胞中出现较多棕黄色颗粒,1分为细胞中出现少量棕黄色颗粒,0分为细胞中未出现棕黄色颗粒。判定观察到的阳性细胞占比分值:4分为占比>80%,3分为占比60%~80%,2分为占比40%~60%,1分为占比20%~40%,0分为占比<20%。将染色强度分值与阳性细胞占比分值相乘,阴性记0分,弱阳性记1~4分,阳性记5~8分,强阳性记9~12分。强阳性和一般阳性为HIF-1α高表达,弱阳性和阴性为HIF-1α低表达。
1.4 RT-PCR检测
将RNA酶灭活冻存管中的胎盘组织标本取出,采用逆转录-聚合酶链反应扩增引物,使用总RNA抽提试剂TRIZOL提取胎盘组织总RNA,将β-actin作为参照物,取5 μL PCR产物在琼脂糖凝胶中电游,检测胎盘组织中的HIF-1αmRNA,HIF-1α基因引物序列见表1。
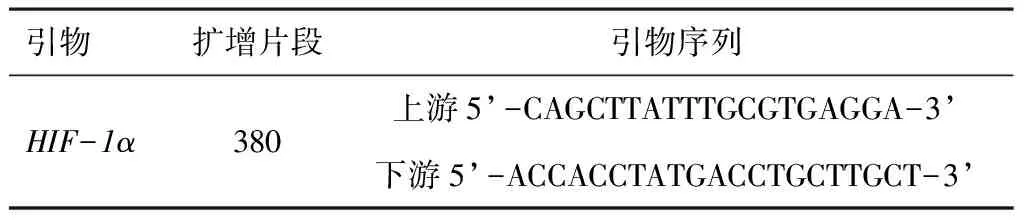
表1 HIF-1α基因引物序列
1.5 凝血指标检测
3组孕妇入组后,采集空腹静脉血5 mL放置在抗凝管内,使用鸿恩H1203全自动凝血分析仪检测血浆凝血酶原时间(prothrombin time,PT)、活化部分凝血活酶时间(activated partial thromboplastin time,APTT)、纤维蛋白原(fibrinogen,Fib)指标水平。
1.6 统计学方法
2 结果
2.1 微血管密度
对照组孕妇胎盘组织的微血管密度最高,轻症组次之,重症组最低,组间差异有统计学意义(P<0.05)。见表2。
表2 3组孕妇胎盘组织微血管密度对比
2.2 HIF-1α mRNA和凝血指标
重症组HIF-1αmRNA、Fib水平高于轻症组和对照组,且轻症组高于对照组;重症组APTT、PT低于轻症组和对照组,且轻症组低于对照组,组间差异有统计学意义(P<0.05)。见表3。
表3 3组胎盘组织HIF-1α mRNA和凝血指标对比
2.3 HIF-1α蛋白免疫组化表达
3组胎盘组织中均有HIF-1α阳性表达,重症组HIF-1α总阳性表达率高于轻症组与对照组,轻症组高于对照组,组间差异有统计学意义(P<0.05)。见表4。
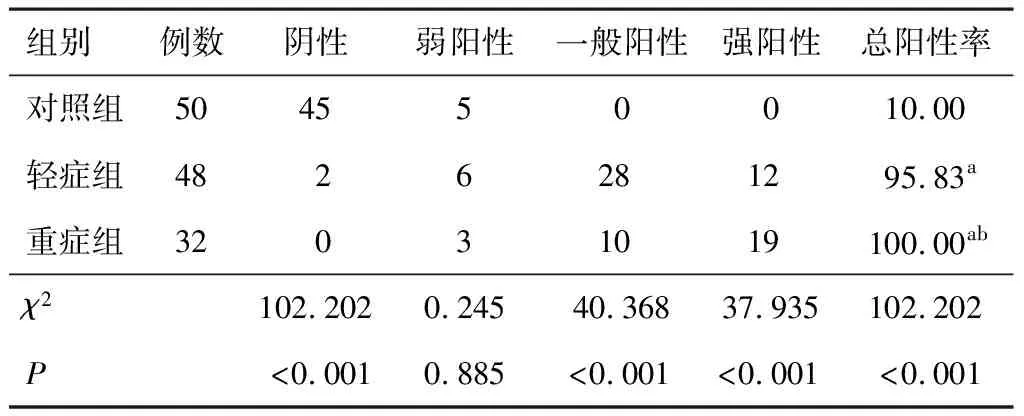
表4 3组胎盘组织中HIF-1α阳性检出情况比较(n,%)
2.4 胎盘组织中HIF-1α表达与血管生成的相关性分析
经双变量相关性分析检验结果显示,子痫前期患者胎盘组织中HIF-1α相对表达量与血管生成(微血管密度)呈负相关(r=-0.938,P<0.001)。
3 讨论
子痫前期属于妊娠期高血压疾病的一种,目前,疾病病因和具体发病机制尚未完全明确,通常认为是多因素、多机制及多通路导致的疾病[7]。妊娠期孕妇血压升高导致血管阻力变大,胎盘血流变少,容易引起孕妇血管病变和内皮功能障碍,增加胎盘病变和发生子痫前期的风险[8]。子痫前期患者的胎盘组织中血管生成呈现异常状态,容易引起胎盘缺血、缺氧,并释放多种诱发炎症反应的胎盘因子[9-10]。
本研究结果显示,重症组孕妇胎盘组织中的微血管密度低于轻症组和对照组,且轻症组孕妇低于对照组,表明子痫前期患者病情越重,胎盘组织中血管生成情况越差。因胎盘的血管是为胎儿提供营养物质的关键介质,因此分析可能与血管生成有关的指标较为关键。APTT、PT、Fib 凝血指标是判断机体凝血功能状态和凝血酶活性的标准,可反映患者体内凝血因子和纤维蛋白原释放量[11]。子痫前期患者的凝血功能障碍,会增加胎盘组织中血管被堵塞的分险,不利于血管生成[12]。本研究结果显示,重症组孕妇APTT、PT水平低于轻症组和对照组,轻症组低于对照组,而重症组孕妇Fib水平高于轻症组和对照组,轻症组高于对照组,表明子痫前期患者体内凝血-抗凝血系统存在紊乱现象,血液处于高凝状态。但由于患者体内凝血因子的水平还受到饮食、药物、自身免疫力等多种因素的影响,若单纯将其用于子痫前期患者胎盘组织中血管生成的评价可能准确性不高,所以本研究未将其作为主要的指标进行研究。
HIF-1α参与了体内细胞代谢、血管功能调节的过程,是机体适应缺氧环境的主要调节因子[13]。HIF-1α异常过表达时,会控制组织内的细胞增殖,抑制胎盘滋养细胞的发育[14]。因此,推测HIF-1α表达可能与胎盘组织中的血管生成有关。本次研究发现,重症组HIF-1αmRNA表达水平高于轻症组和对照组,轻症组孕妇高于对照组,同时重症组孕妇HIF-1α总阳性表达率高于轻症组和对照组,轻症组孕妇高于对照组。这表明在子痫前期患者中,HIF-1α呈现异常过表达,且随着患者病情加重,这种过表达的情况更为明显。分析原因,HIF-1α作为介导细胞参与缺氧反应的重要转录调控因子,能够和细胞中稳定表达的HIF-1β结合成具有高度活性的二聚体,参与胎盘组织中缺氧反应的表达,稳定缺氧环境,造成胎盘缺血情况更加严重[15]。HIF-1α还能够控制细胞因子分泌,对胎盘滋养细胞功能产生影响,子痫前期患者体内的胎盘因子有可能是受到HIF-1α刺激而释放出来,导致血管内皮损伤加剧,从而严重影响胎盘组织中的血管生成,加重了子痫前期患者的病情[16]。为进一步明确HIF-1α相对表达量与胎盘组织中微血管密度的关系,本研究进行了双变量相关性分析检验,结果显示,子痫前期患者胎盘组织中HIF-1α相对表达量与微血管密度呈负相关,证明在胎盘组织中高表达水平的HIF-1α与血管生成有关,或可通过导致胎盘组织缺氧缺血,引起胎盘缺血和血管损伤,继而诱发血管生成异常。
4 结论
HIF-1α在子痫前期患者的胎盘组织中高表达,且表达水平和血管生成呈负相关,与患者子痫前期病情严重程度有关。

