DHCR7基因在胃癌中的表达及其与免疫相关基因的关系
王业忠,杨明华,曹少锋,梅璐
(郑州大学第五附属医院 消化内科,河南 郑州 450052)
胃癌是最常见的恶性肿瘤之一,在全世界所有肿瘤中发病率位于第5位,病死率位居第4位[1]。胃癌的主要治疗方式为手术、放疗、化疗和靶向治疗。但胃癌患者多数就诊时已为中晚期,治疗效果欠佳[2]。近年来,免疫治疗在胃癌中取得了重要进展,与常规治疗相比,免疫治疗通过增强肿瘤细胞的免疫功能,产生抗肿瘤作用。免疫检查点抑制剂治疗是一种最主要的免疫疗法。然而,免疫治疗并不是对所有患者都有效果,对一部分人疗效甚微,甚至完全没有作用[3-4],因此需要进一步提高免疫治疗的效果。另外,胃癌具有高度的异质性,在临床上表现出不同的组织病理学类型[5],目前仍缺少有助于选择个性化治疗方案的生物标志物。
7-脱氢胆固醇还原酶(7-dehydrocholesterol reductase,DHCR7)是胆固醇合成中的关键代谢基因,参与体内胆固醇合成途径中的前体物质合成,将7-脱氢胆固醇转化为胆固醇[6]。近年来发现DHCR7在多种肿瘤中呈现异常表达[7-8],但关于胃癌的研究相对较少,因此,本研究通过分析多种数据库中胃癌的测序数据集,探究DHCR7基因在胃癌中的表达与免疫相关基因的关系,为胃癌的免疫治疗提供新的靶点。
1 材料与方法
1.1 数据库分析
通过Ualcan(http://ualcan.path.uab.edu/analysis.html)、TIMER(http://cistrome.dfci.harvard.edu/TIMER/)数据库分析DHCR7在不同类型肿瘤中的表达情况。通过GEPIA(http://gepia.cancer-pku.cn/)数据库[9]、TCGA (https://www.cancer.gov/about-nci/organization/ccg/research/structural-genomics/tcga)数据库以及GEO(https://www.ncbi.nlm.nih.gov/geo/)数据库分析胃癌组织和正常组织中DHCR7的表达差异。通过Kaplan-Meier Plotter(www.kmplot.com)数据库分析DHCR7表达与胃癌患者生存相关性。利用cBioPortal(http://www.cbioportal.org/)数据库[10]找出与DHCR7共表达的基因,并通过R(Pheatmap)软件包展示与DHCR7正负相关的基因。
1.2 GEO数据库数据来源
从GEO数据库中下载GSE79973基因表达数据,测序平台为GPL570(HG-U133_Plus_2)Affymetrix Human Genome U133 Plus 2.0 Array;共有10例胃癌组织与配对的癌旁组织。
1.3 基因功能及通路分析
利用Metascape(https://metascape.org/gp/index.html#/main/step1)基因功能注释分析工具,对与DHCR7基因正负相关基因进行基因本体分析(geneontology,GO)和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析。
1.4 DHCR7表达水平与CD8+T细胞浸润相关性分析
基于TIMER(http://cistrome.dfci.harvard.edu/TIMER/)数据库分析DHCR7在胃癌组织中与CD8+T免疫细胞浸润关系,TIMER数据库综合TIMER、XCELL、MCPCOUNTER、 CIBERSORT等算法对TCGA数据库中的样本进行免疫细胞浸润分析,并提供了可视化线上工具[11]。
1.5 统计分析
TCGA数据库中DHCR7表达值采用两独立样本校正t检验。GEO数据库使用GEO2R在线分析功能,差异有统计学意义的标准为adj.P<0.05且|log2FC|>2,adj.P为调整后的P值,FC为差异倍数。生存分析在Kaplan-Meier Plotter数据库中采用log-rank检验进行。从TCGA数据库下载DHCR7与免疫相关基因表达数据,并利用GraphPad 8.0软件中分析绘制相关性统计图,P<0.05代表差异有统计学意义。TCGA数据库中DHCR7表达与临床病理学参数相关性使用SPSS 19.0统计软件进行统计分析,采取χ2检验或连续校正χ2检验。
2 结果
2.1 DHCR7在多种类型肿瘤中高表达
通过分析ULCAN(图1A)、TIMER(图1B)数据库的数据,DHCR7在胃癌、膀胱癌、乳腺癌、结肠腺癌、食管癌、头颈部癌、肺部鳞状细胞癌等大多数肿瘤类型中的表达均高于各自的癌旁组织。
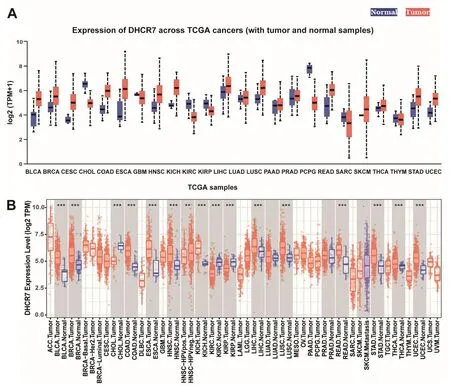
A为ULCAN数据库;B为TIMER数据库。
2.2 DHCR7基因在胃癌的表达以及与胃癌患者预后相关性分析
通过不同的数据库分析DHCR7在胃癌患者中的表达情况。首先分析GEPIA数据库408例胃癌患者和211例正常人的基因表达数据,发现DHCR7的表达高于正常组织,差异有统计学意义(P<0.05)(图2A)。TCGA数据库中384例胃癌患者和37例健康人DHCR7的表达数据也显示DHCR7在胃癌患者中高表达,差异有统计学意义(P<0.05)(图2B)。GSE79973芯片数据集的10例胃癌患者和10例健康人DHCR7基因表达数据同样提示DHCR7在胃癌患者中高表达(P<0.05)(图2C)。其次分析DHCR7在胃癌患者中高表达是否会影响患者预后,Kaplan-Meier Plotter数据库基因芯片数据(Affy ID:201790-s-at)显示DHCR7高表达组患者远期生存率下降(P<0.05)(图2D)。以上结果说明DHCR7在胃癌患者中高表达,并且高表达DHCR7与胃癌患者不良预后相关。
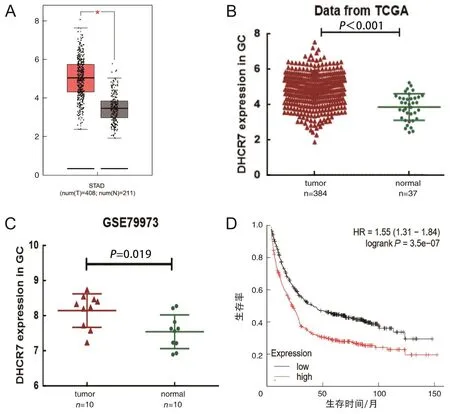
A为GEPIA数据库(*P<0.05)、B为TCGA数据库、C为GEO数据库,3种数据库分析DHCR7基因在胃癌组织与正常组织的表达情况;D为DHCR7基因的高低表达与胃癌患者预后的生存曲线。
2.3 在胃癌中与DHCR7共表达基因分析
进一步分析胃癌中与DHCR7表达相关的基因,使用cBioPortal数据库得出与DHCR7表达正负相关的基因,并通过R软件包对相关系数高的基因进行聚类图分析,在热图中可视化了前25个正相关基因(图3A)和前25个负相关基因(图3B)。
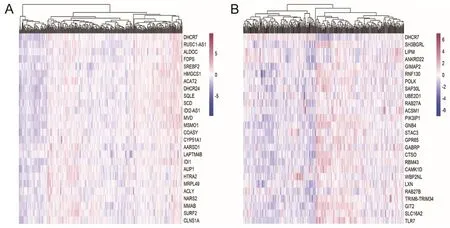
A为与DHCR7正相关基因聚类分析;B为与DHCR7负相关基因聚类分析。
2.4 DHCR7功能富集分析
为了探究DHCR7在胃癌发生发展过程中发挥的功能,对胃癌中与DHCR7共表达基因中正负相关基因进行功能富集分析,正相关基因的GO分析主要富集在类固醇生物合成过程、线粒体膜、有机磷酸代谢、线粒体组织等相关功能上(图4A);正相关基因的KEGG通路富集分析主要富集在类固醇生物合成、萜类骨架的生物合成、碳代谢、脂肪酸代谢、氨基酸的生物合成等通路(图4B),负相关基因的GO分析富集在白细胞激活、免疫应答调节、调控细胞因子、T细胞激活等免疫功能上(图5A);负相关基因的KEGG通路富集分析富集在参与调节IgA产生的肠道免疫网络、Toll样受体信号通路、病毒蛋白与细胞因子和细胞因子受体的相互作用等免疫相关信号通路(图5B)。
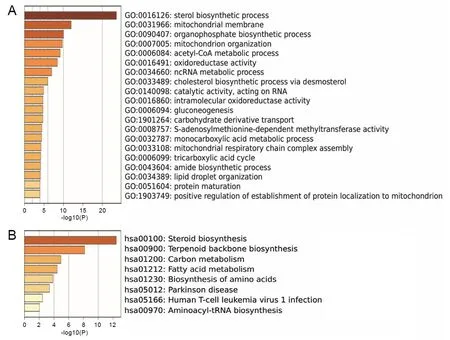
A为GO分析;B为KEGG分析。
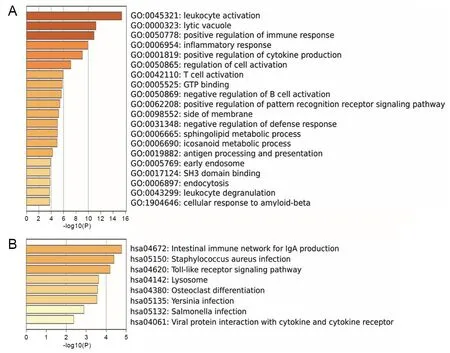
A为GO分析;B为KEGG分析。
2.5 DHCR7与CD8+T细胞以及招募CD8+T细胞相关趋化因子的相关性分析
上述功能富集分析结果提示,DHCR7基因表达可能在胃癌免疫微环境发挥免疫抑制作用,进一步分析DHCR7与免疫系统中重要的抗肿瘤免疫细胞CD8+T细胞之间的相关性, XCELL(图6A,r=-0.346,P<0.05)、CIBERSORT(图6B,r=-0.195,P<0.05)、 MCPCOUNTER(图6C,r=-0.113,P<0.05)、TIMER(图6D,r=-0.241,P<0.05)4种分析方法均显示DHCR7基因与CD8+T细胞具有较高的负相关性,并且DHCR7基因与招募CD8+T细胞相关的趋化因子CCL5(图6E,r=-0.42,P<0.05)、CXCL9(图6F,r=-0.20,P<0.05)、CXCL10(图6G,r=-0.13,P<0.05)、CXCL13(图6H,r=-0.41,P<0.05)也具有很高的负相关性,提示DHCR7可能是通过调控CCL5、CXCL9、CXCL10、CXCL13的表达进而影响CD8+T细胞的浸润。
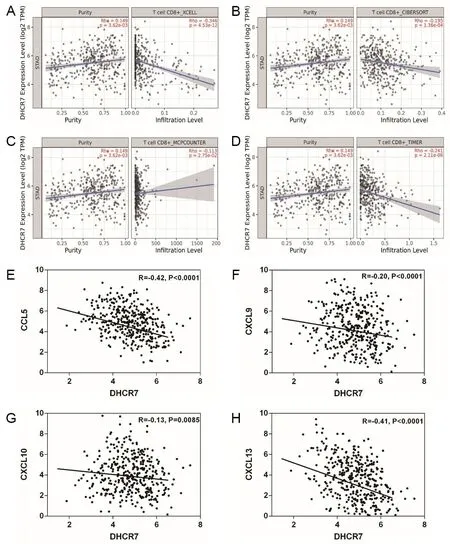
A为XCELL;B为CIBERSORT;C为MCPCOUNTER;D为TIMER。4种算法进行免疫浸润评估,分析DHCR7基因与CD8+T细胞浸润关系;DHCR7与招募CD8+T细胞相关趋化因子(E为CCL5;F为CXCL9;G为CXCL10;H为CXCL13)的相关性分析。
2.6 DHCR7与免疫激活相关基因的相关性分析
为了进一步探讨DHCR7是否参与免疫相关调节机制,本研究分析了DHCR7与免疫激活相关基因(IFN-γ、GZMB、GZMH、GZMK、PRF1、IL2)的相关性(图7A~F),结果发现DHCR7与这些免疫分子均呈负相关性,其中IFN-γ(r=-0.20,P<0.05);GZMB(r=-0.16,P<0.05);GZMH(r=-0.28,P<0.05);GZMK(r=-0.49,P<0.05);PRF1(r=-0.21,P<0.05);IL2(r=-0.27,P<0.05)。
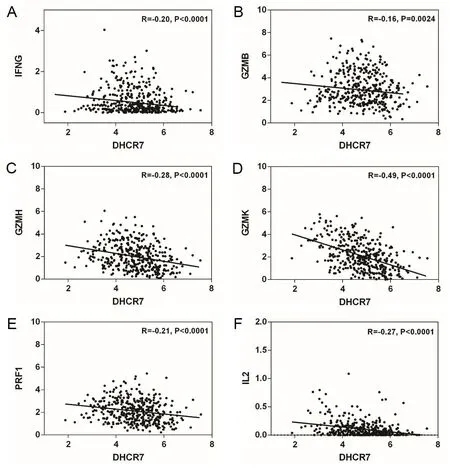
分析TCGA数据库胃癌中DHCR7与免疫激活相关基因(A为IFN-γ;B为GZMB;C为GZMH;D为GZMK;E为PRF1;F为IL2)的相关性。
2.7 胃癌组织中DHCR7的表达与患者临床病理学特征的关系
最后,本研究对TCGA数据库中DHCR7表达与胃癌患者临床特征进行了分析(表1),结果发现DHCR7表达与胃癌患者年龄呈正相关(P<0.001),而与患者性别(P=0.068)、肿瘤浸润深度(P=0.333)、淋巴结转移(P=0.912)、远端转移(P=0.655)以及分期(P=0.462)无相关性。
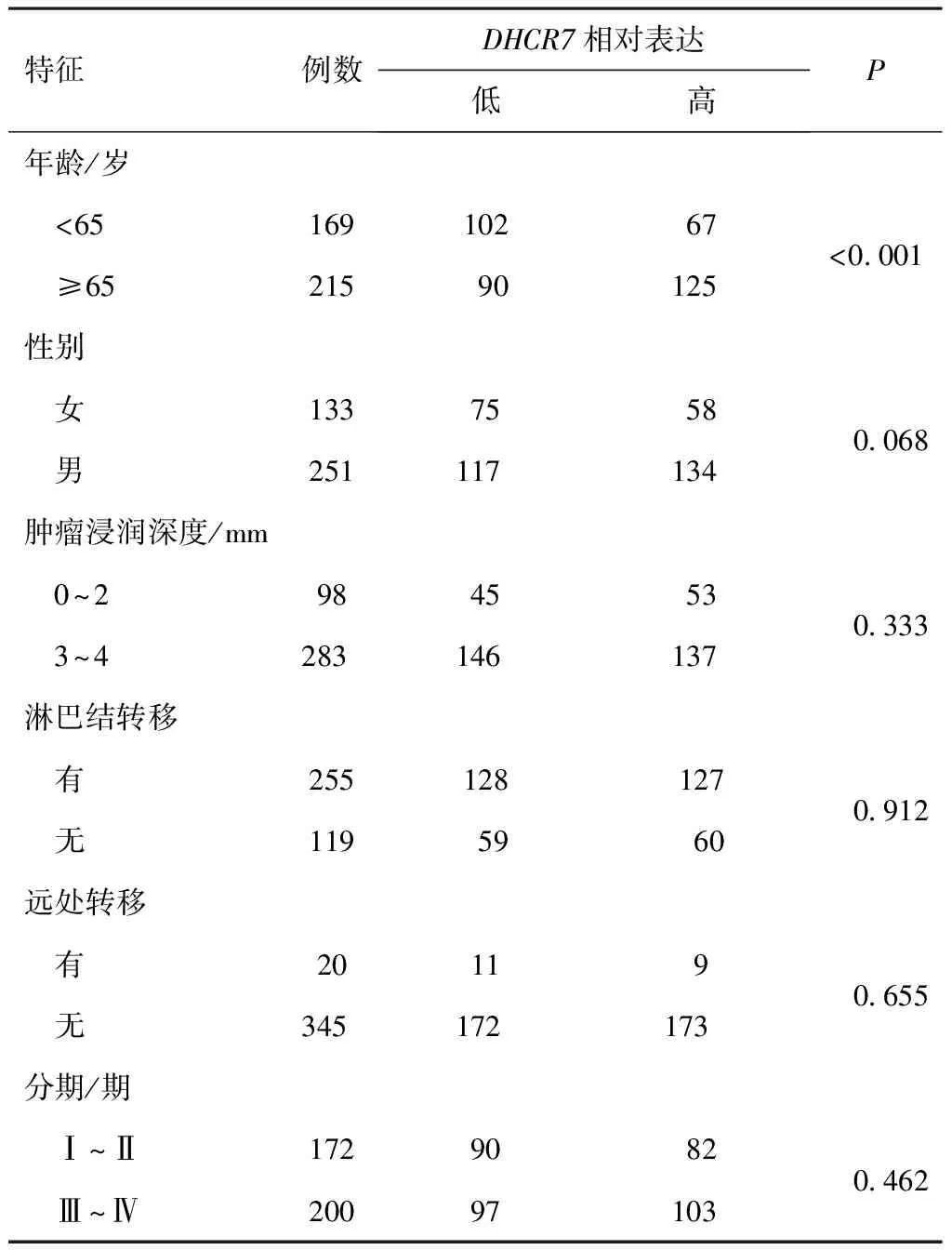
表1 TCGA数据分析DHCR7表达与胃癌患者临床 病理学特征的关联(n)
3 讨论
肿瘤的代谢重编程是维持肿瘤恶性生物学行为的重要方式,肿瘤的代谢异常能够使肿瘤在缺氧和营养缺乏的环境中获得生存,并且代谢产物更能够抑制免疫反应,有助于肿瘤逃避宿主的免疫杀伤[12]。例如,磷酸甘油酸脱氢酶(phosphoglycerate dehydrogenase,PHGDH)是丝氨酸代谢的关键基因,该基因能够调控巨噬细胞的极化,抑制PHGDH基因表达,可以增强干扰素-β(interferon-β,IFN-β)介导的抗病毒先天免疫[13]。在肿瘤微环境中吲哚胺2,3-双加氧酶可以催化色氨酸分解代谢为犬尿氨酸,进而激活CD4+T细胞中的芳烃受体,使其分化为免疫抑制调节T细胞(Treg细胞)[14]。一些免疫抑制细胞如Treg细胞、M2型巨噬细胞表达的精氨酸酶1通过降解精氨酸抑制免疫反应,在肿瘤微环境中通过补充精氨酸或抑制其降解,同时联合细胞程序性死亡-配体1免疫检查点抑制剂治疗,可以显著提高免疫疗效[14]。因此,研究肿瘤微环境中能够产生免疫抑制性的关键代谢基因以及如何调控肿瘤微环境是提高肿瘤免疫治疗的有效策略。
DHCR7作为胆固醇合成的关键代谢基因,可以将7-脱氢胆固醇转化为胆固醇,参与调控胆固醇与维生素D3的动态平衡[15]。研究结果显示,DHCR7在宫颈癌中高表达,高表达DHCR7可能是宫颈癌预后不良的生物标志物[7]。在膀胱癌中,DHCR7可以通过调控PI3K/AKT/mTOR信号通路促进肿瘤发生[8]。另有研究结果显示,抑制胆固醇代谢通路中的DHCR7能引起7-脱氢胆固醇积累,进而激活丝氨酸/苏氨酸激酶3和干扰素调节因子3,导致病毒感染后IFN-β的提高和抗病毒反应,为胆固醇代谢重编程调控天然免疫提供了新的研究思路[16]。本研究通过分析多种数据库中胃癌的测序数据集,探究DHCR7基因在胃癌中的表达及其在胃癌免疫微环境中的作用,GEPIA数据库、TCGA数据库以及GEO数据库3个数据库的结果均发现DHCR7在胃癌患者中高表达,接下来分析DHCR7在胃癌的高表达是否可作为胃癌预后的潜在生物学分子标志物,结果发现DHCR7高表达胃癌患者远期生存率低,提示其可作为胃癌患者手术后转移、复发等不良预后的生物学标志物,为评估胃癌患者的生存期提供基础。以上结果说明DHCR7在胃癌的发生发展中可能发挥了重要作用,进一步探究DHCR7是通过何种机制影响胃癌进展,从cBioPortal数据库中获得了与DHCR7的共表达基因,并在热图中可视化了前50个正相关基因和前50个负相关基因。使用Metascape数据库分析了正负相关基因的GO和KEGG通路。负相关基因的GO分析富集在白细胞激活、免疫应答调节、调控细胞因子、T细胞激活等免疫功能上;负相关基因的KEGG通路富集分析富集在参与调节IgA产生的肠道免疫网络、Toll样受体信号通路、病毒蛋白与细胞因子和细胞因子受体的相互作用等免疫相关信号通路。其中Toll样受体被视为连接固有免疫和先天免疫的桥梁,通过识别相应的模式识别受体,可以上调细胞因子、趋化因子等激活先天性免疫[17]。这些结果提示胃癌中DHCR7基因表达可能对免疫系统产生一定抑制作用,进而影响免疫系统发挥抗肿瘤作用。由于CD8+T细胞是重要的抗肿瘤免疫细胞,若患者缺乏CD8+T细胞的浸润,则无法响应免疫检查点抑制剂的治疗。因此,进一步分析了DHCR7与CD8+T细胞之间的相关性,多种免疫评估方法得到的结果均显示DHCR7基因与CD8+T细胞浸润呈负相关性,并且与招募CD8+T细胞相关的趋化因子CCL5、CXCL9、CXCL10、CXCL13也与DHCR7具有负相关性。鉴于CD8+T细胞免疫应答的激活与某些上调的信号有关[18],接下来分析了DHCR7与免疫激活相关基因(IFN-γ、GZMB、GZMH、GZMK、PRF1、IL2)的相关性,同样发现DHCR7与这些免疫分子均呈负相关性。最后回归临床,分析胃癌组织中DHCR7的表达与患者临床病理学特征的关系,从而为胃癌的临床治疗提供依据。
综上所述,DHCR7在胃癌组织中高表达,肿瘤中高表达的DHCR7在胃癌患者中表现出较差的生存率。DHCR7在抑制CD8+T细胞介导的免疫中发挥重要作用,其机制可能是通过调控CCL5、CXCL9、CXCL10、CXCL13趋化因子的表达进而抑制CD8+T细胞的浸润。同时,DHCR7能够抑制多种胃癌免疫激活相关基因的表达,提示DHCR7可能通过在肿瘤微环境中诱导免疫抑制机制促进胃癌的发生发展。但此研究仅限于生物学信息分析,后续仍需通过大量的实验进一步验证,从而明确DHCR7在胃癌中的调控机制。
4 结论
本研究通过多种数据库的数据挖掘,探讨了DHCR7在胃癌中的表达及其在胃癌免疫微环境中的作用,结果表明DHCR7在肿瘤微环境中发挥了免疫抑制作用,并参与了胃癌的进展,后续通过基因沉默或抑制DHCR7的药物来阻断DHCR7表达,可能会提高胃癌免疫治疗的效果。靶向DHCR7在胃癌免疫治疗中具有良好的治疗前景。

