益生菌对发酵乳品质影响的研究进展
戴一佳,赵 亮,2,*
(1.中国农业大学食品科学与营养工程学院,北京 10083;2.中国农业大学益生菌研究中心,中国农业大学营养与健康系,北京 100190)
发酵乳指的是以生牛(羊)乳或乳粉为原料,经杀菌、发酵后制成的 pH 降低的产品[1],一般由德氏乳杆菌保加利亚亚种(Lactobacillusdelbrueckiisubsp.Bulgaricus)、嗜热链球菌(Streptococcusthermophilus)发酵而成。发酵乳的本质是一种乳蛋白凝胶,凝胶物质的组成和结构是影响发酵乳品质的关键因素。由于发酵工艺及贮藏条件的不同,发酵乳产品的凝胶特性、风味、贮藏稳定性也有所不同。我国的发酵乳产品一般分为发酵乳和风味发酵乳[1]。风味发酵乳在发酵乳的基础上添加了营养强化剂、果蔬制品等,益生菌发酵乳属于此类范畴,占发酵乳市场的比例超过1/3[2]。
益生菌是指摄入足够数量对宿主产生有益作用的活的微生物。目前广泛应用的益生菌主要包括乳杆菌属(Lactobacilllus)、双歧杆菌属(Bifidobacterium)。益生菌通过调控宿主的肠道微生物平衡,直接或间接地影响宿主健康[3],具有改善便秘腹泻、缓解肠道炎症、调节机体免疫、降低氧化应激水平、调节血脂和血糖水平[4],缓解乳糖不耐等益生功能。
发酵乳是益生菌应用的优良载体,是我国益生菌应用的主要形式,占益生菌市场规模的78.4%[5]。益生菌的添加提升了发酵乳产品的健康属性,具有广阔的市场前景。添加益生菌可能影响发酵乳的质构、风味等品质,如任然[6]在发酵乳中添加了干酪乳酪杆菌CICC-20280(Lacticaseibacilluscasei),不仅能提高发酵乳的粘度,还使发酵乳中酸类、酮类等重要风味物质的含量升高,提升了发酵乳的品质。白梅等[7]的研究表明在发酵乳中添加益生菌干酪乳酪杆菌 Zhang 和/或乳双歧杆菌 V9 能够改善其质构特性和贮藏稳定性;另一方面,发酵乳的组分、贮存条件会通过影响益生菌产品中的活性影响而菌株益生功能,如贮存期间的高酸度环境会对菌株生存造成胁迫,使活菌数难以达到标准。
目前国内外关于益生菌发酵乳的研究主要集中在评价从传统发酵食品分离出来的新型益生菌的有益作用[8-9],通过将这些益生菌应用于发酵乳,研究其对发酵乳制品的感官品质和功能特性的影响。然而不同益生菌对发酵乳品质影响具有菌株特异性,机制仍不清楚;生产过程中如何选择合适的菌种及接种量、加工工艺、贮藏条件以维持益生菌的存活剂量还存在较大困难[10-11]。本文综述了益生菌影响发酵乳质构、风味的机理,总结了益生菌对发酵乳质构、风味品质的规律;通过分析发酵乳中菌种的互作、pH、温度等环境因素,总结了提高菌株稳定性和应用水平的技术手段,旨在为益生菌发酵乳的开发和应用提供理论依据。
1 益生菌对发酵乳品质的影响
1.1 益生菌对发酵乳质构的影响
发酵乳的质构基础是酪蛋白复合凝胶,凝胶结构是发酵过程中由于乳酸菌产酸使pH 降低至酪蛋白等电点,导致酪蛋白聚集所形成的三维网状含水结构。凝胶结构的强度主要与凝胶形成动力学、酪蛋白网络结构的排列、多糖及脂肪、蛋白[12]的组成与分子量等有关。此外,pH 和温度等环境因素也会通过影响酪蛋白胶束的相互作用及与变性乳清蛋白的交联、颗粒表面的Zeta 电位影响凝胶结构的稳定性[13]。
由于低凝胶强度容易导致发酵乳脱水及乳清析出[14],黏度和硬度下降,从而对产品的组织状态和口感造成不利影响[15]。为增强凝胶强度,工业生产往往通过优化均质、热处理等加工工艺或添加果胶、淀粉等稳定剂增强发酵乳蛋白网络结构强度[16]。与稳定剂相比,在发酵乳中添加特定益生菌也能起到维持乳蛋白凝胶稳定性的效果。
益生菌主要通过代谢和分泌EPS[17]影响发酵乳的凝胶结构,研究表明,在发酵乳中添加发酵乳杆菌(Limosilactobacillusfermentum)和植物乳植杆菌(Lactiplantibacillusplantarum),可水解商业发酵菌未水解的蛋白质,产生更多小分子肽以加强乳蛋白网络结构的交联[18]。此外,部分益生菌如鼠李糖乳酪杆菌(Lacticaseibacillusrhamnosus)、干酪乳酪杆菌(Lacticaseibacilluscasei)、植物乳植杆菌、双歧杆菌(Bifidobacterium)、乳酸乳球菌乳脂肪亚种[19](Lactococcuslactissubsp.cremoris)产生的游离型[20]胞外多糖(EPS)也可起到增稠的效果,制备的发酵乳析水率低于果胶和琼脂强化型发酵乳[21],可作为一种天然增稠剂应用于发酵乳生产[22]。
益生菌产EPS 对酸奶质构稳定性具有明显贡献,也是研究和实际应用的热点。EPS 通过与蛋白质相互作用形成连续的分支蛋白网络,从而提高发酵乳的凝胶硬度和粘度以及保水性。Costa 等[23]在脱脂乳中分别接种产EPS 的乳脂乳球菌Lactococcus cremorisDPC6532 和不产生EPS 的同基因变种,结果表明由产EPS 菌株所发酵的发酵乳黏度较高,持水性较好。主要是因为溶解在乳清相中的EPS 对蛋白质起到排斥作用,从而形成较大的酪蛋白聚集物,使凝胶强度显著增加。Ruas-Madiedo 等[24]对比了五株乳酸乳球菌所产EPS 的结构,结果表明摩尔质量大,主链含较多α-1,4 糖苷键、侧基空间位阻大的EPS 粘度较大(>1.5 m3·kg-1),可提高发酵乳的凝胶强度。Gentes 等[25]也发现EPS 的分子量和分支度与发酵乳粘度、硬度呈正相关,且EPS 结构中的负电荷可通过在相邻蛋白聚集体之间形成桥联来提高酪蛋白网络的弹性,从而增强凝胶的结构。而中性的多糖如淀粉、瓜尔胶等不直接参与蛋白质网络的形成,以填料形式吸收蛋白网络孔隙中的水分,增加乳清相的黏度[26]。由此表明,EPS 对发酵乳凝胶强度的调节作用主要取决于EPS 的结构(分子质量、分支度、电荷量)以及它们与其他物质的相互作用,其中分子量大、分支度高带负电荷的EPS 可增强凝胶强度,提高发酵乳的粘度、硬度以及持水力[27]。合成EPS 的基因位于乳酸菌染色体或质粒上,在质粒上编码的基因EPS 产量较不稳定,菌株在没有环境压力的情况下容易丧失EPS 的生产能力[28],且不同菌株产EPS的能力有较大差异(浓度在0.1~100 mg/L 范围内)[12,29],因此EPS 的结构、生产能力及产量稳定性具有显著的特异性[30],对发酵乳质构稳定性的影响差异巨大,目前对于EPS 影响发酵乳质构的量效、构效关系仍不完全明确。为了筛选EPS 产量稳定且结构符合要求的菌株应用于发酵乳生产,可将表型和已公布的基因型数据相关联,但目前的研究在基因组水平上的具体机制(如单糖单元的排列方式和EPS产量的调控机制)仍未完全阐明。
1.2 益生菌对发酵乳风味品质的影响
发酵乳的风味品质与发酵剂种类、加工工艺、原料乳特性以及添加剂、贮藏条件等多种因素有关。发酵乳中大部分风味物质由乳酸菌代谢产生,因此发酵剂的选择是关键影响因素。发酵乳风味物质主要包括酮类、醛类、酸类、酯类。乳酸菌通过糖酵解、蛋白质和脂肪分解作用产生乳酸和多种挥发性有机芳香化合物,从而赋予发酵乳特殊的风味。其中糖酵解的重要中间产物丙酮酸可以部分转化为双乙酰和乙偶姻,赋予发酵乳独特的奶油味和黄油味;丙酮酸的其他代谢产物如乙醛、乙酸也是发酵乳中的关键风味成分。除此之外,脂类水解产生的游离脂肪酸和乳酸菌通过氨基酸代谢转化生成的多种化合物也会对发酵乳的风味产生影响[8]。表1 列出了发酵乳中主要的风味物质。然而,并非所有挥发性成分都具有重要的感官意义,只有其浓度超过阈值时才能被感知。通常认为赋予发酵乳理想风味的主要化合物是乳酸、乙醛、双乙酰、2-丁酮等,当这些化合物的含量在适当水平时,发酵乳的风味较好。例如发酵乳中乙醛的最佳浓度在14~20 mg/kg 之间,低于8.0 mg/kg时味道较淡;而过量的乙醛会导致发酵乳口感较涩,产生异味[31]。
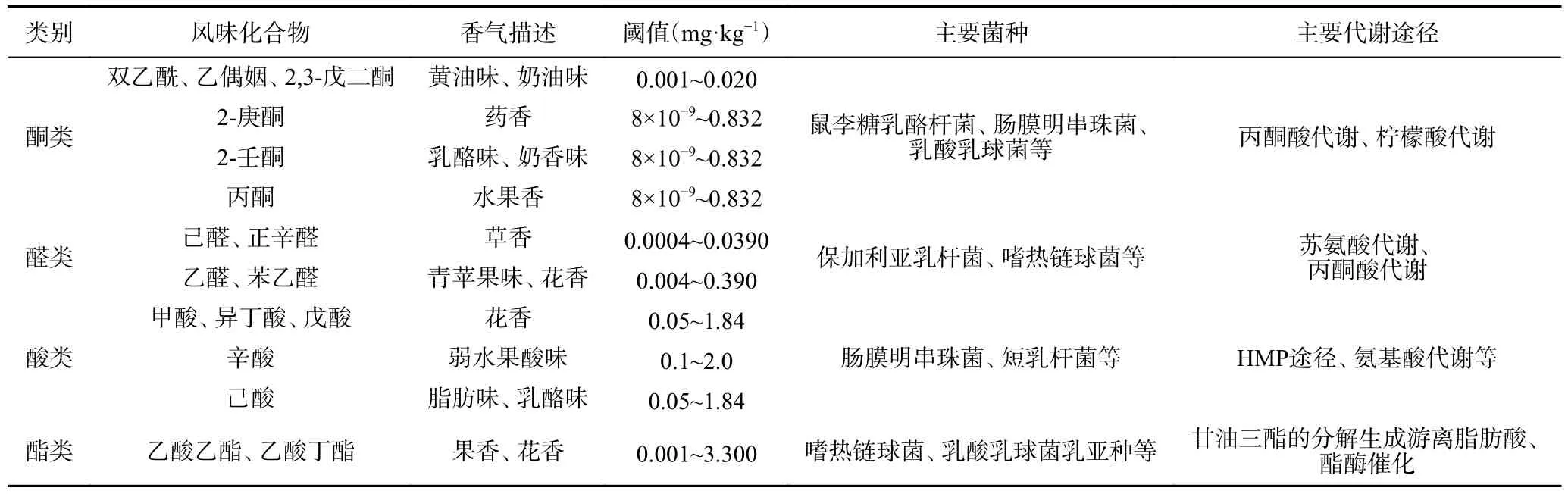
表1 发酵乳中主要风味化合物、香气描述[35-37]Table 1 Description of the main flavor compounds and aroma in fermented milk[35-37]
为了使发酵乳中风味物质的浓度适当浓度,工业生产过程可以利用发酵剂与益生菌共同培养改善发酵乳的风味品质[31]。其木格苏都等[32]的研究表明嗜热链球菌与干酪乳酪杆菌Zhang 复配发酵有利于提高发酵乳中2,3-丁二酮和己酸的含量,促进风味物质的形成。Xu 等[33]将四种常见的益生菌与传统发酵剂共同发酵,发现费氏丙酸杆菌谢氏亚种(Propionibacteriumfreudenreichiisubsp.Shermanii)的添加能够提高发酵乳中2,3-丁二酮的含量,从而显著改良发酵乳风味。除了提高某种风味化合物的含量,益生菌还可起到改善不良风味的作用,延长产品附加值。Liu 等[34]在发酵核桃乳中添加植物乳植杆菌LP56,研究表明发酵后的甜味氨基酸、鲜味氨基酸含量提高且导致产品较浓青草味的醛类物质含量降低,提升了核桃发酵乳的品质。
1.3 益生菌对发酵乳后酸化的影响
发酵乳在在贮藏、运输和销售过程中耐酸性的乳酸菌由于β-半乳糖苷酶在低温(0~5 ℃)依旧保持较高的活性[38],将继续利用剩余乳糖代谢产酸使发酵乳 pH 下降至4.0 以下,导致蛋白质之间的疏水和静电相互作用增加,胶体磷酸钙(CCP)溶解、蛋白质网络重构[39],从而使发酵乳脱水和乳清析出、风味劣化的现象称为发酵乳的后酸化。
发酵乳贮藏期间后酸化程度的增加主要来源于发酵剂中的德氏乳杆菌保加利亚亚种[40]。益生菌主要通过影响发酵剂菌种的生长影响后酸化进程,影响程度与其低温贮藏期间的生长能力有关,存在菌株特异性[30]。嗜酸乳杆菌、双歧杆菌等益生菌的生长会受到发酵过程中产生的过氧化氢、酸的抑制[41]。兼性厌氧菌如植物乳植杆菌等,氧气对菌体细胞本身没有损伤作用,但是在其代谢过程中所产生的活性氧(Reactive Oxygen Species,ROS)、(过氧化氢(H2O2)、超氧阴离子自由基(O2-·)以及过氧化自由基能引起脂类、蛋白质及DNA 等的损伤,进而破坏菌体细胞[42];而蛋白水解能力强的益生菌如嗜酸乳杆菌等可通过水解乳蛋白分泌更多氨基酸、肽等营养因子,促使发酵剂菌种更好地生长,促进产酸,加速后酸化[40]。也有研究表明产EPS 的益生菌株可通过竞争利用乳糖优先产生EPS 而非乳酸,从而减缓发酵乳后酸化程度,维持发酵乳的凝胶结构[39]。因此益生菌主要通过影响发酵剂菌种的生长影响后酸化进程,影响程度与其低温贮藏期间的生长能力有关,存在菌株特异性[30]。
2 发酵乳中益生菌的稳定性
根据FAO/WHO 建议,发酵乳产品每日益生菌活菌摄入量应不低于106CFU/g[43],欧美及日本等国则规定应达到107CFU/g 以上。摄入益生菌达到一定数量才能发挥其益生功能,因此益生菌在发酵乳中的稳定性是产品关注的重点。影响发酵乳中益生菌稳定性的因素主要有菌株间的互作和环境条件。发酵乳发酵过程中,不同菌株间存在共生或拮抗作用,表现出拮抗作用的菌株主要通过产生细菌素[44]影响其他菌株的生存能力,起到抑制有害微生物的作用。研究表明,竞争微生物通过群体感应(QS)途径调控的某些特定成分(如植物乳植杆菌素)的调控系统的激活,可引发微生物拮抗作用。与植物乳植杆菌L.plantarumDC400 共培养时,旧金山乳杆菌L.sanfranciscensisDPPMA174和戊糖片球菌P.pentosaceus2XA3 的生长受到抑制,与各自的单一培养相比,死亡或受损细胞数量增加[45]。此外,温度、pH 也是影响活菌数稳定性的关键因素。由于益生菌的适宜温度普遍在30~40 ℃之间,且大多数益生菌是嗜中性的,生长最适pH 在5~9 之间[43],因此发酵乳贮藏期间的温度变化、酸度上升易导致菌体存活率下降,影响菌株益生功能的发挥[46]。研究表明,将发酵乳分别置于4、-10、-20 ℃的温度下贮藏,活菌数存在较大差异。4 ℃贮藏条件下,益生菌缓慢生长,数量逐渐增加;而-10 与-20 ℃条件会导致酸乳发生冻结,从而使菌体内部水分逐渐结晶,刺破细胞,造成死亡[47]。除了低温胁迫,较高的贮藏温度会使乳酸菌大量繁殖产酸,导致益生菌活菌数下降。当发酵乳酸度较高时,益生菌的生长同样受到抑制,容易出现菌体老化、活菌数下降等现象。吕嘉枥等[48]以干酪乳酪杆菌、植物乳植杆菌、鼠李糖乳酪杆菌等13 株常见的乳酸菌为研究对象,研究酸胁迫对其活性的影响。结果表明,随着酸胁迫程度的增强,乳酸菌的活性受到不同程度的抑制,其中当pH 为1~3 时,13 株乳酸菌的抑制率在90%以上。此外对氧气高度敏感的益生菌如双歧杆菌,活性氧ROS 可导致其蛋白质错误折叠和聚集、DNA 损伤和脂质过氧化[49],使活菌数无法达到标准。因此工业生产往往采取一定技术手段提高发酵乳中益生菌的稳定性,从而维持发酵乳的健康特性。
2.1 提高发酵乳中益生菌株稳定性的技术
2.1.1 提高菌株自身耐受能力 工业生产中,益生菌往往面临不利于生存的环境胁迫[50]。如发酵过程中容易遭到氧化胁迫,冷链运输和贮藏期间易遭受低温胁迫和酸胁迫。氧化胁迫过程中生成的超氧阴离子自由基(O2-·)、过氧化氢(H2O2)和羟自由基(·OH)等活性氧簇攻击蛋白质、DNA 和脂类等大分子,造成细胞衰老和死亡,导致菌体存活率下降和活性衰减。此外,发酵过程中的酸性环境以及进入人体消化道后胃酸会导致菌体胞内的pH 下降,代谢途径中部分酸敏感的酶失活,从而严重影响能量供给。因此,通过诱变育种、食品级基因改造等技术手段筛选对氧化胁迫、酸胁迫等不良环境具有较强抵抗能力的菌株是提高益生菌稳定性的关键[51]。
2.1.1.1 诱变育种 野生型菌株具有代谢产量低、耐受性低、稳定性低等缺点,难以满足工业化需求。诱变育种通过改良微生物的遗传性状提高益生菌的耐受能力,是现代食品工业及发酵工业中的重要育种途径[52]。常用的诱变育种方法一般可以分为物理、化学及复合诱变。在益生菌菌种选育中,由于化学诱变试剂普遍毒性较大,物理诱变是常用的诱变方式[53]。物理诱变主要包括紫外线诱变、α、γ射线诱变。但紫外诱变存在诱变效应具有菌种特异性、可见光修复导致突变的不稳定性等局限[54]。针对这一现状,目前较多研究采用常压室温等离子体(Atmospheric Room Temperature Plasma,ARTP)、重离子束辐射(Heavy Ion Beam Irradiation,HIB)等新型物理诱变技术。化学诱变剂种类繁多且适用性较广,与物理诱变相比相对经济。为了提高菌株突变率,通常采用两种或以上诱变剂同时或先后作用,也可将物理诱变和化学诱变复合处理进行复合诱变。诱变育种在益生菌选育中的应用如表2 所示。

表2 诱变育种技术在益生菌中的应用Table 2 Application of mutagenesis breeding technology in probiotics
2.1.1.2 食品级基因改造 利用基因工程技术改造传统的发酵菌株[60],增强其对不良环境的抵抗能力是目前食品生物技术领域的研究热点之一,但我国法规要求,基因工程改造菌株不能用于食品。食品级基因修饰菌(genetically modified microorganisms)是指被导入公认安全的食品级微生物的基因,并因此具有某种优良性状的用于发酵等食品工业生产的微生物。目前在基因工程领域已建立一系列基于乳酸菌的遗传转合系统,其诱导剂、筛选标准均为食品级,符合美国食品和药物管理局的安全标准[61]。通过研究胁迫抵抗机制,找到提高益生菌胁迫抗性的途径进行食品级基因改造,能够显著增强对环境胁迫的抵抗能力。
翟征远[62]采用蛋白组学技术和转录水平分析相结合的方法对保加利亚乳杆菌CAUH1 的酸耐受反应中的差异基因进行分离鉴定,并进一步采用超量表达实验对其进行功能验证,结果表明Ldb0677 在抗酸胁迫反应中起到重要的调控作用。杨扬[51]通过揭示植物乳植杆菌CAUH2 的氧化胁迫应激机制,选择转录水平上调最为显著的麦芽糊精ABC 转运系统的通透酶基因mdxF进行基因突变,成功筛选到参与氧化胁迫应激调控的关键转录因子,从而提高菌株抗氧化胁迫的能力。氨基酸代谢调节在胞内pH 调节中发挥着重要作用,卢承蓉[52]将精氨酸琥珀酸合成酶(ASS)和精氨酰琥珀酸裂解酶(ASL)在乳酸乳球菌LactococcuslactisNZ9000 重组表达,从而引起氨基酸代谢流量的增加,结果表明重组菌株在酸胁迫条件下的生长性能及耐受性均高于对照菌。通过对益生菌进行食品级基因改造提高其抗氧化胁迫和酸协迫的能力有利于维持活菌数的稳定性。
2.1.2 外源活性物质 除了提高菌株自身耐受能力,在发酵乳中添加多糖、细菌素等外源活性物质促进益生菌生长也能增强益生菌的稳定性。益生元是通过向益生菌提供营养,使肠道内的有益菌将其分解、消化、吸收,从而起到促进益生菌的生长繁殖的非消化成分,具有提高益生菌活性的作用[63]。低聚果糖、低聚半乳糖、菊粉是常见的益生元制剂。刘秀清等[64]研究了低聚木糖、低聚果糖和低聚异麦芽糖3 种益生元对发酵乳中鼠李糖乳酪杆菌活性的影响,结果表明3 种益生元均可促进鼠李糖乳酪杆菌生长,提高益生菌的活性,其中低聚麦芽糖的效果最好。张娜等[65]在发酵乳中添加了低聚木糖和低聚异麦芽糖的混合糖,结果表明能够维持植物乳植杆菌ZDY2013 在发酵乳中的浓度,提高益生菌的稳定性。刘洋等[66]也得到了类似的结论:低聚糖对益生菌活菌数具有较为显著的增殖效果,但不同的低聚糖对发酵乳的酸度的降低具有不同效果。因此在实际应用过程添加低聚糖需进一步筛选,避免产生后酸化等影响发酵乳品质。此外,菊粉[67]、甜菊糖苷[68]、谷氨酰胺转胺酶[69]也可作为功能性添加剂应用于发酵乳生产。Bifidocin A 是由动物双歧杆菌 BB04 代谢合成的一种新型细菌素,邱爽等[70]将细菌素bifidocin A 添加到发酵乳中,发现在维持正常酸度的前提下,持水力、挥发性风物质含量显著提高。生产应用时可通过复配上述稳定剂来强化其功效,但复配比例以及最佳添加量需要进一步确定。
2.1.3 微胶囊技术 益生菌微胶囊技术是指用半透性和生物相容性基质作为载体包埋益生菌,达到目标部位后进行缓慢释放的一种起到保护和递送作用的新技术[71]。微胶囊的制备技术主要包括物理方法、化学方法和物理化学方法3 大类。目前在食品行业中已被推广应用的技术有有挤压法、乳化法、喷雾干燥法、冷冻干燥法等[72]。微胶囊由壁材外壳和芯材两部分组成。通常将益生菌作为芯材进行包埋,而微胶囊壁材外壳作为一种物理屏障可以提高益生菌对不良环境的抗性力,保护益生菌在加工和贮藏过程和在上消化道(口腔、胃、小肠等)不被释放,从而有效解决发酵乳贮藏期间益生菌活菌数下降、胃酸不耐的问题。因此,提高微胶囊的包埋效果可以显著提高益生菌的稳定性。
为了提高益生菌包埋效果,需选择合适的壁材。不同壁材在流动性、溶解性、缓释性和渗透性等方面效果不同。海藻酸钠、壳聚糖和果胶等天然高分子材料常作为益生菌微胶囊壁材。Prasanna 等[73]用海藻酸钠对动物双歧杆菌Bb-12 进行包埋应用于发酵乳中,结果表明动物双歧杆菌Bb-12 的存活率显著提高,且能够抑制发酵乳的后酸化。Wu 等[74]利用阿拉伯木聚糖和海藻酸盐的相互作用增强了微胶囊结构强度,从而提高了发酵乳中植物乳植杆菌的稳定性。
虽然大量研究已表明微胶囊技术可以提高发酵乳中益生菌的稳定性,但该技术的应用仍存在一定缺陷。目前国内益生菌微胶囊技术的研究主要集中于单一菌种,对不同菌种同时包埋的研究较少,且新型包埋壁材的应用还需进行安全性评价[72]。有研究发现,益生菌的微胶囊化会对发酵乳制品的感官质量造成一定影响。如利用喷雾干燥法制备微胶囊的过程中,由于出口温度较高发生的美拉德反应会影响胶囊的颜色,且对发酵乳的质地风味也会造成一定影响。此外,益生菌微胶囊化工艺较为复杂,可能增加生产成本。因此,在应用微胶囊技术时仍需进一步优化生产工艺,在提高益生菌稳定性的同时保证发酵乳的感官品质。
2.1.4 其他技术 除上述技术外,超声波技术作为一种广泛使用的食品加工技术也可用于提高发酵乳中益生菌的活性。Gholamhosseipour 等[75]研究了超声波处理对发酵乳中植物乳植杆菌AF1 的影响,结果表明经处理后发酵过程中植物乳杆菌AF1 活菌数提高,可能是因为低频超声可以通过在细胞膜上形成瞬态气孔,从而提高细胞膜的渗透性,促进了细胞内酶等代谢物的分泌,刺激细胞生长和繁殖。但长时间超声处理也会导致益生菌存活率降低。Niamah[76]的研究表明超声波处理对益生菌对效果取决于菌株的类型,在相同的功率下处理10 min,动物双歧杆菌的存活率相较于其他菌株减少。低频超声处理发酵乳可通过提高酶活促进益生菌生长,但应用时需要针对菌株优化超声处理的条件。此外,低频超声波(100 kHz)处理可使菌体细胞释放β-半乳糖苷酶,加速反式半乳糖基化,促进乳糖水解发酵[77],从而提高益生菌的酶活增加糖和蛋白质的分解。一些蛋白水解能力强的益生菌可通过产生氨基酸、肽等营养物质促进商业发酵菌株生长,从而为开发新型功能性发酵乳制品提供机遇[78]。
3 结论与展望
发酵乳作为益生菌重要的食品载体,是益生菌的主要应用形式。益生菌可以通过水解蛋白质产生小分子肽和分泌胞外多糖增强乳蛋白网络的交联,提高发酵乳质构稳定性;也可通过代谢增强发酵乳风味,此外益生菌的添加也会影响发酵乳的后酸化程度。在益生菌应用过程中应对产品品质进行评价,重点关注优良益生菌的筛选和适配。发酵乳中菌种互作、贮藏环境会影响益生菌的活性,可通过诱变育种、食品基因改造、外源活性物质的添加、微胶囊及超高压等新兴技术增强菌株的耐受能力,增强益生菌活菌数的稳定性并提高益生菌的应用水平。未来可以持续开展益生菌对发酵乳品质影响机制,开发高稳定性、具备生产性能和益生功能多功能菌株,实现益生菌在发酵乳中的广泛应用。
© The Author(s) 2024.This is an Open Access article distributed under the terms of the Creative Commons Attribution License (https://creativecommons.org/licenses/by-nc-nd/4.0/).

