黄芩苷通过ROS 依赖性调节RhoA/ROCK 通路保护氯化钴诱导心肌细胞损伤的实验研究
沈艳玲,刘承红,王世魁,徐 尧,张云波,顾申红
(1.海南医学院,海南省创伤与灾难救援研究重点实验室,海南 海口 571199;2.海南医学院第一附属医院全科医学科,海南 海口 570102)
缺血性心肌病是指冠状动脉病变心肌持续性缺血引起的心肌舒缩广泛失调,导致心功能不全的一类疾病。心肌缺血是冠心病、心肌梗死、心力衰竭等心血管疾病的初始病因。心肌梗死是病理生理学涉及心肌缺血、临床上发病率和死亡率相对较高的心血管疾病。心肌梗死后会引发氧化应激和过度生成炎症细胞因子,导致一系列促级联反应损伤心肌细胞并加速心肌细胞的凋亡过程[1]。研究发现急性心肌梗死后导致心肌细胞不良重塑和梗死面积急剧恶化的触发因素是机体白细胞和清除心肌细胞坏死碎片的平衡紊乱发生心肌细胞坏死碎片的炎症发应,一旦机体持续发生的炎症反应就会通过一些细胞因子会加速心肌细胞死亡,损害正常存活心肌细胞的收缩功能[2]。而氧化应激参与多种缺血性心脏病的发生,当体内氧自由基生产和清除失衡时会引起心肌细胞结构受损和功能障碍[3]。因此探索缺血环境下心肌细胞损伤的分子机制,寻找有效的抗心肌缺血药物预防或减少心肌细胞损伤对控制缺血性心肌病具有重要的意义。
RhoA/ROCK 是一种重要的信号传导通路,在心肌缺血中起着非常重要的作用。在心肌缺血过程中细胞内钙离子浓度增高,进而激活RhoA/ROCK 信号通路刺激肌球蛋白轻链磷酸化,导致心肌细胞收缩增强,使心肌供血进一步受限造成心肌损伤[4]。此外,激活的RhoA/ROCK 还能促进炎症介质的释放进一步加重心肌缺血损伤[5]。黄芩苷(Baicalin)是一种从双子叶唇形科植物黄芩干燥根中提取分离得到的黄酮类化合物,其化学名称为5,6-二羟基-7-O-葡萄糖醛酸黄酮甙。众多研究表明,黄芩苷具备多种药理作用,如抗炎、抗过敏、抗氧化、抗肿瘤以及调节肝功能和免疫系统等。黄芩苷还展示出对脑缺血模型的神经保护作用[6],能通过促进巨噬细胞从M1 型向M2 型的转换来减轻心肌炎症反应、缓解心肌损伤并抑制心肌细胞凋亡[7]。黄芩苷可应用于内皮功能损伤、氧化应激、炎症激活、血小板聚集、血管平滑肌细胞异常增殖与迁移等原因导致的心脏缺血性疾病[8],因此黄芩苷具有成为治疗心肌缺血损伤的潜在候选药物。但是黄芩苷在抗心肌缺血损伤作用机制仍然不充分,是否可以通过RhoA/ROCK 通路发挥对心肌缺血损伤起保护作用尚未报道。基于以上发现,本研究计划以H9c2 心肌细胞为研究对象,构建体外H9c2 细胞缺氧损伤模型以模拟心肌缺血损伤,旨在探讨黄芩苷是否通过RhoA/ROCK 通路对大鼠心肌细胞缺氧损伤产生保护作用。本研究旨在为心肌缺血相关疾病的治疗提供理论基础和实验依据,为心肌细胞保护研究提供新的研究思路。
1 实验材料和方法
1.1 实验材料
1.1.1 细胞株 大鼠心肌细胞(H9c2),购自中国科学院上海生命科学研究院细胞资源中心。
1.1.2 主要试剂和仪器 氯化钴(CoCl2)(上海生工生物工程有限公司);黄芩苷(成都麦德生科技有限公司);Y-27632(MCE);DMEM 培养基(美国Gibco);胎牛血清、胰蛋白酶细胞消化液(BI);CCK8(Cell Counting Kit-8)细胞活力检测试剂盒、二氯荧光黄双乙酸盐(Dichlorofluoresceindiacetate, DCFH-DA)荧光探针、MDA 试剂盒、ECL 化学发光底物试剂盒(特超敏)(biosharp);二甲基亚砜(Dimethyl sulfoxide,DMSO)(美国Sigma-Aldrich);青霉素-链霉素溶液、PBS 缓冲液(procell);SOD 试剂盒(碧云天公司);兔单克隆抗体RhoA (1∶1 000)(成都正能生物技术有限公司);抗ROCK1(1∶1 000)、抗ROCK2(1∶2 000)(景杰生物科技有限公司);抗TNF-α(1∶2 000)、抗IL-1β(1∶2 000)、辣根过氧化物标记的羊抗鼠或抗兔二抗(bioss);β-actin(1∶1 000)(武汉赛维尔生物科技有限公司)。酶标仪(Bio-Rad:Model3550-UV);凝 胶 成 像 系 统(Bio-Rad:Gel doc1000);台式(冷冻)高速离心机(Eppendorf:5810R,5415D);低速冷冻离心机(Eppendorf 公司);超低温冰箱(-80 ℃,Haier)、超净工作台(Biological Safety Cabinets, ClassII, NUAIR, SANYO);电泳仪(Bio-Rad);CO2孵育箱(SANYO)流式细胞仪(EPICSXL,COULTER);激光共聚焦显微镜(TCS SP5Ⅱ,Leica)等。
1.2 实验方法
1.2.1 建立体外心肌细胞缺氧损伤模型 H9c2 细胞用含10%胎牛血清含双抗的DMEM 培养基在37 ℃、5%CO2培养箱中培养。取对数在生长期内的H9c2 细胞制备细胞悬液,5 000/孔接种于96 孔板15 h 后构建H9c2 细胞缺氧损伤模型,采用不同浓度的氯化钴(CoCl2)对H9c2 细胞进行缺氧处理。为模拟缺氧条件,使用氯化钴作为化学试剂:弃去原液后加入完全培养基,并在37 ℃、5% CO2培养箱中培养。通过预实验,设立对照组及不同CoCl2浓度缺氧组(100、300、500、750、1 000、1 300、1 600、2 000 μmol/L),进行12、24、36 h 的缺氧状态培养,以确定最佳造模条件。造模后,采用CCK8 法并使用酶标仪在450 nm 波长处检测各孔吸光度(optical density,OD),以判断各组细胞增殖情况。将各组细胞的OD 值分别与对照组的OD 值均数进行比较,计算各组细胞活力值,并绘制曲线图,从而选取最佳缺氧造模条件。
1.2.2 分组 在确定最佳缺氧造模条件后,进行细胞培养和分组:(1)对照组:未使用黄芩苷和CoCl2药物处理,加入DMEM 培养基,置于37 ℃,5% CO2培养箱中培养细胞24 h。(2)CoCl2组:通过最佳Co-Cl2造模浓度成功造模后,加入相同体积的完全培养基并在相同培养箱环境中进行培养。(3)CoCl2+Baicalin 组:将黄芩苷干粉充分溶解于DMSO 中,配制成浓度为150 mmol/L 的储存液,DMSO 的终浓度≤0.1%。将配置的黄芩苷储存液稀释成浓度为10、25、50、75、100 μmol/L 的五个组别,确定最佳黄芩苷药物浓度条件后,在最佳CoCl2造模浓度下加入最佳黄芩苷药物浓度,并在相同培养基体积及培养箱环境中进行培养。(4)CoCl2+Baicalin+Y27632组:在最佳CoCl2造模浓度和最佳黄芩苷药物浓度下,加入浓度为10 μmol/L 的Y27632(选择性Rho激酶抑制剂),并在相同培养基和培养箱环境中培养。(5)CoCl2+Y27632 组:在黄芩苷+CoCl2+Y27632 组的基础上,不使用黄芩苷干预。
1.2.3 CCK8 检测各组细胞增殖情况 按照每孔约5 000 个细胞的数量,以100 μL 的体积在96 孔板中接种细胞。在孔板外围添加PBS,以减少培养孔内液体的挥发。盖上盖子,然后在37 ℃的培养箱中培养15 h。按照前述分组及药物处理方法进行细胞干预。每孔加入100 μL 含有10 μL CCK-8 溶液的细胞培养基,避光操作。采用枪头沿孔内侧壁注入的方式,以防止产生气泡。将细胞与CCK-8 溶液在37 ℃、避光条件下共同孵育0.5~2.5 h。
1.2.4 荧光探针检测活性氧(Reactive oxygen species,ROS) 在消化细胞并进行细胞计数后,将细胞均匀接种至无菌的15 mm 共聚焦小皿中,每个小皿约含有5×104个细胞。当细胞融合度达到约70%时,以1∶1 000 的比例使用无血清培养液稀释ROS 探针DCFH-DA 至10 μmol/L。在弃去细胞培养基后,加入足够的DCFH-DA 溶液以覆盖细胞,然后在37 ℃的细胞培养箱中孵育30 min。使用无血清细胞培养液清洗细胞3 次,以充分去除未进入细胞内的DCFH-DA,于倒置显微镜观察荧光强度。1.2.5 黄嘌呤氧化酶法(羟胺法)测定SOD 活力、硫代巴比妥酸显色法检测MDA 消化细胞后收集各组H9c2 心肌细胞经超声破碎处理后检测SOD 活力和MDA 含量。所有步骤均根据试剂盒说明操作。通过酶标仪设定特定波长(MDA 检测波长:532 nm;SOD 检测波长:450 nm),检测各个孔的OD 值并计算结果。
1.2.6 蛋白质印迹法分析(Westernblot) 通过Western blot 方法检测RhoA、ROCK1、ROCK2、TNF-α、IL-1β 蛋白的表达水平:各组经过不同处理后,使用含有蛋白酶抑制剂的裂解缓冲液提取细胞总蛋白,定量蛋白浓度后通过聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electrophoresis,SDS-PAGE)电泳,转印至PVDF 膜(聚偏二氟乙烯膜)。在封闭后,加入一抗孵育过夜,用TBST 洗涤后加入二抗孵育。显影等操作后,使用ImageJ 软件分析灰度值,利用GraphPad Prism 8 进行图像分析。
1.3 统计学分析
2 结果
2.1 不同浓度CoCl2对H9c2 细胞存活率的影响
通过建立H9c2 细胞缺氧模型,经0、100、300、500、750、1 000、1 300、1 600、2 000 μmol/L 浓度的氯化钴(CoCl2)对H9c2 细胞进行12 h、24 h、36 h 缺氧状态处理。随着CoCl2浓度的增高和时间的延长,H9c2 细胞存活率逐渐下降。在1 000 μmol/L CoCl2处理H9c2 细胞24 h 后,细胞活力降至(55.16±3.29)%,与0 h 相比具有显著差异(P<0.001)。活力下降程度处于50~60%范围内,适中且可控。因此,后续实验中选用1 000 μmol/L Co-Cl2建立H9c2 心肌细胞缺氧损伤模型。见表1。
表1 不同浓度CoCl2对H9c2 细胞活性的影响(n=3,±s)Tab 1 Effect of different concentrations of CoCl2 on H9c2 cell viability(n=3,±s)

表1 不同浓度CoCl2对H9c2 细胞活性的影响(n=3,±s)Tab 1 Effect of different concentrations of CoCl2 on H9c2 cell viability(n=3,±s)
注:与对照组相比,*P<0.05,**P<0.01,***P<0.001。
CoCl2浓度(μmol/L)时间(h)36 h 100.00±1.95 82.00±0.95***76.17±14.46***65.15±5.70***47.81±4.07***35.98±5.91***28.36±3.00***27.22±5.01***16.66±1.91***89.13<0.001 0 100 300 500 750 1 000 1 300 1 600 2 000 FP 12 h 100.00±9.88 98.80±4.20 95.50±3.54 87.37±1.81**82.30±3.56***77.08±3.18***66.66±3.72***63.28±4.47***61.21±4.20***40.67<0.001 24 h 100.00±3.91 93.48±2.03 88.27±2.13***82.58±2.53***66.71±3.73***55.16±3.29***51.15±5.05***45.75±3.85***36.29±3.79***173.93<0.001
2.2 不同浓度的Baicalin 对CoCl2诱导的H9c2 细胞缺氧损伤的影响
使用CCK8 法检测10、25、50、75、100 μmol/L浓度黄芩苷Baicalin 对1 000 μmol/L CoCl2处理24 h 的H9c2 细胞活力的影响。随着Baicalin 浓度增高,H9c2 细胞存活率呈逐渐上升趋势。单独CoCl2组相比,75 μmol/L Baicalin+CoCl2组细胞活力为(69.54±2.97)%,开始具有统计学意义(P<0.05)。然而,10 μmol/L、25 μmol/L、50 μmol/L 与CoCl2组,75 μmol/L 浓度组与100 μmol/L 浓度组之间的H9c2 细胞活力差异均无统计学意义(P>0.05)。因此,后续实验中选用75 μmol/L Baicalin 作为治疗心肌细胞缺氧损伤的治疗浓度。见表2。
表2 不同浓度Baicalin 对CoCl2诱导的H9c2 细胞缺氧损伤的影响(n=3,±s)Tab 2 Effect of different concentrations of Baicalin on Co-Cl2-induced hypoxic injury in H9c2 cells (n=3,±s)

表2 不同浓度Baicalin 对CoCl2诱导的H9c2 细胞缺氧损伤的影响(n=3,±s)Tab 2 Effect of different concentrations of Baicalin on Co-Cl2-induced hypoxic injury in H9c2 cells (n=3,±s)
注:与对照组相比,***P<0.001,与CoCl2 相比,#P<0.05,##P<0.01。
细胞活力(%)100.00±9.26 59.00±2.50***60.48±3.45 62.99±4.97 65.81±6.26 69.54±2.97#71.78±2.32##32.32 P<0.001组别对照组CoCl2组CoCl2+Baicalin 10 μmol/L 组CoCl2+Baicalin 25 μmol/L 组CoCl2+Baicalin 50 μmol/L 组CoCl2+Baicalin 75 μmol/L 组CoCl2+Baicalin 100 μmol/L 组FP
2.3 Baicalin 对H9c2 增殖能力的影响
将各组细胞按2.2 分组进行药物干预。与对照组相比,CoCl2组细胞活力明显下降(P<0.001);与CoCl2组相比,CoCl2+Baicalin 组和CoCl2+Y27632组细胞活力得到缓解(P<0.05);与CoCl2+Baicalin组相比,CoCl2+Baicalin+Y27632 联合组H9c2 细胞活力显著升高(P<0.01)。见表3。
表3 各组H9c2 细胞存活率情况(n=3,±s)Tab 3 H9c2 cells survival in each group(n=3,±s)
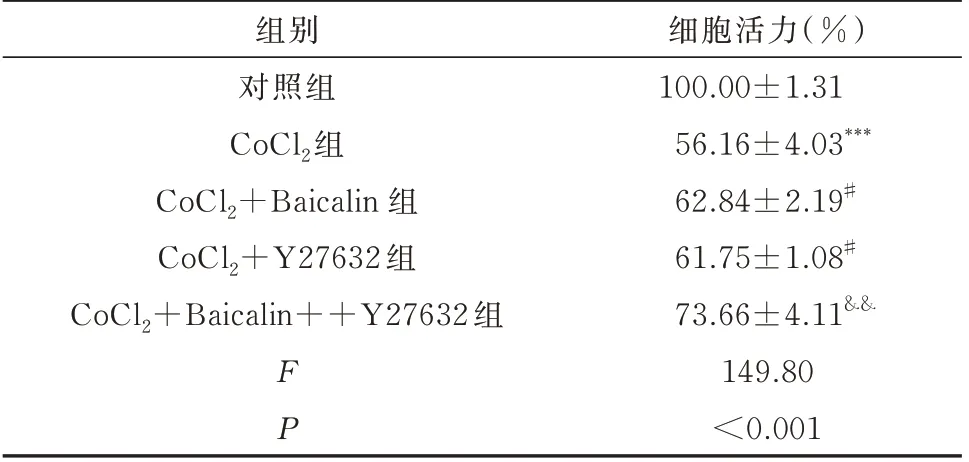
表3 各组H9c2 细胞存活率情况(n=3,±s)Tab 3 H9c2 cells survival in each group(n=3,±s)
注:与对照组相比,***P<0.001;与CoCl2 相比,#P<0.05,##P<0.01;与CoCl2+Baicalin 组相比,&&P<0.01。
细胞活力(%)100.00±1.31 56.16±4.03***62.84±2.19#61.75±1.08#73.66±4.11&&149.80<0.001组别对照组CoCl2组CoCl2+Baicalin 组CoCl2+Y27632 组CoCl2+Baicalin++Y27632 组FP
2.4 Baicalin 对各组H9c2 细胞ROS 水平的检测
与对照组相比,CoCl2作用H9c2 心肌细胞24 h可引起显著的氧化应激反应产生大量的ROS(P<0.001,t=11.08);与CoCl2组相比,Baicalin 或Y27632 预处理H9c2 细胞均能明显减少H9c2 细胞内ROS 的堆积(P<0.01,t=7.32;P<0.01,t=7.11);Y27632 Rho 激酶抑制剂干预后,CoCl2+Baicalin+Y27632 组相比CoCl2+Baicalin 组H9c2 细胞内 ROS 水平明显降低(P<0.05,t=2.93)。见图1。
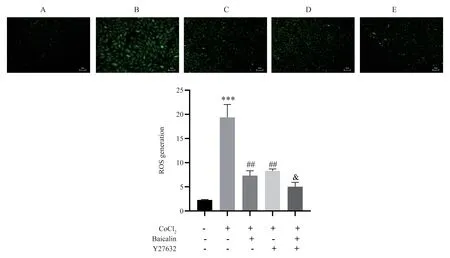
图1 各组H9c2 细胞内ROS 水平(100×)Fig 1 Intracellular ROS levels of H9c2 in each group(100×)
2.5 Baicalin 对各组H9c2 细胞SOD 活力、MDA 含量的检测
试剂盒测定结果显示,与对照组相比,CoCl2诱导H9c2 心肌细胞损伤后SOD 活性下降,MDA 含量升高(P<0.001,t=11.23;P<0.01,t=7.99);与Co-Cl2相比,Baicalin 或Y27632 预处理后可升高SOD活性(P<0.05,t=4.18;P<0.05,t=2.94),降低MDA 含量(P<0.05,t=2.90;P<0.05,t=3.20);与CoCl2+Baicalin 组相比,CoCl2+Baicalin+Y27632组更能显著增高SOD 活力,降低MDA 含量(P<0.05,t=3.16;P<0.05,t=2.79)。见图2。

图2 各组H9c2 细胞SOD 活力、MDA 含量Fig 2 SOD activity and MDA content in H9c2 cells of each group
2.6 Baicalin 对各组H9c2 细胞中信号蛋白和炎症因子蛋白的表达情况
信号蛋白相对表达量表达情况:与对照组相比,CoCl2组中RhoA、ROCK1、ROCK2 蛋白相对表达量明显增加(P<0.001,t=11.57;P<0.01,t=6.90;P<0.01,t=5.74);与CoCl2组相比,CoCl2+Baicalin 组RhoA、ROCK1、ROCK2 蛋白相对表达量下降(P<0.05,t=2.82;P<0.05,t=4.33;P<0.01,t=5.67),CoCl2+Y27632 组RhoA、ROCK1、ROCK2蛋白相对表达量也呈下降趋势(P<0.01,t=5.46;P<0.05,t=3.88;P<0.05,t=3.37);与CoCl2+Baicalin组,CoCl2+Baicalin+Y27632 组RhoA、ROCK1、ROCK2蛋白相对表达量显著下降(P<0.05,t=4.56;P<0.01,t=5.07;P<0.05,t=3.30)。见图3。
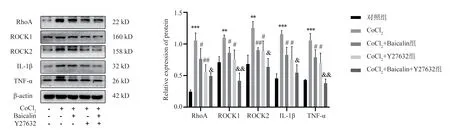
图3 各组H9c2 细胞蛋白相对表达量比较(n=3,±s)Fig 3 Comparison of relative protein expression in H9c2 cells of each group (n=3,±s)
炎症因子蛋白相对表达情况:与对照组相比,CoCl2组中IL-1β、TNF-α 蛋白相对表达量明显增加(P<0.001,t=13.35;P<0.001,t=9.75);与CoCl2组相比,CoCl2+Baicalin 组IL-1β、TNF-α 蛋白相对表达量下降(P<0.05,t=4.31;P<0.05,t=2.82),CoCl2+Y27632 组IL-1β、TNF-α 蛋白相对表达量也呈下降趋势(P<0.05,t=3.24;P<0.05,t=3.19);与CoCl2+Baicalin 组,CoCl2+Baicalin+Y27632 组IL-1β、TNF-α 蛋白相对表达量显著下降(P<0.05,t=2.84;P<0.01,t=5.12)。见图3。
3 讨论
在心脏组织中,由于心肌细胞损失无法通过有效的细胞增殖来补偿,异常的心肌细胞凋亡可能导致心脏疾病的发生[9]。在诸多心脏病类型中,缺血性心脏病是导致死亡或残疾的主要原因之一。目前发现无论是年轻人还是老年人罹患急性心肌梗死常伴有炎性细胞浸润[10],这可能是心肌细胞缺氧后和募集的炎症细胞通过病原体相关分子模式(PAMP)和损伤相关分子模式(DAMPs)与模式识别受体(PRRs)的结合而被激活,随后激活多种信号通路,最终过度表达更多促炎介质[11]。另外心肌缺血时血流恢复与活性氧的毒性作用有关[12]。这可能是氧化应激对心肌细胞中的一些生物分子造成氧化损伤影响钙离子平衡,使细胞内钙离子浓度上升导致心肌细胞收缩力[13],氧化应激也会影响心肌细胞的线粒体功能,线粒体功能障碍影响心肌细胞的内环境稳态形成恶行循环,一旦受损的线粒体增加就会激活心肌细胞死亡的途径[14]。
为了评估缺血损伤期间黄芩苷Baicalin 对心肌细胞的影响,本研究采用体外诱导的缺氧模型进行探讨。研究结果显示,1 000 μmol/L 的CoCl2处理H9c2 细胞24 h 后,以及75 μmol/L 黄芩苷作为治疗心肌细胞缺氧损伤浓度时,细胞活力较佳。在确定最佳条件后,对H9c2 细胞设置对照组、CoCl2组、CoCl2+Baicalin 组、CoCl2+Baicalin+Y27632 组、CoCl2+Y27632 组,通过活性氧荧光法检测ROS 水平,MDA 和SOD 检测氧化应激水平,Western Blot方法检测RhoA、ROCK1、ROCK2、TNF-α、IL-1β 的蛋白表达。
活性氧(ROS)是导致氧化应激的主要因素。在心肌缺氧过程中会引起细胞内能量代谢障碍、Ca2+离子平衡紊乱、氧自由基的大量产生和炎症反应的激活等,导致心肌细胞的氧化损伤。这些氧自由基和炎症反应产生的物质会直接或间接地导致细胞内的氧化应激,从而加剧心肌细胞的损伤和死亡[15]。ROS 与多种信号通路有关,其中ROS 可激活RhoA,这可能与形成分子内二硫化物,阻止鸟嘌呤核苷酸结合使RhoA 失活或促进鸟嘌呤核苷酸激活RhoA 有关[16]。另外有研究发现ROS-RhoA/ROCK 通路参与了心肌梗死的病理过程[17],还参与了减少肝细胞凋亡,逆转肝纤维化[18]。而本研究结果显示,黄芩苷能显著降低缺氧模型中H9c2 细胞的ROS 水平,而使用Y27632 Rho 激酶抑制剂干预后,细胞中的ROS 水平出现明显回升。李冰冰等[19]在研究中提到,黄芩苷可直接清除活性氧,减轻缺血再灌注大鼠心肌细胞氧化应激反应,提高心肌细胞的生物功能和存活率。而本研究进一步发现,黄芩苷可能是通过RhoA/ROCK 通路来影响ROS 的表达,增加SOD 活力,降低MDA 浓度,从而参与H9c2 细胞缺氧过程中的氧化应激过程。本研究中蛋白质印迹法分析显示与CoCl2组比较,CoCl2+黄芩苷+Baicalin 组的 RhoA、ROCK1、ROCK2、IL-1β、TNF-α 的蛋白表达有所降低,均再次证实了黄芩苷在心肌缺氧模型中能够通过RhoA/ROCK通路来缓解心肌细胞氧化应激和炎症反应,减少细胞死亡率。
RhoA 作为一种广泛表达的丝氨酸苏氨酸蛋白激酶,可以在细胞内被激活并与其下游效应蛋白ROCK 相互作用调节细胞的生理过程。抑制RhoA/ROCK 信号通路在心血管疾病、糖尿病并发症、肿瘤、急性肺损伤、神经损伤性疾病、肿瘤等多种疾病的治疗中具有潜在的保护作用[20],其机制可能与减少血管平滑肌细胞的过度收缩、缓解内皮功能障碍、减少炎症细胞募集、改善血管和心脏重塑等相关[21]。另外黄芩苷的抗氧化、抗肿瘤、调节免疫、抗抑郁等作用与RhoA/ROCK 降低有关[22],这间接说明黄芩苷可能通过抑制RhoA/ROCK 通路来发挥生物学作用。而本文研究表明黄芩苷减轻心肌缺血损伤实现对心脏的保护作用与抑制RhoA/ROCK 信号通路有关,这为黄芩苷作为心肌缺血相关疾病的治疗药物提供重要的实验基础。目前RhoA/ROCK 信号通路广泛参与细胞收缩、迁移、增殖的调节,而Yang 等[23]的研究表明RhoA/ROCK 信号通路抑制结肠癌细胞生长、增殖是通过miR-126 进行调控。本研究仅分析了黄芩苷通过RhoA/ROCK 通路来缓解心肌细胞氧化应激反应,降低细胞凋亡率,尚未探究黄芩苷是否通过调控miR-126 来影响RhoA/ROCK 通路,后续可进一步实验来证实。
本研究首次揭示了黄芩苷通过影响RhoA/ROCK 信号通路实现对心肌细胞缺氧的保护机制,为心肌细胞缺血损伤治疗提供了潜在靶点。研究聚焦于黄芩苷通过抑制ROS 依赖性调节RhoA/ROCK 信号通路对缺氧损伤心肌细胞的保护作用,这为黄芩苷在缺氧损伤疾病防治中作为新靶点的应用提供了更加充分的理论和实验依据,并为心肌细胞保护研究开辟了新的研究思路。
作者贡献度说明:
沈艳玲:撰写论文、数据分析;刘承红、王世魁、徐尧:完成细胞实验和指标检测、实验数据的收集;张云波:评价文献检索,完成文章初稿修改;顾申红:实验设计、论文最后校审。
所有作者声明不存在利益冲突关系。

