AIF1 在急性髓系白血病中的表达及生物信息学分析
高娅娅,李妙雨,孙文瑞,贾双双,田 彪,肖婉婷,张春燕,冯 娟,高广勋
(1.陕西中医药大学第二临床医学院,陕西 咸阳 712000;2.解放军空军军医大学西京医院血液内科,陕西 西安 710000)
急性髓系白血病(acute myeloid leukemia ,AML) 可由基因突变、染色体易位或分子水平的变化引起,是一种生存具有高度异质性的疾病,预后不一。AML 是成年人中最常见的白血病,约占所有疾病的80%[1]。随着诊疗技术的进展,AML 患者的生存较前有所改善,但老年人群的预后仍然较差[2]。新的生物标志物的发现可能有助于更好地理解AML 的分子基础,并在AML 的诊断、疗效预测、预后判断中发挥重要作用,甚至为未来的靶向药物开发和治疗提供新的靶点。
同种异体移植炎症因子-1(allograft inflammatory factor 1,AIF1)是一种 17 kDa 的钙结合蛋白,由单核细胞、巨噬细胞和淋巴细胞产生,它的合成是由 INF-γ 诱导的[3]。AIF1 基因位于染色体 6p21.3上的主要组织相容性复合体 Ⅲ类区域。既往在多种不同的疾病中观察到 AIF1 表达增加,包括子宫内膜异位症,动脉粥样硬化,类风湿性关节炎和纤维化[4,5]。既往研究报道AIF1 在神经系统退行性疾病和代谢紊乱(如代谢综合征和糖尿病)中促进疾病发生发展的作用[5,6],在糖尿病肾病中 AIF1 通过miR-34a/ATG4B 通路调节人肾小球内皮细胞的炎症、氧化应激和自噬水平,通过体内体外实验研究发现 AIF1 表达升高时,miR-34a、活性氧和炎症因子水平明显升高,而自噬相关蛋白下降,而 AIF1 基因下调效果相反[7]。也发现 AIF1 参与多种不同的肿瘤疾病中,包括乳腺癌,肝细胞癌,非小细胞肺癌等。在乳腺癌中,AIF1 通过激活 NF-κB/细胞周期蛋白 D1 通路促进乳腺癌增殖,促进肿瘤生长[8]。在肝细胞癌中 AIF1 表达升高与门静脉肿瘤血栓形成显著相关,沉默 AIF1 表达可抑制肝细胞癌细胞增殖和迁移[9]。在结直肠癌中 AIF1 通过激活 p38 MAPK 信号通路抑制结直肠癌细胞增殖和迁移,诱导细胞发生凋亡从而发挥抗肿瘤作用[10]。在非小细胞肺癌中,AIF1 通过激活 p38 MAPK 和 JAK/STAT 信号通路来促进非小细胞肺癌细胞系的增殖、迁移、IL-6 分泌和 VEGF 分泌[11]。非小细胞肺癌中高 AIF1 表达还与转移、较高的 TNM 分期和较差的生存率有关。在血液肿瘤中,课题组通过GEO 骨髓瘤数据集分析发现AIF1 在多发性骨髓瘤(multiple myeloma,MM)中低表达,且与MM 进展、治疗反应、ISS 分期及无进展生存期呈负相关。体外细胞水平验证了过表达AIF1 后增加了骨髓瘤H929、U266 细胞的凋亡比例,降低了自噬水平,初步机制探索认为AIF1 可能是通过 PI3K/AKT 通路影响 MM 细胞自噬和凋亡,综上表明 AIF1 可能在MM 发生发展中发挥着重要的作用。
本研究旨在通过数据库挖掘分析确定AIF1 的表达量与AML 预后之间的关系:首先,获得癌症基因组图谱(TCGA)和基因型-组织表达(GTEx)的初治AML 样本RNA-seq 数据,分析核心基因AIF1的差异表达[12]。其次,通过GO、KEGG 对AIF1 进行功能富集和通路富集分析,选择与AIF1 相关的显著改变的基因和通路。最后, 应用GEO 数据库的生存数据集进行Kaplan-Meier 生存曲线绘制、采用Cox 回归和诺莫图预测模型,分析AIF1 在AML中的临床意义。
1 材料与方法
1.1 RNA-seq 数据和生物信息学分析
通过UCSC Xena (https://xenabrowser.net/datapages/)网站获得癌症基因组图谱(TCGA)数据库和基因型-组织表达(GTEx)数据库的33 种肿瘤类型和正常组织的RNA-seq 数据及相关临床数据[13]。从TCGA 数据库(https://portal.gdc.cancer.gov/repository) 获 取 初 治 AML 样 本 的HTSeq-FPKM 和HTSeq-Count 数据进一步分析。本研究实施的所有程序均符合《赫尔辛基宣言》(2013 年修订)。
1.2 人类蛋白质图谱(HPA)数据库分析
HPA(https://www.proteinatlas.org/)数据库包含蛋白组学、转录组学以及系统生物学数据,可以绘制组织、细胞、器官等图谱,不仅收录了肿瘤组织以及正常组织的蛋白表达情况,还可以绘制肿瘤患者的生存曲线[14]。本研究以“AIF1”为关键词分析了AIF1 在各种细胞系如白血病细胞系、肺细胞系、乳腺细胞系和脑细胞系中的表达。
1.3 差异表达基因(DEGs)分析
使用R 软件中的“limma”包对合并后的数据集进行差异基因分析,以P<0.05(P:校正P)与|log2FC|>1.5 为过滤条件筛选DEGs。通过分析不同AIF1 表达组之间的差异表达基因(低表达组:0%~50%; 高表达组:50%~100%),利用pheatmap 包绘制热图,并标注上调与下调最显著的前10个DEGs。
1.4 富集分析
运用R 软件中“clusterProfiler”包,以P<0.05为过滤条件,对DEGs 进行基因本体 (gene ontology,GO)、京都基因和基因组数据库(Kyoto encyclopedia of genes and genomes,KEGG)和疾病本体(disease on-tology,DO)富集分析。
1.5 蛋白质互作(PPI)网络
利用Metascape (https://metascape.org/gp/index.htm)进行通路和过程富集分析。使用STRING数据库预测DEGs 的PPI 网络。用Cytoscape(版本3.9.0)绘制PPI 网络,并使用MCODE(版本1.6.1)识别PPI 网络中最重要的模块。根据PPI 的中心节点及聚类情况,筛选在显著性富集结果中出现的基因为关键基因[15]。
1.6 预后模型生成和预测
使用RMSR 软件(版本6.2.0)生成诺莫图,绘制诺莫图预测概率和观测率。并通过1 000 个自举样本的校准曲线来验证预测模型的准确性,当曲线与45°对角线吻合时,预测概率与实际结果频率一致性较好。P<0.05 为差异具有统计学意义。
1.7 分离收集CD34+细胞
收集西京医院血液科20 例初诊AML 患者的骨髓标本,10 例健康受试者的骨髓标本。健康受试者均接受病毒感染和骨髓异常的筛查,这些受试者没有使用过免疫调节药物,也没有已知的影响免疫系统的疾病。采用密度梯度离心法分离骨髓单个核细胞,CD34+磁珠分选CD34+细胞。冷冻CD34+细胞用于后续实验。
1.8 免疫印迹
根据上述方法收集患者骨髓样本,并收集单个核细胞裂解物。使用RIPA 缓冲液低温下提取蛋白样品,并在4 ℃离心30 min 去除不溶物。电泳分离蛋白质后,PVDF 膜进行蛋白质转移,室温下牛奶封闭 1 h。在 4 ℃ 冰箱中与AIF1 一抗孵育过夜。次日用TBST 洗涤 PVDF 膜,并在室温下与二抗孵育1 h。TBST 去除过量的抗体后使用发光试剂盒进行曝光。选择 GAPDH 作为内参,通过 Image Lab分析蛋白表达量。
1.9 qRT-PCR
用TRIzol 法提取单个核细胞的总RNA。根据mRNA qPCR RT Master Mix 试剂盒合成cDNA,使用SYBRⓇGreen Realtime PCR Master Mix 进行实时荧光定量PCR。以GAPDH 作为内参。AIF1的特异性引物如下:正向,5′-ACGTTCAGCTACCCTGACTTTCT-3′;反向,5′-CCTGTTGGCTTTTCCTTTTCTCT-3′。GAPDH 的特异性引物如下:正向,5′-GGAGCGAGATCCCTCCAAAAT-3′;反向,5′- GGCTGTTGTCATACT TCTCATGG -3′。
1.10 统计学分析
所有的统计分析都基于R 软件(版本:3.6.3)或者SPSS(版本:23.0)。
2 结果
2.1 AIF1 在泛癌和AML 中的表达
从 UCSC XENA (https://xenabrowser.net/datapages/)下载TCGA 数据库中肿瘤和GTEx 数据库中正常人的RNA-seq 数据。通过标准化分析,本研究发现AIF1 在25 种肿瘤中存在显著表达差异(图1A),在初治AML 患者样本中表达高于正常组织(图1B)。随后,根据HPA 数据库中RNA-Seq 数据分析AIF1 在初治AML 中的相对表达水平,可发现AIF1 mRNA 在AML 细胞系如HMC-1、NB-4、HEL、THP-1 和U937 中的表达高于淋巴细胞系。同时,AIF1 mRNA 在其他如脑、胰腺、肺等的细胞系中几乎不表达(图1C)。
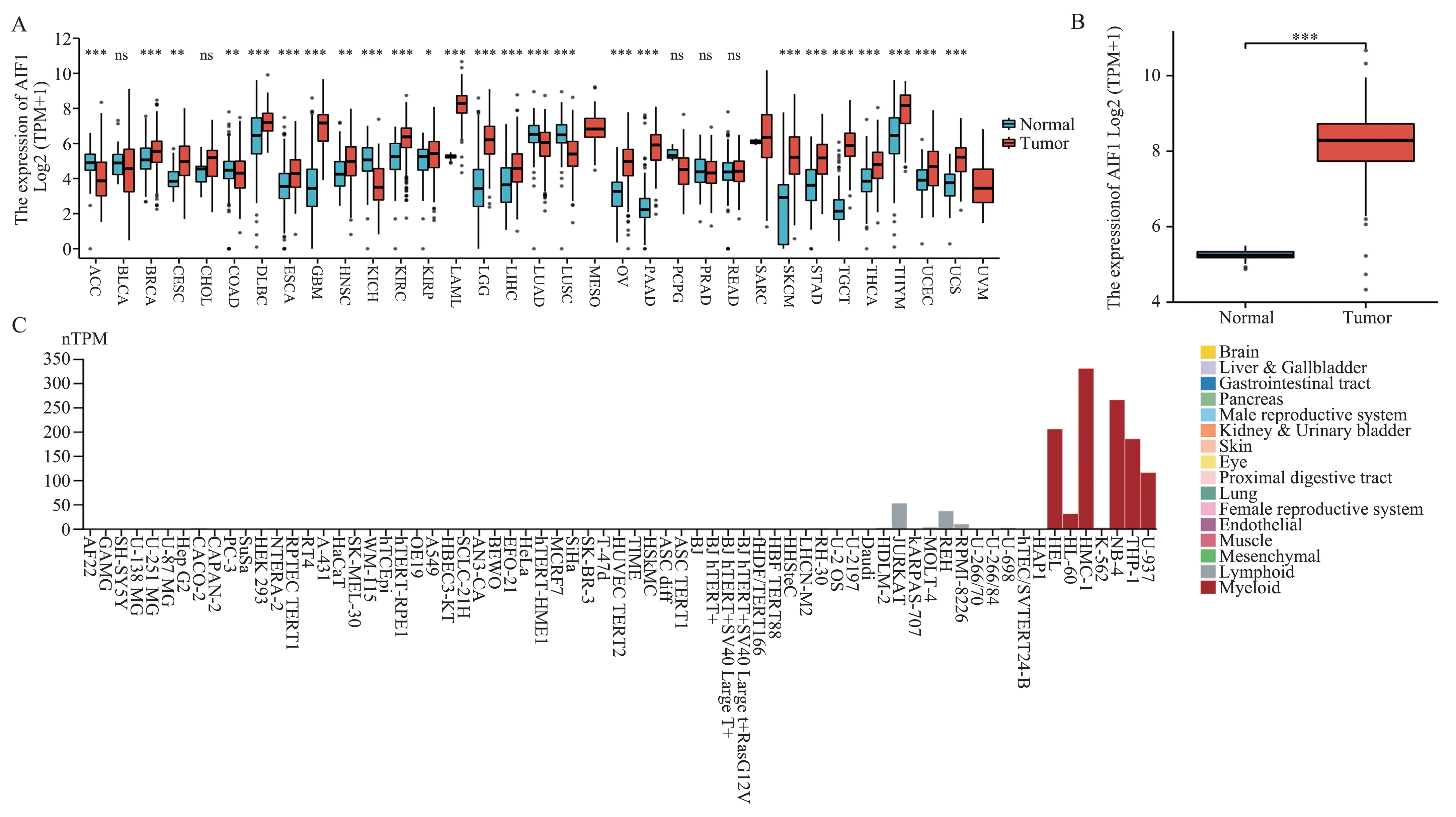
图1 AIF1 在泛癌和AML 中的表达Fig 1 The expression of AIF1 in AML compared with normal samples
2.2 AIF1 高表达和低表达的AML 样本的DEGs鉴定
分析高、低表达组间基因表达谱mRNA 中位表达量的差异,鉴定出具有统计学意义(|logFC| >1.5,P<0.05) 的DEGs 共1 275 个,其中有444 个上调基因和831 个下调基因(图2A)。AIF1 高表达组差异最显著的前5 个DEGs 和低表达组差异最显著的前5 个DEGs(图2B)。
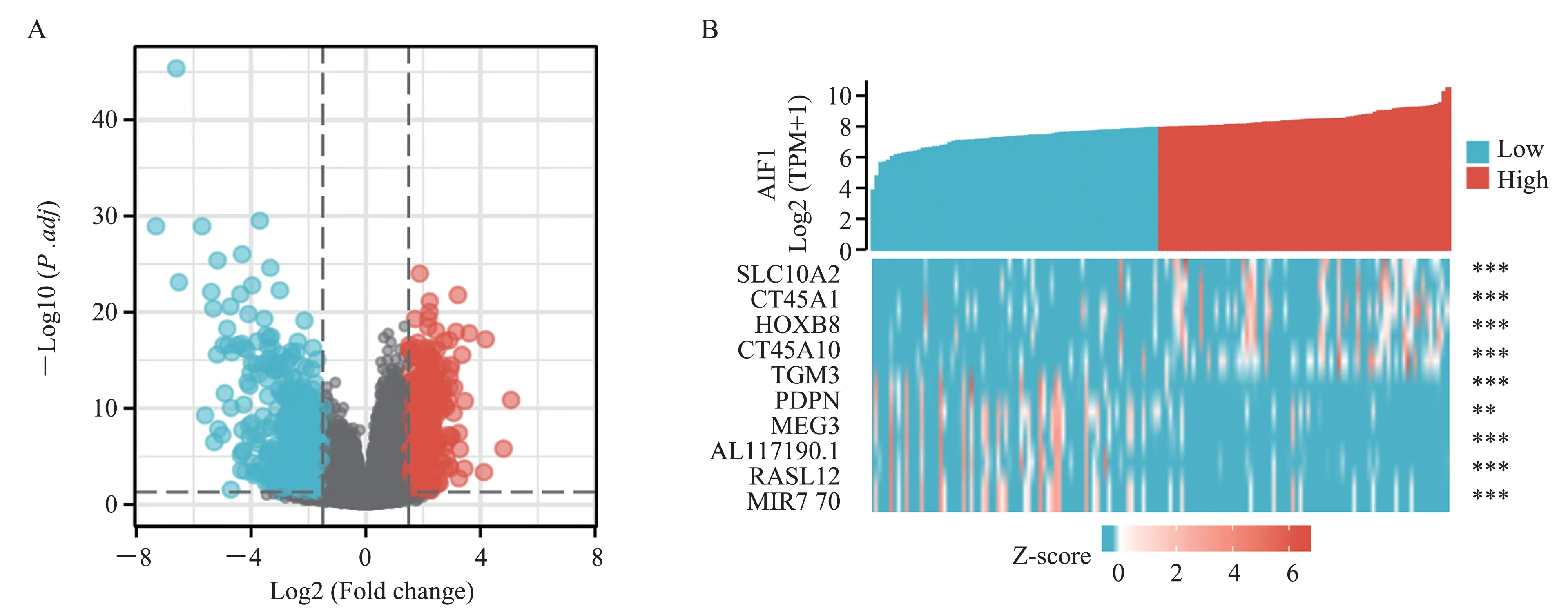
图2 AIF1 高表达和低表达的AML 样本的DEGs 鉴定Fig 2 Identification of DEGs in AML samples with high and low expression of AIF1
2.3 DEGs 功能富集分析
为探索AML 中AIF1 高表达和低表达之间的DEGs 的功能意义,本研究使用cluster profile 包进行GO 分析和KEGG 通路富集分析(补充表1,图3)。GO 分析结果显示DEGs 与生物过程(BP)相关的功能包括白细胞迁移、细胞外结构组织和细胞外基质组织;与细胞成分(CC)相关的包括含胶原的细胞外基质、神经元胞体和质膜外侧面;与分子功能(MF)相关的包括受体配体活性、细胞外基质结构成分、货物受体活性。KEGG 分析发现DEGs 功能涉及神经活性配体-受体相互作用、细胞因子-细胞因子受体相互作用和金黄色葡萄球菌感染。

表1 TCGA 数据库AML 样本中AIF1 表达与临床病理特征之间的关系[n(%)]Tab 1 Association between AIF1 expression and clinicopathologic features in AML samples from the TCGA database[n(%)]
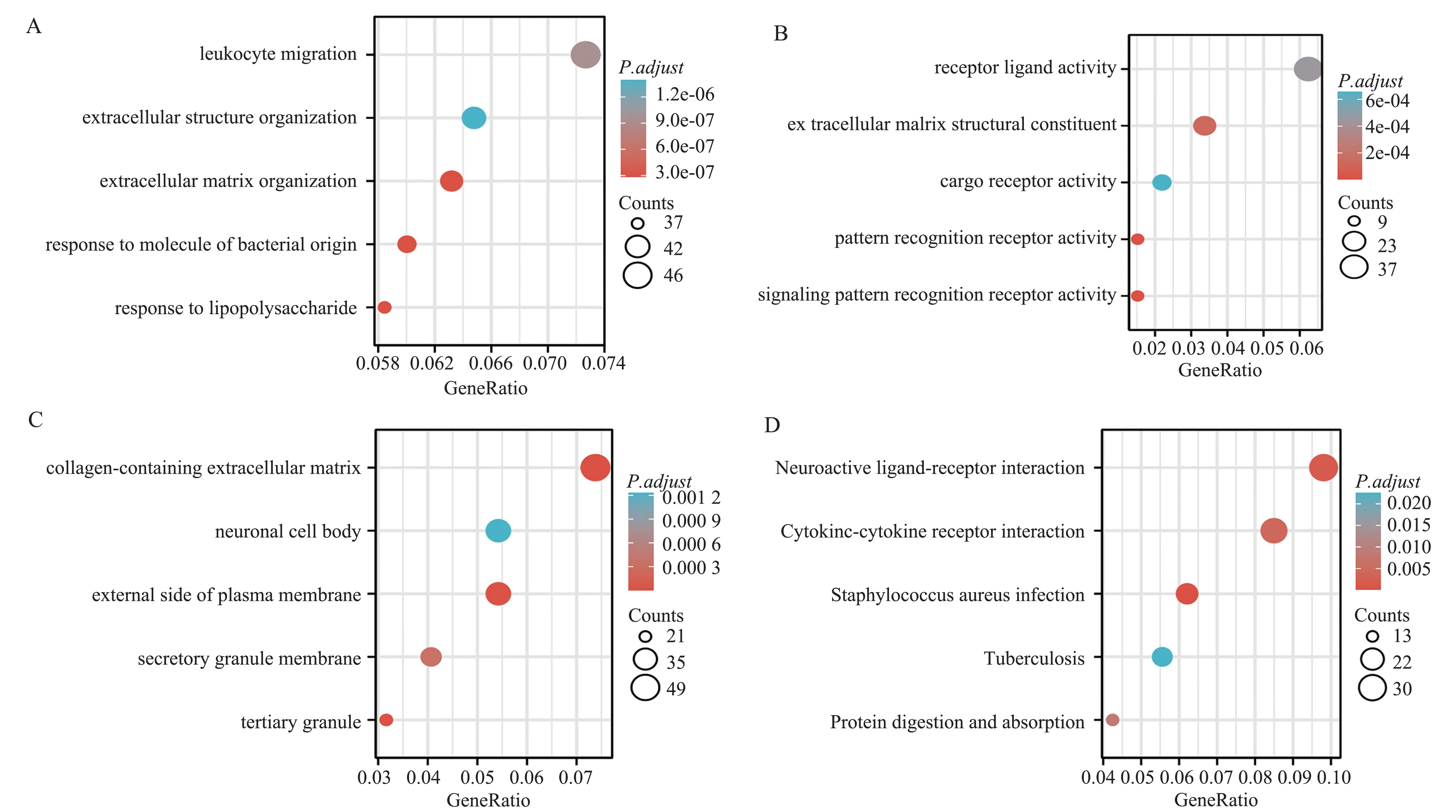
图3 TCGA-LAML 患者AIF1 高表达和低表达DEGs 的GO/KEGG 富集分析Fig 3 GO/KEGG enrichment analysis of DEGs between high and low AIF1 expression in TCGA-LAML patients
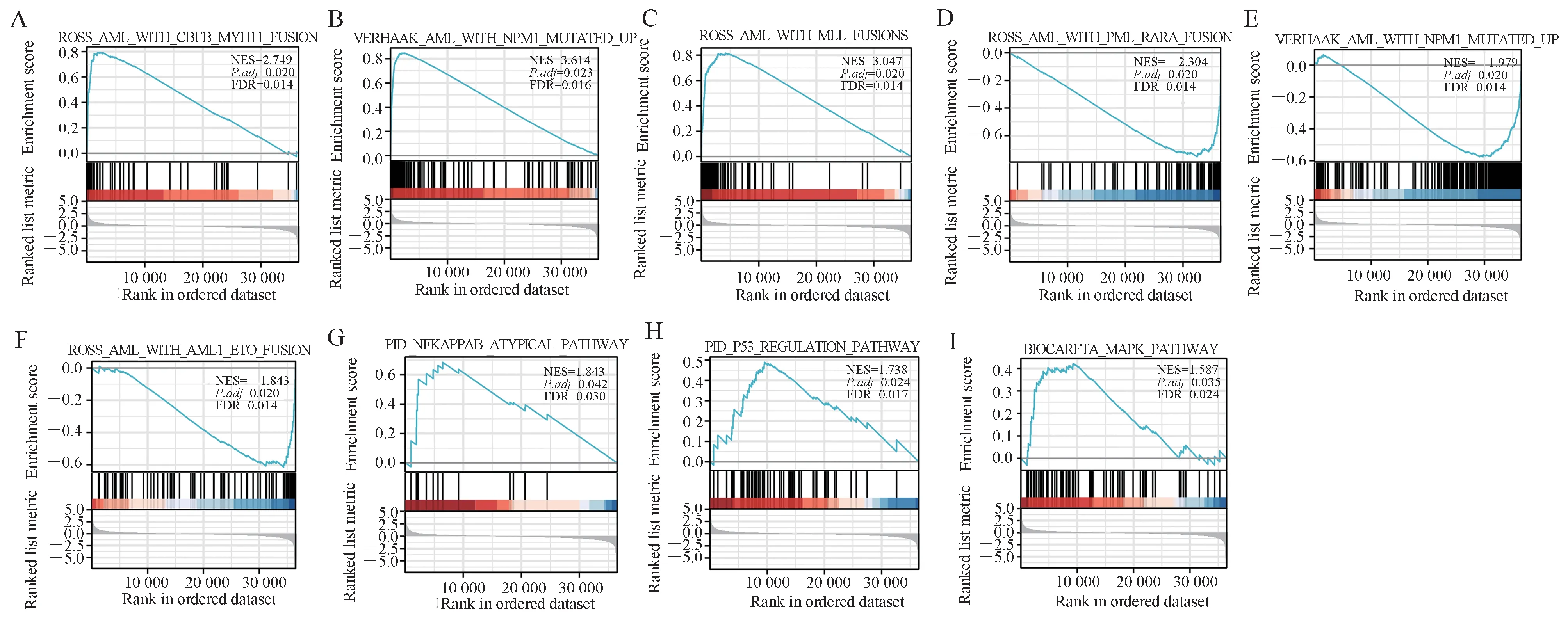
图4 富集图来自基因集富集分析(GSEA)Fig 4 Enrichment plots from the gene set enrichment analysis (GSEA)
在AIF1 高表达和低表达的数据集之间进行GSEA 分析,以识别参与AML 的关键信号通路。在这些通路的数据库MSigDB 中观察到显著的差异 (FDR<0.25, 校正P<0.05)(补充表2 和图4)。在AIF1 高表达组中,AML 中的基因突变或融合基因如CBFB-MYH11 融合、NPM1 突变和MLL 融合显著富集(校正P<0.05,FDR<0.05)(图4A~4C)。相反,在AIF1 低表达组中,AML 中预后较好的因子如PML-RARA 融合基因和AML1-ETO 融合基因表现出显著富集(图4D~4F)。AIF1 涉及NFκB、P53 和MAPK 通路参与AML 及其他肿瘤的发生(图4G~4I)。

表2 logistic 回归分析AML 临床病理因素与AIF1 表达的关系Tab 2 The relationship between the clinicopathological factors of AML and AIF1 expression by using logistic analysis
2.4 AML 的PPI 富集分析
通过STRING 构建AIF1 及其相关基因的共表达网络,共筛选出1 275 个DEGs(| logFC | >1.5,P<0.05)并导入PPI 网络。利用Cytoscape-MCODE显示PPI 网络。最显著的模块MCODE 得分为20.267,包含31 个节点和608 条边(图5)。
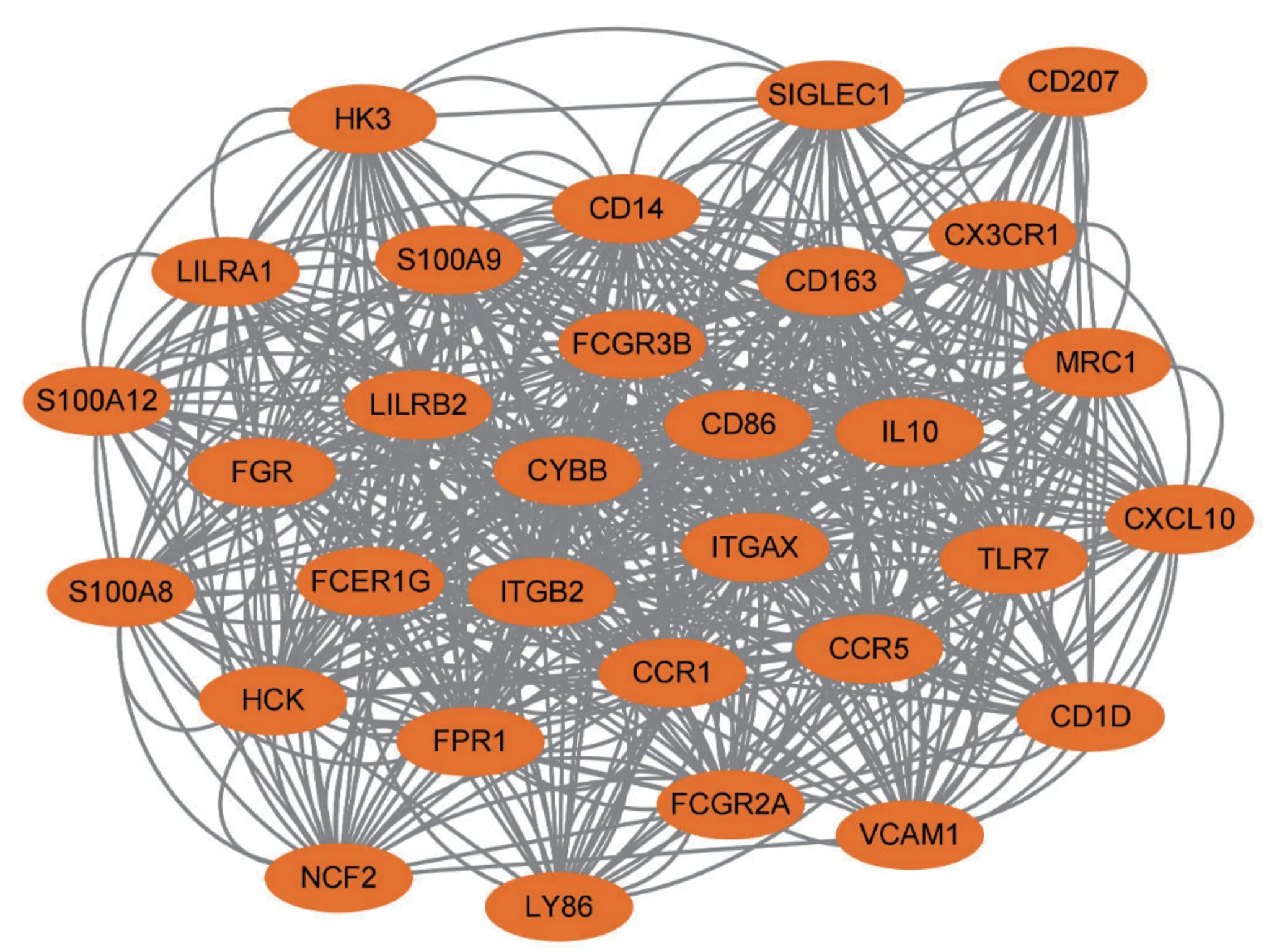
图5 AIF1 相关DEGs 的PPI 网络Fig 5 The PPI network of AIF1-related DEGs
2.5 AIF1 表达与AML 临床特征的关系
表1 是TCGA 中AML 患者的主要临床特征。共纳入151 例患者,其中男性83 例,女性68 例,平均年龄65.5 岁。其中,AIF1 在75 例(49.7%)AML 患者中低表达,其余76 例(49.3%)患者中高表达。相关性分析提示AIF1 高表达与细胞遗传学风险、FAB 分型、NPM1 突变、白细胞(WBC)计数(×109/L)显著正相关(P<0.001)。此外,AIF1 表达与总生存期(overall survival , OS)显著相关(P=0.009),高表达患者生存期则较短。
采用Logistic 回归分析进一步验证AML 患者临床病理因素与AIF1 表达的关系。结果显示AIF1高表达与高WBC 计数(×109/L) (OR=4.264;P<0.001)、高细胞遗传学风险(OR=7.322;P<0.001)和NPM1 高突变(OR=6.245;P<0.001)呈显著正相关(表2)。ROC 曲线分析AIF1 在AML中的潜在诊断价值,AUC 值为0.985,提示AIF1 可能是诊断AML 的潜在生物标志物(图6A)。采用Wilcoxon 秩和检验比较AIF1 在不同临床病理特征患者中的表达情况。结果显示,在RAS 突变阳性、WBC 计数>20×109/L、非M3 型、细胞遗传学风险为中/差和NPM1 突变阳性的患者中AIF1 显著高表达(图6B~6F),这些临床病理特征多数与不良预后相关。

图6 AIF1 表达与临床特征之间的关系Fig 6 Association between AIF1 expression and clinical features
2.6 AIF1 高表达对不同临床病理状态AML 患者预后的影响
采用Kaplan-Meier 法分析AIF1 表达与AML患者预后的关系。如图7A 所示,AIF1 高表达患者的预后明显差于AIF1 低表达患者(OR=1.86(1.22-2.86);P=0.004)。Kaplan-Meier 分析显示,在年龄≤60 岁(P=0.035)、年龄> 60 岁(P=0.041)、WBC 计数(≤20×109/L)(P< 0.001)、骨髓原始细胞 ≥ 20% (P= 0.04)、外周血原始细胞≤70% (P= 0.034)、IDH1 R132 突变阴性(P=0.007) 、R140 突变阴性(P= 0.034) 、R172 突变阴性(P=0.014)的亚组中,AIF1 高表达与不良预后相关(图7B~7I)。
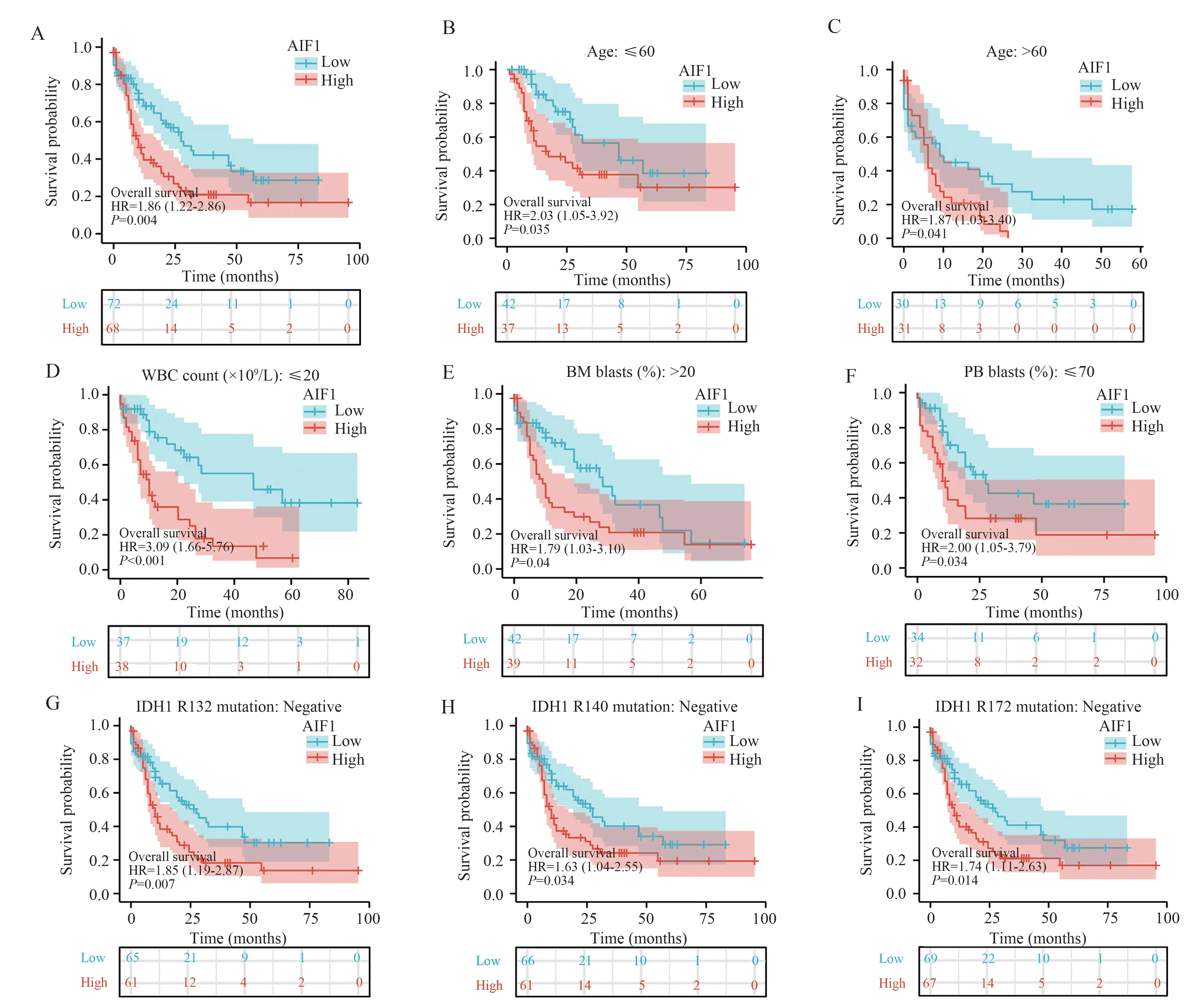
图7 AIF1 高表达与AML 患者较差的OS 相关Fig 7 High expression of AIF1 was associated with poor OS in AML patients
使用单因素Cox 回归来评估OS 的预后影响因素,发现AIF1 高表达(P=0.004)、细胞遗传学风险为差/中等(P<0.001)、年龄>60 岁(P<0.001)均为OS 的预后不良因素(表3)。进一步行多因素Cox 回归分析,仅AIF1 高表达(P=0.019)和年龄> 60 岁(P<0.001)具有统计学意义,表明二者为OS 的独立预后不良因素。

表3 单因素和多因素Cox 回归分析影响AML 患者OS 的因素Tab 3 Univariate and multivariate Cox’s regression analysis of factors associated with OS in AML
2.7 AIF1 在AML 中的预后模型
为了更好地预测AML 患者的预后,基于Cox回归分析,使用RMS R 包构建诺莫图 (图8A)。年龄、细胞遗传学风险和AIF1 表达等3 个预后因素被纳入到预测模型中。同时,利用校准图评价预后模型的预测精度。构建带有校准曲线的预后诺莫图,预测个体1、3、5 年的OS (图8B~D)。

图8 AIF1 在AML 中的预后预测模型Fig 8 A prognostic predictive model of AIF1 in AML
2.8 数据验证
基于GEPIA 数据库分析,本研究发现与正常组相比,AIF1 mRNA 表达在AML 患者中显著增加(P< 0.01,|Log2FC| > 1)(图9A)。进一步收集AML患者和健康受试者的骨髓样本,分离CD34+细胞,用于qPCR 和Western blot (图9B、C),显示AIF1 在AML 中的表达水平升高。
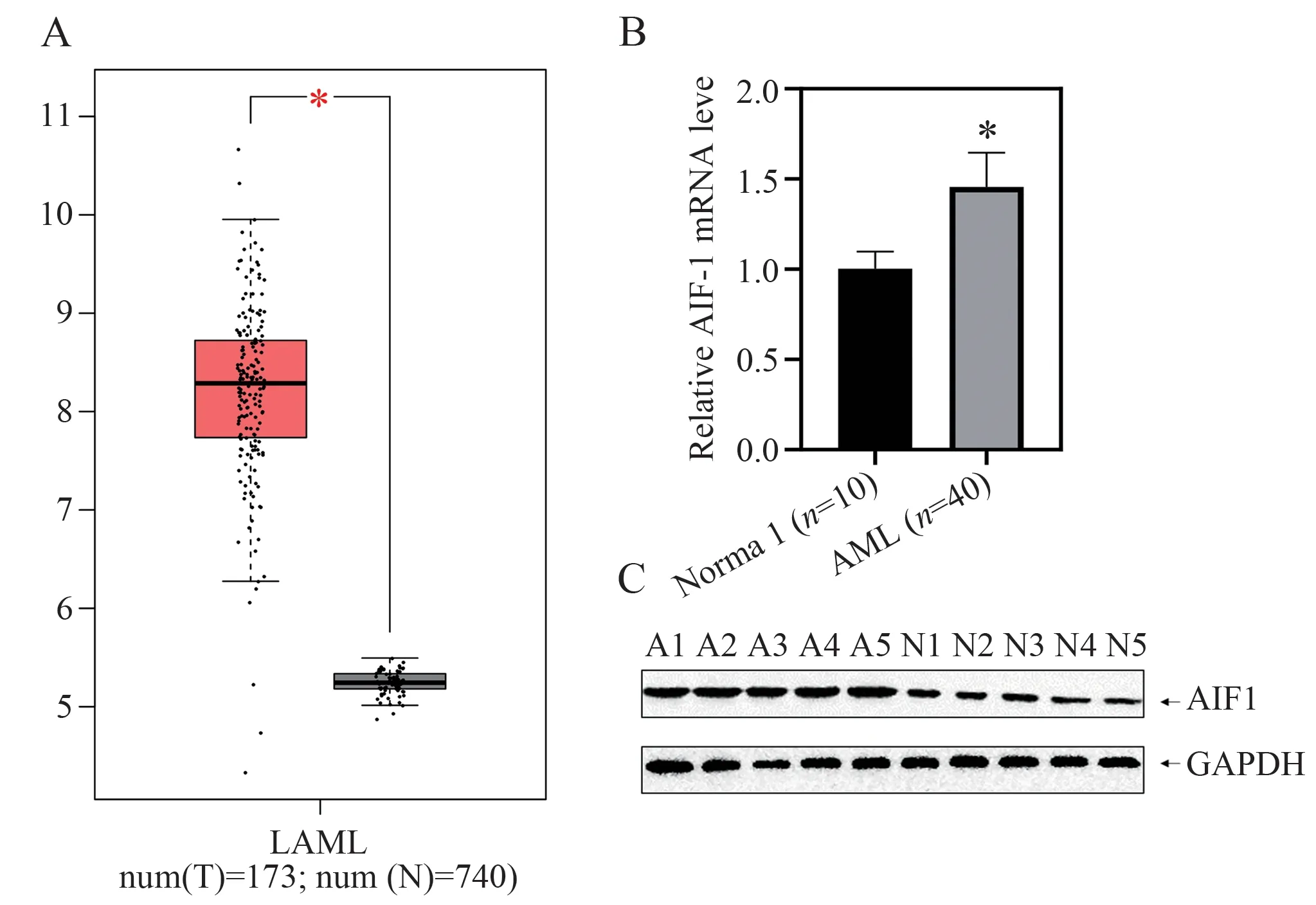
图9 数据验证Fig 9 Data validation
3 讨论
AIF1 是一种17 kDa 的胞质钙结合炎症反应支架蛋白,主要在免疫细胞中表达[16]。参与各种炎症性疾病,如类风湿关节炎、结肠炎、自身免疫性疾病的发生发展[17,18]。有研究表明,AIF1 通过激活NF-κB/cyclinD1 通路促进乳腺癌增殖,通过p38 MAPK 信号通路上调TNF-α 促进乳腺癌细胞迁移。在胃癌中,AIF1 调节β-catenin 可作为保护性预后指标[19]。然而,目前对AIF1 在AML 中的表达和预后价值知之甚少。
本研究的核心结果是AIF1 在AML 中高表达,并与高细胞遗传学风险和不良预后相关。GSEA 基因富集分析结果提示,AIF1 低表达与NPM1 突变、PML-RARa 融合、AML-ETO 融合相关,是良好的预后因素。相反,AIF1 高表达与NFκB、P53 和MAPK 通路相关,表明AIF1 是一个潜在的预后生物标志物[5],而且与AML 的致癌通路相关,可能成为一个有前景的治疗靶点。更重要的是,本研究发现在NPM1 突变的AML 中,AIF1 高表达预示预后不良。NPM1 突变发生于约30%的初诊AML,这是迄今为止在AML 中,发现的最常见的基因异常之一。一般认为孤立的NPM1 突变对AML 有积极的预后作用[20,21]。但约30%~60%的NPM1 突变的AML 患者在5 年内复发,或许与AIF1 表达异质性相关,具体机制尚不明确有待进一步研究。此外,NFκB、p53 和MAPK 通路也被发现与AIF1 的高表达密切相关[22]。NF-κB 在AML 中持续激活,使白血病细胞逃避程序性细胞死亡机制,从而增加细胞增殖[22,23]。本研究发现AIF1 高表达与这些通路相关,可能导致其不良预后。
另外,值得注意的是AIF1 高表达与低生存率相关。多因素Cox 回归分析显示AIF1 高表达是除年龄(>60 岁)外的另一个独立不良预后因素。诺莫图预测模型的建立进一步证实了AIF1 表达对预后的预测作用。因此,AIF1 可能是AML 患者新的不良预后因素。将AIF1、细胞遗传学风险和年龄相结合,构建诺莫图模型,获得更准确的预后预测模型。校准图显示AIF1 相关诺莫图的预测值与1 年、3 年、5 年OS 概率的实际观测值一致性较好。据报道,高龄(>60 岁)、高细胞遗传学风险、高WBC 计数(>20×109/L)、FLT3 突变阳性和NPM1 突变阴性是AML 不良预后的预测因素[24]。通过Cox 回归分析和诺莫图模型,发现AIF1 的预测能力可能优于细胞遗传学风险、高WBC 计数、FLT3 突变状态。从这个角度来看,本研究模型可能为个体AML 患者提供个性化评分。
综上所述,本研究首次揭示了AIF1 在AML 中高表达,不仅是AML 预后不良的潜在生物标志物,且可能通过调节免疫细胞的肿瘤侵袭在 AIF1 微环境中发挥重要作用,提示AIF1 可作为调节抗肿瘤免疫应答的治疗靶点。本研究也有一定局限性。首先,由于回溯性特征,研究可能导致选择偏差,未来可进行前瞻性研究以验证生物标志物在AML 个性化管理中的临床应用。其次,未进一步证实AIF1在肿瘤中作用的相关通路。再次AIF1 治疗肿瘤免疫的基础机制和免疫特征的预后价值应进一步研究。
作者贡献度说明:
高娅娅:数据分析及文章写作;李妙雨,孙文瑞,贾双双, 田彪, 肖婉婷,张春燕,冯娟:给予修改意见;高广勋:指导研究设计及文章写作并提供项目基金支持。
所有作者声明不存在利益冲突关系。

