Gremlin-1 在骨关节炎中的研究进展
周 塏,杜秀藩,杨城阔,王广积
(海南医学院附属海南医院 海南省人民医院 运动医学科,海南 海口 570311)
骨关节炎是最常见的慢性退行性关节疾病,其特征是关节软骨的破坏,包括软骨细胞凋亡、细胞外基质(ECM)降解、软骨下损伤以及骨赘形成[1],可引起关节的不稳定、疼痛、肿胀等症状,甚至还可导致残疾,极度的影响人们的正常生活。目前OA的发病机制尚不明确,先前的研究发现OA 的形成是一个极其复杂的过程,与关节软骨退化、软骨细胞衰老以及关节腔内炎症等诸多因素密切相关[2],近些年来,研究发现表观遗传机制及基因异常表达影响着OA 的进展[3],其中Gremlin-1(Grem-1)基因在OA 中起着至关重要的作用,它可通过抑制BMP/Smad 信号通路以及介导Wnt/b-连环蛋白/NF-κB 信号通路从而导致了软骨细胞损伤、破坏以及加重了滑膜炎症。与此同时,Grem-1 还通过干预软骨生成及软骨内骨化过程,从而进一步加重OA进程。因此,本文将研究了解Grem-1 与OA 的关系,探讨其干扰骨形成过程,分析Grem-1 介导相关信号通路致使关节软骨破坏与修复机制过程,并可能为OA 提供一个潜在的治疗靶向因子。
1 Grem-1 概述
Grem-1 是一种高度保守的糖蛋白,分子量为27 kDa,属于分泌性BMP 拮抗剂的Cerberus 和Dan亚家族[4],主要是通过与BMP 上的胱氨酸键发生结合,从而抑制了BMP 与其相应受体结合而发挥作用。Grem-1 位于染色体15q13-q15 上,可编码近184 种氨基酸,并在多种组织中表达[5]。研究发现,Grem-1 参与了器官发育、组织分化以及骨形成分化等过程[6],如今它已被证实与多种疾病的发生、发展有关,如癌症[7]、糖尿病[8]、骨关节炎[9]等等,其相关疾病的发生机制多与Grem-1 参与的BMP/ Smads通路和Wnt/b-连环蛋白通路以及NF-κB 信号通路相关。但目前对该基因的研究仍处于初步阶段,还有许多所介导的机制或者分子尚未被研究,往后需要进行挖掘相关分子与机制并验证以期能够在此领域有突破性的进展,对未来相关靶向因子的研发具有极大的作用。
2 Grem-1 表达水平与骨关节炎的关系
研究发现,骨形态发生蛋白(BMP)属于转化生长因子-β(TGF-β)超家族的成员,参与骨形成以及骨和软骨的修复过程[10],而Grem-1 是一种BMP 拮抗剂,与BMP-2 和BMP-4 具有很高的结合能力[11],通过可与其结合而介导OA 的发生过程,据报道,Grem-1 表达在早期骨关节炎软骨中显著升高,并随着疾病进展而增加[12]。值得注意的是,Grem-1 显著抑制了人类MSC 代谢以及DNA 含量,并且还可降低成骨细胞基因的表达水平,从而抑制了成骨细胞的形成[13]。此外,Grem-1 基因还可促使软骨的终末肥厚分化,致使OA 的形成[14]。以下将详细介绍Grem-1 影响骨形成过程。
2.1 Grem-1 介导间充质干细胞代谢以及成骨分化过程
间充质干细胞(MSC),也称为多能基质细胞,对骨的形成和发育有重要作用[15],作为成骨细胞的前体,间充质干细胞在特定微环境中发生成骨分化,调节体内骨代谢的稳态过程[16],先前研究表明,Grem-1 通过靶向BMP2 和BMP4 来抑制MSC 的成骨分化过程,其大致作用机制主要为Grem-1 通过抑制BMP/Smad 的信号转导过程,通过阻断BMP 信号传导与受体Ⅱ型(R-Ⅱ)和受体Ⅰ型(R-Ⅰ)结合,致使特定Smad 蛋白(R-Smads)的无法磷酸化,阻断了R-Smads 与Smad 以及Smad4 形成复合物,导致相关复合物无法易位到细胞核中以指导转录反应[17](图1)。此外,Grem-1 还可通过BMP/Smad 通路介导相关途径抑制了MSX2 和RUNX2 的表达,从而抑制了间充质干细胞代谢以及成骨分化过程。因此,BMP/Smad 信号传导以及MSX2、RUNX2 的表达在成骨细胞分化和骨形成中起着关键的调节功能。目前已有许多研究证实Grem-1 干扰BMP/Smad 信号传导的还可导致其他多种临床疾病的发生。值得注意的是,已有研究相关分子通过抑制Grem-1 或调控MSC 代谢从而促进成骨细胞的分化。主要是由于MSC 受各种RNA 修饰与控制[18],而研究发现N-乙酰转移酶 10 (NAT10)在关节软骨中介导了RNA 乙酰转移酶4mRNA 的C 修饰[19]而调控MSC 代谢,此外,NAT10 还可抑制Grem-1的表达,调节smad1/5/9 信号通路以及MSC 的成骨能力[20]。最后,由于Grem-1 具有抑制成骨分化,拮抗BMP 转录作用,因此,未来对Grem-1 或BMP/Smad 信号分子以及MSC 成骨能力更深入研究并探讨其相关因子在治疗骨骼相关疾病方面具有巨大的潜力。

图1 Gremlin-1 介导BMP/Smad 信号转导抑制成骨细胞分化过程Fig 1 Gremlin-1 mediating BMP/SMAD signaling inhibits osteoblast differentiation
2.2 Grem-1 介导软骨生成及软骨内骨化过程
软骨生成与软骨内骨化是一种复杂的生物现象,涉及多种因素和细胞过程[21]。其中BMP 介导了这一过程的发生。相关研究表明,BMP 信号传导在软骨生成和软骨内骨形成的中起至关重要作用[22]。在软骨生成的最早阶段,BMP 信号传导促进间充质细胞分化为软骨细胞,并通过诱导Sox9 表达刺激软骨细胞增殖。同时,还通过促进软骨细胞肥大来控制软骨细胞分化过程,Grem-1 作为BMP 信号传导的拮抗剂,主要是通过抑制BMP 信号传导与Ⅰ型和Ⅱ型受体的形成异四聚体复合物,阻止了相关靶向基因表达的Smad 依赖性典型途径和Smad 非规范 MAPK 途径的激活[23]。从而抑制了软骨生成及软骨内骨化过程。同时Grem-1 还可促使软骨破坏损伤以及加重OA 的病程,值得注意的是,有研究发现通过抑制BMP2 的表达可以减轻OA 中的软骨变性以及软骨下骨的破坏[24]。表明了通过减少Grem-1 与BMP2 的结合有助于OA 的缓解。然而据目前研究已知抑制Grem-1 基因有利于减少了OA 病理以及还可促使软骨生成及软骨内骨化过程,未来为OA 预防和早期疾病治疗提供了新的治疗靶点。
3 Wnt/b-连环蛋白信号/NF-κB 信号通路在OA中的作用
在骨骼和关节病理学中,Wnt/β-连环蛋白信号通路已被证明影响骨骼、软骨和滑膜组织的作用[25],先前的研究表明,退行性或骨关节炎软骨中β-连环蛋白表达水平升高,并可通过诱导了MMP和其他蛋白酶的快速基因表达,从而导致蛋白多糖基质的降解[26]。此外,Wnt/β-连环蛋白信号通路的激活通过下调SIRT-1 促进软骨细胞衰老,加重OA的进展[27],但有研究显示:Wnt 通路的激活可以诱导甚至加速受损关节软骨的修复[28]。因此,可以推断出适度的Wnt 活性对于软骨的生理维持是必要的,而强烈抑制或激活Wnt 通路会促使相关疾病(如OA)的发生。而值得注意的是,NF-κB 信号通路与OA 也有极大的联系,研究证实了NF-κB 信号通路激活后致使软骨基质重塑、软骨细胞凋亡以及滑膜炎症[29],从而加重OA,以下将详细介绍Grem-1 介导在以上两条信号通路在OA 中的作用。
3.1 Grem-1 参与Wnt/b-连环蛋白信号通路在OA中的相互作用
目前已有许多研究证实了Wnt 通路不仅参与软骨或软骨下骨的病理生理过程,而且对整个关节起了复杂的作用[30],其主要作用过程为Wnt 信号分子与其特定的细胞膜受体结合时,致使蛋白质Frizzled(Fzd)和辅助受体低密度脂蛋白受体相关蛋白(LRP5 / 6)的激活,导致功能信号传导。随后Dvl的活化导致多蛋白复合物解离,导致GSK3β 失活。最后,细胞质中积累的β-连环蛋白易位到细胞核,从而与LEF 和TCF 相互作用,引发靶基因的转录激活[31],导致相关疾病(如OA)的发生。由此可见,Wnt 通路异常激活可对软骨造成极大的损伤。然而,Grem-1 可通过未知的间接机制抑制WNT 信号传导[32],但抑制典型WNT 信号又可诱导Grem-1 的mRNA 表达,有趣的是,WNT 信号与BMP 信号之间也有相互影响作用,相关研究也证实了WNT 信号传导的激活降低编码BMP 拮抗剂(Grem-1)的基因的表达,并与BMP 信号传导的上调有关。反过来,BMP 信号传导的激活导致编码WNT 拮抗剂(FRZB、DKK1)的基因表达增加,这与WNT 信号传导减少有关[33](见图2)。由此可见,Grem-1 与WNT 信号之间的关系是通过BMP 介导的,目前未有相关研究报道由Grem-1 与WNT 信号之间调控而影响OA,近年来,有一项研究表明,骨关节炎与软骨中的Grem-1 与FRZB 和DKK1 基因表达之间存在负相关关系[34],表明了BMP 和WNT 信号在负反馈回路中起着连接调控作用,但具体过程仍是未知。综上所述,在OA 中平衡BMP 与WNT 活性有利于维持关节软骨的稳态作用,有助于OA 的缓解。
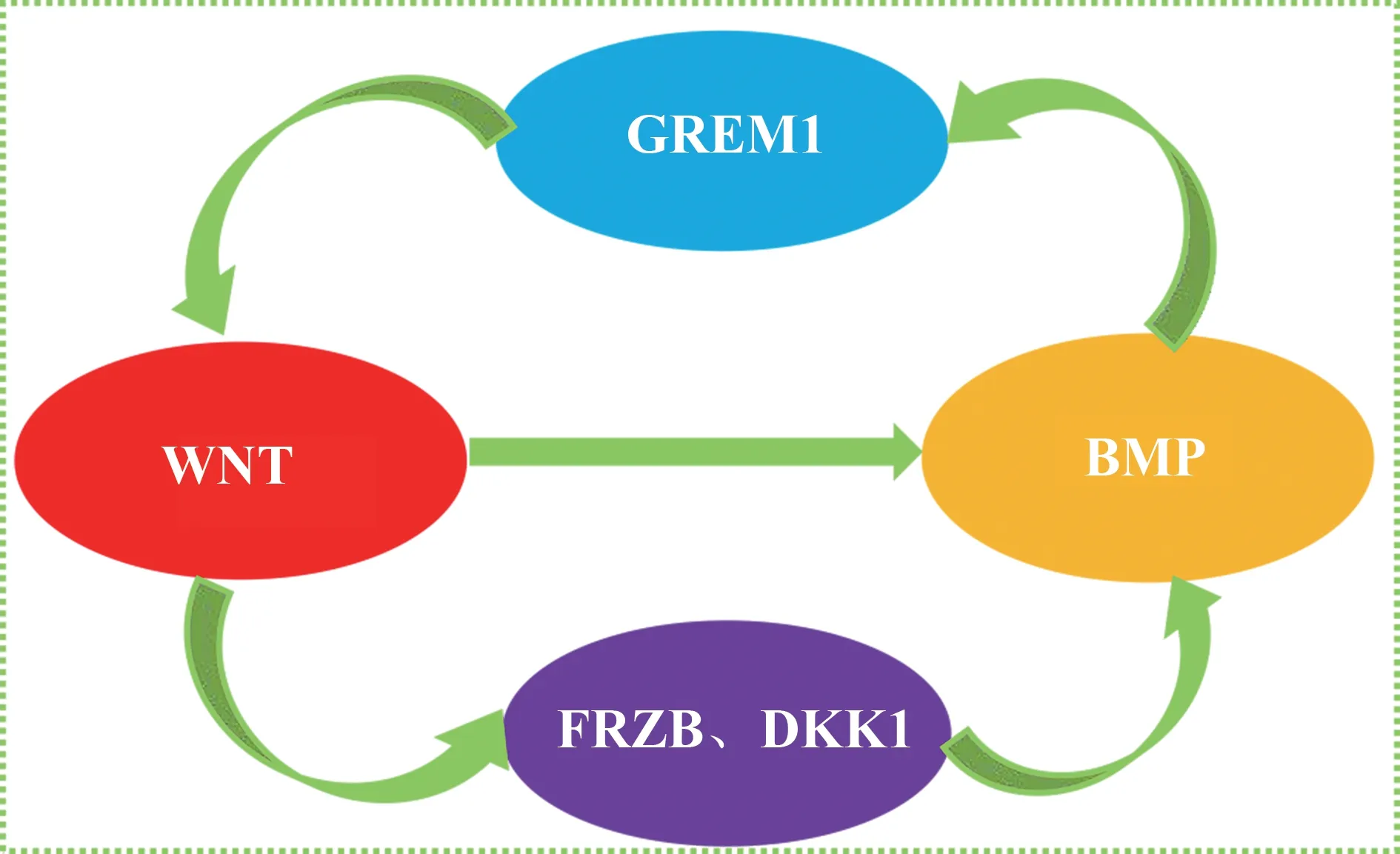
图2 BMP 与Wnt 信号相互作用过程Fig 2 BMP and Wnt signal interaction process
3.2 Grem-1 介导NF-κ B 信号通路在OA 中的作用
核因子-κB(NF-κB)是一种参与各种生物过程的多功能转录因子,在各种因素刺激下,将激活NF-κB 分子,从而触发一系列基因的表达,诱导关节的破坏,导致OA 的进程[35]。值得注意的是,NF-κB 信号的调节对机械负载有一定的响应,正常生理负荷对软骨是具有保护作用,而过度负载可能会通过相关信号通路介导OA 的形成。同时相关研究 也 证 实 了 过 度 机 械 载 荷 可 激 活 的RAC1-ROS-NF-κB 通路,而Grem-1 在过度机械载荷激活Rac1-ROS-NF-κB 轴后发生大量转录[36],值得注意的是,Grem-1 又可进一步激活NF-κB 诱导分解代谢酶产生,如Mmp13 和Adamts5,从而导致了软骨发生破坏[37],此外,Grem-1 也能够抑制BMP/Smad 通路而加重了OA 进程(见图3),因此,中和体内Grem-1 或者致使相关途径抗体遗传缺失对OA 的预防与缓解有巨大的作用,同时,靶向NF-κB 信号传导分子也可作为OA 新的潜在治疗选择,并可降低机械载荷引起潜在的OA 风险。
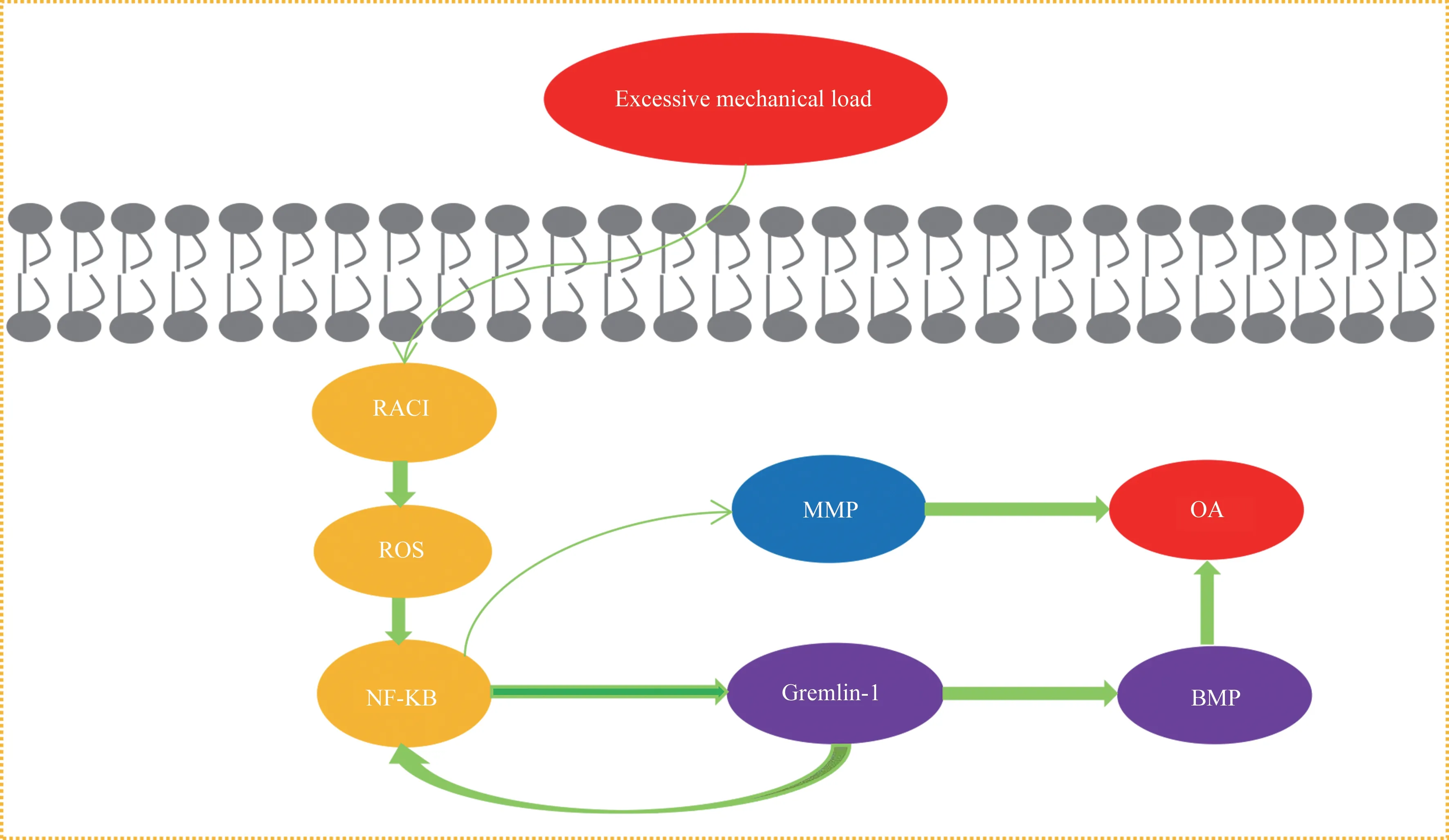
图3 过度机械载荷激活Rac1-ROS-NF-κB 轴致使Gremlin-1 转录影响OA 过程Fig 3 Excessive mechanical loading activates the Rac1-ROS-NF-κB axis causing Gremlin-1 transcription to affect the OA process
4 讨论
Grem-1 在OA 发展的过程具有极大的作用,但Grem-1 在骨与关节领域研究相对较少,许多机制尚未明确。然而,相关研究证实的是 Grem-1 可以促使关节软骨的损伤以及破坏,据了解,Grem-1 在正常的软骨中也处于一个高度集中表达的状态,也有研究证实其在正常人中维持软骨末端肥厚分化以防止OA 形成具有极大的意义[38],因此,是否会在OA 的加重过程中通过某种机制促使Grem-1 高表达从而负反馈调节OA 呢?此外,Grem-1 还参与了MSC 的代谢以及成骨分化过程,并通过抑制其分化,致使OA 的进一步恶化。而值得注意的是,软骨形成和软骨内骨化是一个极为复杂的过程,涉及许多不同类型的刺激和抑制情况出现,而由Grem-1 参与的BMP/Smad 信号传导在此领域也取得了实质性的进展,但仍有许多有待进一步了解。同时,Grem-1 还参与Wnt/b-连环蛋白以及NF-κB 信号途径,这两条途径也是十分复杂的,由Grem-1 介导的信号机制过程还有许多需要研究探讨的空间,未来对研发相关分子以及蛋白有重要的作用,并且可能成为治疗OA 的新方向,最后,由于Grem-1 在OA的病理过程中具有较强的调控作用,将来有望成为OA 早期诊断标志物以及治疗的靶点。
5 结语
本文综述了 Grem-1 如何影响人类骨性关节炎的发生、发展,进一步揭示了Grem-1 介导BMP/Smad 通路干扰了MSC 代谢和成骨分化具体过程,并阐明了Grem-1 参与相关信号通路在OA 发病过程中的作用,其中信号通路是一个复杂的网络,而信号分子的下游信号激活可引发OA 效应。因此,Grem-1 的表达影响骨性关节发生发展,通过深入对其研究同时也为临床治疗指明新方向。
作者贡献度说明:
周塏:主要进行文献查找,翻阅,记录,写作等工作。王广积:文章整体把控,文章内容审校。杜秀藩、杨城阔:课题组成员,提供所在领域文献和相关领域修改意见。
所有作者声明不存在利益冲突关系。

