铜藻岩藻多糖匀浆提取工艺及抗氧化活性分析
蔡树芸,骆春萍,许敏,何袅袅,黄雅瑜,林米妮,张怡评,,4
(1.福建中医药大学药学院,福建 福州 350108;2.自然资源部第三海洋研究所海洋生物资源开发利用工程技术创新中心,福建 厦门 361005;3.厦门海洋职业技术学院海洋生物学院,福建 厦门 361100;4.福建省海岛资源生态监测与保护利用重点实验室,福建 福州 350400)
铜藻(Sargassumhorneri),又名柱囊马尾藻、草茜、海柳麦等,隶属于褐藻门墨角藻目马尾藻科马尾藻属,是马尾藻属中个体较大的可食用大型褐藻[1],通常长度可达2~7 m。《新华本草纲要》中记载了福建民间以铜藻作中药“海藻”药用,其味咸、性寒,归肺肝经。它具有消痰软坚、清热利水的功效,可用于治疗瘿瘤、瘰疬、水肿、甲状腺肿以及淋巴结肿等疾病[2]。铜藻主要分布于我国辽宁半岛、山东半岛、浙江、福建和广东沿岸等[3]。近年来水温升高且海洋富营养化,导致铜藻的产量增加[4]。铜藻富含多糖、多酚、岩藻黄质、植物甾醇及蛋白质等多种生物活性物质[5-7],具有良好的经济利用价值。铜藻岩藻多糖(fucoidan)是铜藻中主要的活性成分,其具有抗氧化、抗病毒、降血糖、抗凝血和降尿酸等多种药理作用[8-14],在医药、保健食品、食品及饲料等领域应用广泛[15-17]。目前,关于多糖的提取研究主要集中于传统的热水浸提,但提取效率较低,因此寻找合适的提取工艺具有重要意义。
匀浆提取法是加入溶剂利用匀浆机将组织进行粉碎或磨浆,使目标成分加快溶出的一种方法,该方法提取速度快、效率高且能耗低[18-20]。本实验以铜藻为原材料,采用匀浆法提取铜藻岩藻多糖,在单因素试验基础上结合响应面优化试验(RSM)优化岩藻多糖提取工艺,并对其抗氧化活性进行研究,为铜藻岩藻多糖的工业化生产以及开发利用提供理论依据。
1 仪器与材料
1.1 仪器DGG-9030A电热恒温鼓风干燥箱(上海森信实验仪器有限公司);UH5300紫外分光光度计(上海光谱仪器有限公司);BCE124-1CCN电子天平[赛多利斯科学仪器(北京)有限公司];DFT-200A粉碎机(温岭市林大机械有限公司);电热恒温水浴锅(巩义市予华仪器有限责任公司);Alpha-Pure15纯水系统(精艺兴业科技有限公司);H1650离心机(湖南湘仪实验仪器开发有限公司);QC-901涡旋振荡器(海门市其林贝尔仪器制造有限公司);Multiskan SkyHigh全波长酶标仪(赛默飞世尔科技公司)。
1.2 材料铜藻由福建远扬藻业有限公司提供。将铜藻洗净,除去泥沙和杂质,沥干水分,烘干,粉碎过50目筛,备用。
L-岩藻糖(Fuc,批号:20180809,自然资源部第三海洋研究所);苯酚[生工生物工程(上海)股份有限公司];四硼酸钠(索莱宝科技有限公司);1,1-二苯基-2-三硝基苯肼(DPPH)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)、过硫酸钾[上海麦克林生化科技有限公司];浓硫酸、浓盐酸、咔唑、抗坏血酸(VC)、二水磷酸二氢钠、十二水磷酸氢二钠、水杨酸、硫酸亚铁、过氧化氢(国药集团化学试剂有限公司)。
2 方法
2.1 铜藻岩藻多糖匀浆提取工艺优化
2.1.1 铜藻岩藻多糖的提取取1.0 g铜藻粉末,加入适量的水,固定匀浆转速,水浴提取一段时间后,冷却,10 000 r·min-1离心5 min,弃沉淀,上清液过滤,将过滤液定容至相同体积。采用苯酚-硫酸法[21]测定岩藻多糖含量。
2.1.2 标准曲线绘制及多糖含量测定标准曲线绘制:精密称取L-岩藻糖标准品5.0 mg于25 mL容量瓶中,加水溶解并稀释至刻度,配成200 μg·mL-1L-岩藻糖标准品溶液。分别吸取0、0.2、0.4、0.6、0.8、1.0 mL L-岩藻糖标准品溶液于15 mL离心管中,加水补足至1.0 mL,依次加入5%苯酚1.0 mL和5.0 mL浓硫酸,涡旋混匀后,30 ℃水浴静置20 min。于490 nm处测定吸光度,以L-岩藻糖的浓度C(μg·mL-1)为横坐标,吸光度(A)为纵坐标,绘制标准曲线,得线性方程。
样品溶液的制备:将定容后的上清液取100 μL,置于离心管中,加水补足至1.0 mL,加入5%苯酚1.0 mL和5.0 mL浓硫酸,涡旋混匀后,30 ℃水浴静置20 min。于490 nm处测定吸光度,根据公式(1)计算岩藻多糖提取率。

(1)
C:L-岩藻糖含量测定标准曲线对应的回归方程计算所得的浓度值,μg·mL-1;V:上清液定容的体积,mL;N:稀释倍数;m:铜藻粉末质量,g。
2.1.3 单因素试验每次只变动一个条件,其他条件不变,考察因素提取时间(1、3、5、7、9 min)、液料比(20、30、40、50、60 mL·g-1)、提取温度(60、70、80、90、100 ℃)、提取次数(1、2、3、4、5)对岩藻多糖提取率的影响。
2.1.4 响应面优化设计在单因素试验结果的基础上,根据响应面Box-Behnken试验设计原理,设定提取时间(A)、提取温度(B)和液料比(C)这3个因素,以岩藻多糖的提取率为考察指标,对匀浆提取铜藻岩藻多糖的工艺参数进行优化。
2.2 铜藻岩藻多糖样品的制备采用优化的最佳工艺提取铜藻岩藻多糖,加入无水乙醇使提取液乙醇浓度达到30%,静置1 h,10 000 r·min-1离心5 min,弃沉淀除去褐藻胶,再继续加入无水乙醇使浓度达到80%,静置24 h,10 000 r·min-1离心5 min,收集沉淀,用无水乙醇洗涤沉淀2次,真空干燥得岩藻多糖(WSHFuc)。
2.3 铜藻岩藻多糖主要成分分析
2.3.1 多糖含量检测精密称取5.0 mg岩藻多糖,配制成0.1 mg·mL-1的多糖溶液,取1.0 mL置于离心管中,加入5%苯酚1.0 mL和5.0 mL浓硫酸,涡旋混匀后,30 ℃水浴反应20 min。于490 nm处测定吸光度,根据“2.1.2”项下方法得到的线性方程计算岩藻多糖的含量。
2.3.2 糖醛酸含量检测采用咔唑-硫酸法[22]对多糖中糖醛酸含量进行测定。以半乳糖醛酸为标准品,分别取0.2、0.4、0.6、0.8、1.0 mL的半乳糖醛酸标准溶液,用水补足至1.0 mL,冰水浴5 min;分别加入5.0 mL四硼酸钠-浓硫酸溶液,涡旋混匀,沸水浴15 min,取出后置于冰水浴中冷却;再分别加入0.2 mL 咔唑-无水乙醇溶液,涡旋混匀,沸水浴10 min,冰浴冷却,于530 nm处测定吸光度值;以半乳糖醛酸标准溶液浓度为横坐标,530 nm吸光度A为纵坐标,绘制标准曲线。取样品溶液1.0 mL代替标准液测吸光度值,根据标准曲线可计算样品中糖醛酸含量。
2.3.3 岩藻糖含量检测准确称取岩藻多糖样品10 mg于10 mL 试管中,加入2.0 mL水,再加入0.6 mL浓盐酸,置于沸水浴中水解3 h,冷却至室温后用水定容至10 mL,采用离子色谱检测[23]。
2.4 铜藻岩藻多糖体外抗氧化活性研究
2.4.1 DPPH自由基清除活性参考李德龙等[24]方法取不同质量浓度的铜藻岩藻多糖溶液200 μL,加200 μL 0.05 mg·mL-1DPPH乙醇溶液,样品对照用无水乙醇代替DPPH乙醇溶液,空白对照用同体积超纯水代替多糖样品,以VC作阳性对照,混匀后避光反应30 min,于517 nm处测吸光度,清除率按照公式(2)计算。
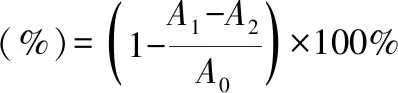
(2)
A0:空白对照吸光度;A1:反应后溶液的吸光度;A2:样品对照的吸光度。
2.4.2 ABTS+自由基清除活性取相同体积的ABTS溶剂(7.0 mmol·L-1)和过硫酸钾溶液(2.45 mmol·L-1)混匀,置于暗处避光12 h,备用。于734 nm处将工作液的吸光值用磷酸盐缓冲液PBS稀释调整为0.7±0.02。分别吸取100 μL不同浓度多糖溶液与1 mL ABTS+工作液混匀,室温避光静置10 min,测定734 nm处的吸光值[25],清除率按照公式(3)计算。
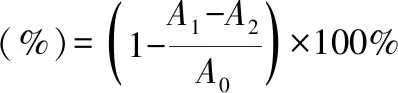
(3)
A0:用超纯水代替多糖溶液的吸光度;A1:反应后溶液的吸光度;A2:样品对照的吸光度。
2.4.3 羟自由基清除活性参考于靓等[26]的方法分别取200 μL不同浓度的多糖溶液,加入6.0 mmol·L-1硫酸亚铁、6.0 mmol·L-1水杨酸乙醇溶液和6.0 mmol·L-1过氧化氢溶液各200 μL,加水定容至2 mL混合均匀,37 ℃水浴30 min,冷却至室温后在510 nm测定吸光度,样品对照组用蒸馏水代替过氧化氢溶液,空白组用蒸馏水代替样品,以VC作阳性对照,清除率按照公式(4)计算。
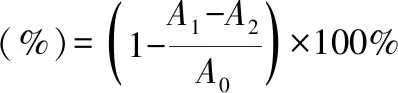
(4)
A0:空白组用超纯水代替多糖溶液的吸光度;A1:反应后溶液的吸光度;A2:样品对照用超纯水代替过氧化氢溶液的吸光度。
3 结果与分析
3.1 单因素试验
3.1.1 提取时间对铜藻岩藻多糖的影响在水浴温度为60 ℃,液料比30 mL·g-1,提取次数为1次条件下,研究提取时间1、3、5、7、9 min对岩藻多糖提取率的影响。结果显示,随着匀浆时间的延长,岩藻多糖提取率逐渐增加,在5 min时达最高,随后开始下降,其原因可能是匀浆时间过长,其他成分也一并溶出,导致岩藻多糖提取率降低。因此,选择5 min为最佳匀浆时间。
3.1.2 提取温度对铜藻岩藻多糖的影响在提取时间为5 min,液料比30 mL·g-1,提取次数为1次条件下,研究提取温度60、70、80、90、100 ℃对岩藻多糖提取率的影响。结果显示,随着提取温度的升高,岩藻多糖提取率逐渐增加,在90 ℃时达最高,随后开始下降,其原因可能是过高的热效应会造成部分多糖分解,导致岩藻多糖提取率降低。因此,选择90 ℃为最佳提取温度。
3.1.3 液料比对铜藻岩藻多糖的影响在提取时间为5 min,提取温度为90 ℃,提取次数为1次条件下,研究液料比20、30、40、50、60 mL·g-1对岩藻多糖提取率的影响。结果显示,随着液料比的增加,岩藻多糖提取率逐渐增加,在30 mL·g-1时达最高,当溶剂用量继续增加时,提取率反而下降,其原因可能是其他物质溶出,抑制了多糖的溶出,导致岩藻多糖提取率降低。因此,选择30 mL·g-1为最佳液料比。
3.1.4 提取次数对铜藻岩藻多糖的影响在提取时间为5 min,提取温度为90 ℃,液料比30 mL·g-1条件下,研究提取次数1、2、3、4、5次对岩藻多糖提取率的影响。结果显示,随着匀浆提取次数增多,多糖溶出量越多,但提取次数不断增加,不利于后续的浓缩分离,增加生产成本。因此,确定匀浆提取次数为2次。
3.2 响应面优化试验
3.2.1 岩藻多糖提取因素水平根据上述单因素试验结果,选取提取时间(A)、提取温度(B)、液料比(C)3个因素,以岩藻多糖提取率作为响应值指标,在Design Expert 12软件中设计3因素3水平响应面优化试验,如表1所示。
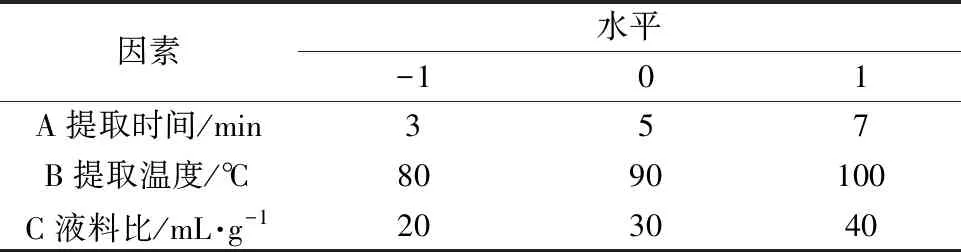
表1 响应面试验因素水平表
3.2.2 响应面试验结果每个因素各3个水平,共17个试验点,按照得到的试验条件对铜藻进行提取,并利用软件 Design Expert 12对数据进行回归分析,结果如表2所示。
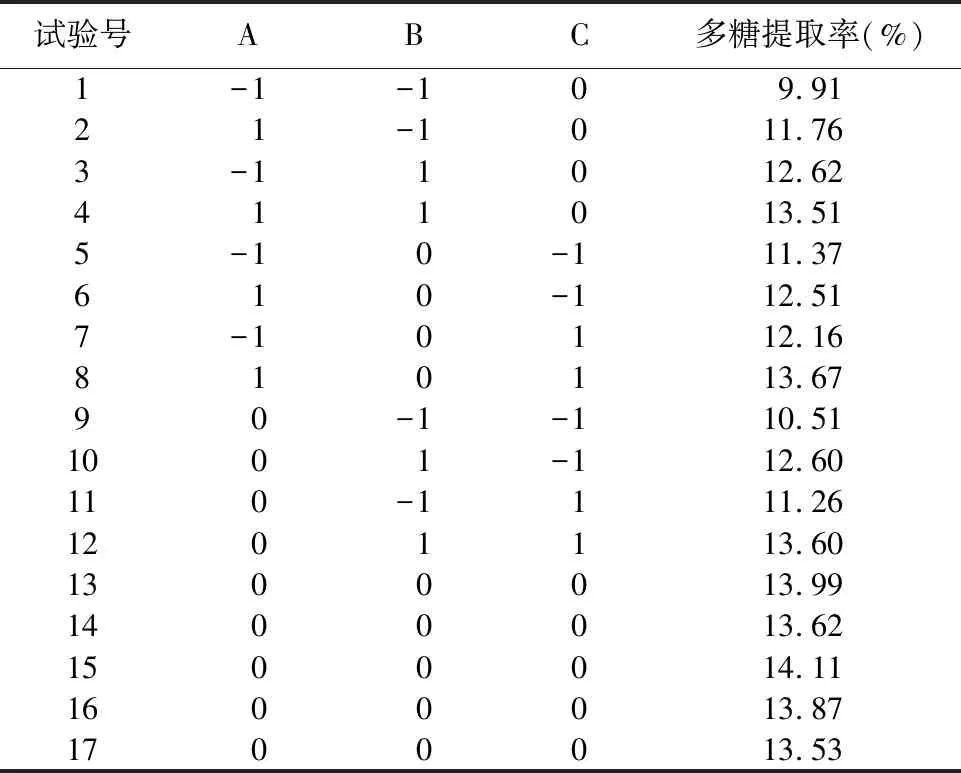
表2 响应面试验方案及结果
采用多元线性回归拟合铜藻岩藻多糖提取的响应值,得到了提取时间(A)、提取温度(B)、液料比(C)和多糖提取率的二次多项式回归方程为:Y=13.82+0.673 7A+1.11B+0.462 0C-0.241 8AB+0.094 5AC+0.061 3BC-0.721 5A2-1.15B2-0.675 1C2。
显著性系数和结果方差分析的结果如表3所示,可以看出模型P<0.01,说明该模型极显著,具有可靠性。失拟项P>0.05,说明模型有较好的拟合度,实际值与预测值相差不大,具有较高的可信度。相关系数R2=0.990 6,进一步表明试验值与模型预测值拟合度高。根据F值可得,这3个因素中,各因素对岩藻多糖提取率的影响为:提取温度(B)=提取时间(A)>液料比(C),说明提取时间和提取温度对多糖的提取影响极显著,液料比对其提取率的影响相对较小。因素A和因素B的交互作用对结果影响最大。
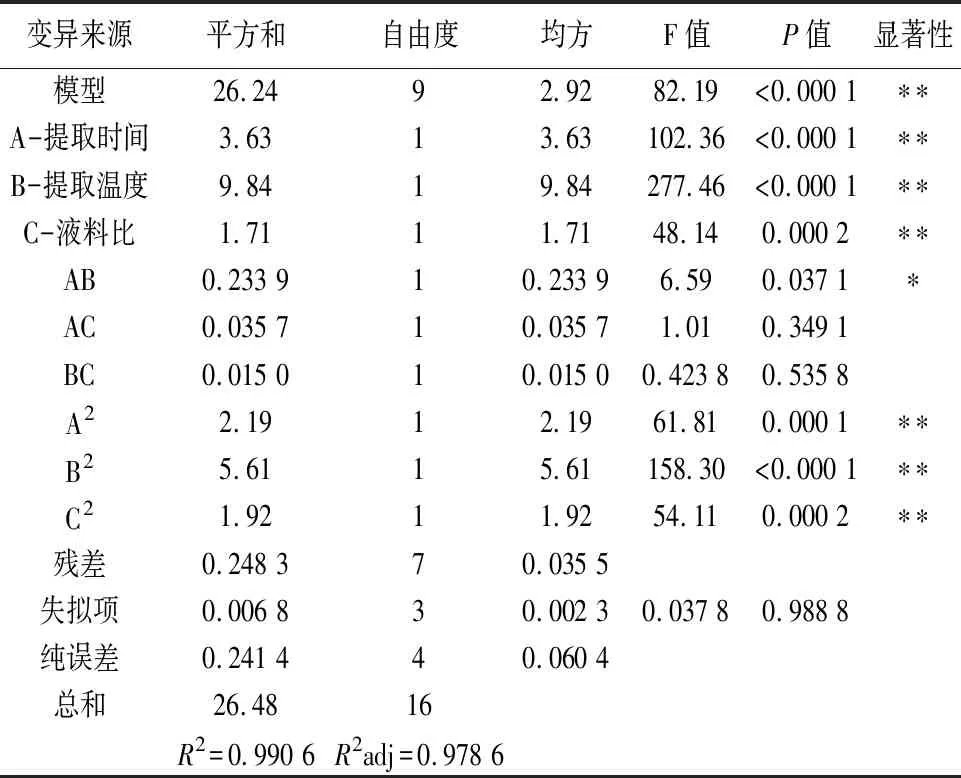
表3 响应面结果方差分析表
采用软件Design Expert 12绘制了响应面3D图和等高线图,更直观的反映试验结果并对其进行分析,研究各因素之间的交互作用对因变量(岩藻多糖提取率)的影响,如图1~3所示。
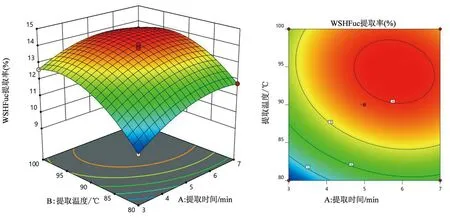
图1 提取时间与提取温度相互作用对岩藻多糖提取率影响的响应面图和等高线图
各因素两两交互作用的显著性可以通过观察响应面图曲线的陡峭程度看出来,响应面的曲线越陡峭,说明显著性约大。由图可知,交互项对WSHFuc提取率的影响大小为:AB>AC>BC,其中AB交互项的影响显著。由图1可知提取温度的陡峭程度比提取时间的陡峭程度大,说明提取温度对岩藻多糖提取率的影响大于提取时间。图2中提取时间和液料比陡峭程度相差不多,说明两者对岩藻多糖提取率的影响区别不是很大。图3中提取温度比液料比的陡峭程度大,说明提取温度对岩藻多糖提取率的影响大于液料比。
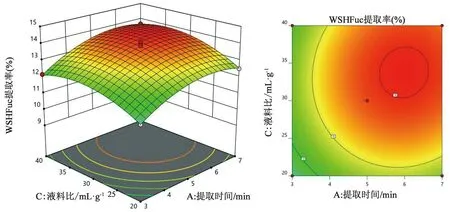
图2 提取时间与液料比相互作用对岩藻多糖提取率影响的响应面图和等高线图
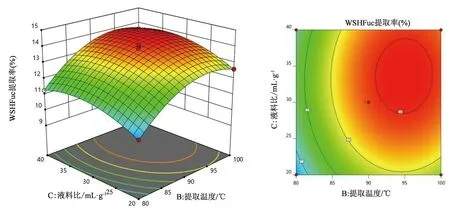
图3 提取温度与液料比相互作用对岩藻多糖提取率影响的响应面图和等高线图
3.2.3 最佳工艺的预测和验证通过软件Design Expert 12预测得到最佳工艺为:提取时间为5.833 min,提取温度94.463 ℃,液料比为33.897 mL·g-1,该条件下模型预测的最高多糖提取率为14.303%。考虑到实验条件,将提取工艺参数调整为提取时间为6 min,提取温度94 ℃,液料比为34 mL·g-1,提取次数2次,该条件下对铜藻进行提取,实际测得岩藻多糖的平均提取为14.76%,RSD<5%,与预测值相差不大。因此,本次试验基于响应曲面法所得到的优化提取工艺参数准确可靠,具有实用价值。
3.3 铜藻岩藻多糖主要成分不同的提取方法会影响多糖的组成成分,匀浆法提取的铜藻岩藻多糖中多糖含量为77.45%,糖醛酸含量为19.18%,岩藻糖含量为7.57%。
3.4 体外抗氧化活性研究
3.4.1 DPPH自由基清除活性结果表明,在0.2~1.0 mg·mL-1浓度范围内,WSHFuc具有良好的DPPH清除活性,与多糖浓度呈正相关,其IC50值为0.22 mg·mL-1,虽然多糖的清除能力低于VC,但岩藻多糖有较好的DPPH自由基清除活性。
3.4.2 ABTS+自由基清除活性在0.2~1.0 mg·mL-1浓度范围内,WSHFuc对ABTS+的清除率随着浓度的增加而升高,其IC50值为0.41 mg·mL-1,虽然岩藻多糖对ABTS+的清除能力低于VC,但岩藻多糖仍有较好的ABTS+自由基清除活性。
3.4.3 ·OH清除活性在0.5~2.5 mg·mL-1浓度范围内,WSHFuc对·OH的清除率随着浓度的增加而升高,岩藻多糖对·OH有一定的清除活性,但清除能力低于VC。
4 讨论与结论
岩藻多糖是一种天然多糖混合物,其化学结构复杂,主要成分包括L-岩藻糖和硫酸基团,还存在少量蛋白质及糖醛酸等[27]。匀浆可以使物料的粒径减小,使多糖加快溶出,与传统的热水浸提相比,大大缩短提取时间。本研究以铜藻为研究对象,在单因素基础上,采用响应面设计优化匀浆辅助铜藻岩藻多糖的提取工艺,探究提取时间(A)、提取温度(B)、液料比(C)对铜藻岩藻多糖提取率的影响。结果表明,影响岩藻多糖提取率的因素的顺序为:提取温度(B)=提取时间(A)>液料比(C),得到多糖的最佳提取条件为:为提取时间为6 min,提取温度94 ℃,液料比为34 mL·g-1,提取次数2次,岩藻多糖的提取率为14.76%,该工艺可以提高铜藻多糖的提取率。
代谢过程中会产生各种氧自由基,H2O2和·OH基等活性氧会对细胞和组织造成损伤,导致衰老或者疾病的发生,清除自由基可以预防氧化的加剧。有研究表明岩藻多糖有着良好的抗氧化活性,为天然抗氧化剂[28-30]。Lou等[31]从马尾藻中分离纯化出一种新型的多糖STSP-I,具有较强清除自由基的作用。本文研究铜藻岩藻多糖对DPPH、ABTS+、·OH的清除率,实验结果表明在多糖浓度达到1.0 mg·mL-1时,岩藻多糖对DPPH、ABTS+自由基的清除率与VC接近,说明其具有良好抗氧化活性,为铜藻岩藻多糖进一步研究和应用提供参考依据。

