中药山药及其伪品主要化学成分比较分析
金一宝,佟月,陈佳佳,王麓,殷果
(1.深圳市药品检验研究院,国家药品监督管理局中药质量研究与评价重点实验室,深圳市药品质量标准研究重点实验室,广东 深圳 518057;2.沈阳药科大学,辽宁 沈阳 110016;3.广州中医药大学,广东 广州 510006)
山药(Chinese yam)为薯蓣科植物薯蓣(DioscoreaoppositaThunb.)的干燥根茎[1]。山药始载于《神农本草经》,将其列为上品,云“署豫,味甘,温。主伤中,补虚嬴,除寒热邪气,补中,益气力,长肌肉。”[2]在宋代以前山药多采用野生品,产地较分散,山西、河南、山东、江苏、湖北等地均有分布,其中评价出“产佳”或“产良”的产地,各种本草说法不一[3]。直至明清的《救荒本草》中首次指出山药“怀孟间产者入药最佳”,且入药以栽培品为主[4]。山药有很高药用价值,包括淀粉、黏液多糖、蛋白质和氨基酸、微量元素、甾体皂苷、多酚等多种活性成分。其中山药多糖具有调节脾胃功能、抗衰老、抗氧化及免疫调节等作用[5-6]。
近年来,山药的市场需求不断增长,市场上亦混入了山药伪品,使药用市场流通的山药质量鱼龙混杂。薯蓣科中薯蓣属大约包含600种,种类丰富。历版《中国药典》均记载中药山药的基原植物为薯蓣。但实际上除薯蓣外,市场上存在多种不同基原的山药,如:淮山药(参薯,DioscoreaalataL.)、广山药(褐苞薯蓣,DioscoreapersimilisPrain et Burkill.)、野山药(日本薯蓣,DioscoreajaponicaThunb.)等,上述3种作为山药地方习用品,分别被浙江、广西、湖南、广东等地收录在地方中药材标准中。此外,中药山药的常见伪品木薯(ManihotesculentaCrantz.)、番薯(IpomoeabatatasLam.)等也在市场上广泛流通[7-8],导致了山药市场混乱。《中国药典》2020年版(一部)、《美国草药集》、《英国药典》2023 Ⅳ、《欧洲药典》11.0、《日本药局方》ⅩⅧ针对其鉴别分别采用显微鉴别和薄层鉴别法[1,9-12]。
本研究采用紫外分光光度计法测定不同来源的山药及其伪品的总多糖、总皂苷、总黄酮和总酚等化学成分的含量并进行主成分分析,以此来鉴定和筛选优良的山药资源,为山药种植资源开发利用提供理论基础。
1 材料
1.1 样品收集43批样品,其中包括28批中药山药(DioscoreaoppositaThunb.)和15批伪品。其中伪品包括同属的参薯(DioscoreaalataL.)、褐苞薯蓣(DioscoreapersimilisPrain et Burkill.)和日本薯蓣(DioscoreajaponicaThunb.),及不同属的木薯(ManihotesculentaCrantz)和番薯[Ipomoeabatatas(L.) Lamarck.]。所有样品均经中国食品药品检定研究院原中药标本馆馆长张继主任药师鉴定。样品来源信息见表1。其中原药材参考《中国药典》2020年版(一部)[1],原药材去皮切片后置于60 ℃恒温干燥箱内烘干,粉碎,过五号筛,置于密封袋中,25 ℃条件下密封保存,备用。
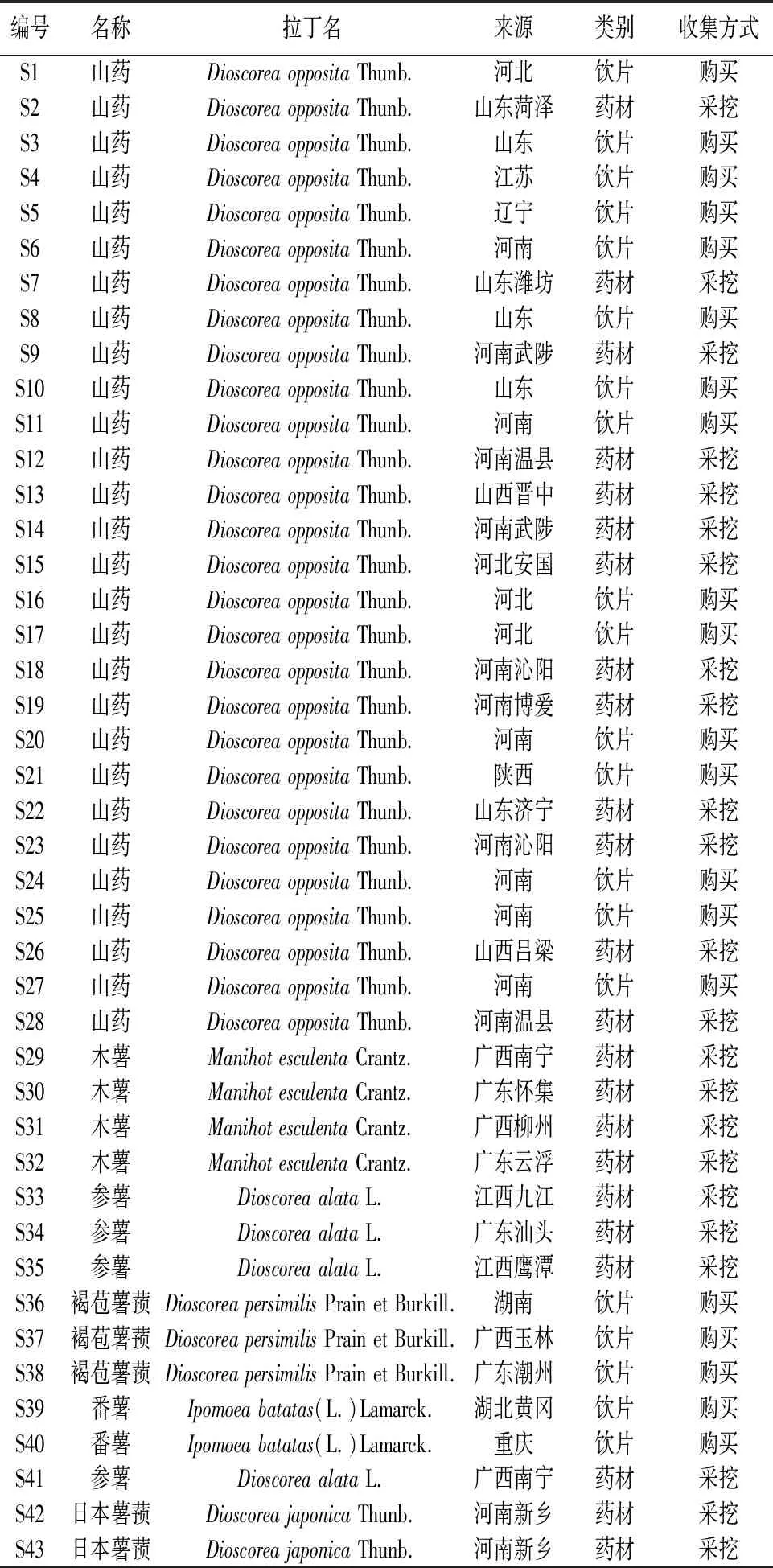
表1 43批中药山药及伪品样品信息表
1.2 仪器与试剂UV-2450型紫外-可见分光光度计(日本岛津公司);TC-15套式恒温器(海宁市新华医疗器械厂);SB26-12DT型超声仪(宁波新芝生物科技股份有限公司);DL-5-B低速大容量离心机(上海安亭科学仪器厂);TW20水浴锅(优莱博技术北京有限公司);Milli-Q Academic纯水器(美国密理博公司);MS-204S分析天平(瑞士梅特勒-托利多集团)。
无水葡萄糖(批号:110833-201908,中国食品药品检定研究院);薯蓣皂苷元(批号:111539-200001,中国食品药品检定研究院);芦丁(批号:20121022,国药集团化学试剂有限公司);没食子酸(批号:K1216026,美国Sigma-Aldich公司) 。硫酸、盐酸、高氯酸、乙醇、石油醚(沸程60~90 ℃)、正丁醇、冰醋酸(分析纯,广州化学试剂厂);硝酸铝、亚硝酸钠、福林酚、碳酸钠、氢氧化钠、苯酚、甲醇、香草醛(分析纯,上海阿拉丁生化科技股份有限公司)。
2 方法
2.1 山药多糖含量的测定
2.1.1 葡萄糖对照品溶液的制备取无水葡萄糖对照品适量,精密称定,加水制成0.1 mg·mL-1的葡萄糖对照品溶液。精密量取葡萄糖对照品溶液0.2、0.4、0.6、0.8、1.0 mL,置具塞试管中,加水补至2.0 mL,按测定方法操作用于绘制标准曲线。
2.1.2 供试品溶液的制备取中药山药样品粉末约0.1 g,精密称定,置圆底烧瓶中,加80%乙醇100 mL,加热回流1 h,趁热过滤,滤渣与滤器用热80%乙醇溶液30 mL,分次洗涤,滤渣连同滤纸置烧瓶中,加水150 mL,加热回流2 h,趁热过滤,用少量热水洗涤滤器,合并滤液与洗液,放冷,移至250 mL量瓶中,加水至刻度,摇匀,备用。
2.1.3 测定方法精密量取一定量供试品溶液,因样品存在较大差异,选择0.5 mL或0.2 mL,使其测得吸光度在标准曲线范围内,置具塞试管中,加水补至2.0 mL,精密加入5%苯酚溶液1.0 mL,摇匀,迅速加入硫酸5.0 mL,摇匀,置40 ℃水浴中保温30 min,取出,置冰水浴中5 min,以水为空白溶液同法操作为空白样品,照紫外-可见分光光度法,在488 nm的波长处测定吸光度,计算总多糖的含量[12]。
2.2 山药总皂苷含量的测定
2.2.1 薯蓣皂苷元对照品溶液的制备精密称取薯蓣皂苷元标准品10.0 mg,置于50 mL量瓶中,甲醇溶解并稀释定容,摇匀,配制成浓度0.2 mg·mL-1的薯蓣皂苷元对照品溶液。精密量取薯蓣皂苷元对照品溶液0.2、0.4、0.8、1.2、1.6、2.0、2.4 mL于10 mL具塞试管中按测定方法操作用于绘制标准曲线。
2.2.2 供试品溶液的制备精密称取样品粉末2.0 g置于具塞锥形瓶,加入70%乙醇20 mL,超声提取60 min,提取2次,上层清液合并后过滤蒸干,残渣以2 mL蒸馏水溶解,转移至60 mL分液漏斗,加入石油醚萃取2次,每次10 mL,收集水层,合并水溶液加入水饱和正丁醇萃取3次,每次5 mL,收集正丁醇层于干燥蒸发皿中,挥干溶剂,残渣加入甲醇溶解,转移至10 mL量瓶,摇匀,以甲醇定容。
2.2.3 测定方法精密量取供试品溶液1.0 mL,置10 mL具塞试管中,加塞,于90 ℃水浴挥干溶剂,精密加入新鲜配制的5%香草醛-冰醋酸溶液0.2 mL,高氯酸0.8 mL,加塞,于60 ℃恒温水浴中反应显色15 min后置冷水浴至室温,精密加入冰醋酸5.0 mL,摇匀,静置15 min。以甲醇为空白溶液同法操作为空白样品,波长465 nm下测定吸光度,计算总皂苷的含量。
2.3 山药总黄酮含量的测定
2.3.1 对照品溶液的制备精密称取芦丁对照品10.0 mg,70%乙醇超声溶解后转移至10 mL量瓶定容备用。精密吸取芦丁标准品溶液0.2、0.4、0.6、0.8、1.0 mL,置于10 mL量瓶中按测定方法操作用于绘制标准曲线。
2.3.2 供试品溶液的制备精密称取山药粉末2.0 g,置于具塞锥形瓶中,加入70%乙醇溶液20 mL,超声提取30 min,5 000 r·min-1离心取上清,蒸干,用70%乙醇复溶并定容至2.0 mL量瓶中。
2.3.3 测定方法精密量取一定量供试品溶液(0.5 mL或0.2 mL),分别置10 mL量瓶中,依次加入5%亚硝酸钠溶液0.3 mL,摇匀,静置6 min,再加入10%硝酸铝溶液0.3 mL,摇匀,静置6 min,最后加入4%氢氧化钠试液2 mL,50%乙醇定容,静置15 min。以70%乙醇为空白溶液同法操作为空白样品,波长502 nm下测定吸光度,计算总黄酮的含量[13]。
2.4 山药总酚含量的测定
2.4.1 没食子酸对照品溶液的制备精密称定没食子酸标准品10 mg,置于100 mL量瓶中加50%乙醇定容。精密量取标准品溶液0.3、0.6、0.9、1.2、1.5、1.8 mL,分别置10 mL量瓶中按测定方法操作用于绘制标准曲线。
2.4.2 供试品溶液的制备精密称取山药粉末0.5 g,置于具塞锥形瓶中,精密加入20 mL 50%乙醇,超声30 min,放冷,离心,精密量取1 mL上清液置10 mL量瓶中。
2.4.3 测定方法精密吸取一定量待测样品提取液、没食子酸标准品溶液,分别置10 mL量瓶中,依次加水3 mL,摇匀,再加入福林酚试液B 0.5 mL,摇匀,0.5~8 min内加入20%碳酸钠溶液1.5 mL,加水至刻度,摇匀,在75 ℃水浴中放置10 min。以50%乙醇为空白溶液同法操作为空白样品,波长760 nm下测定吸光度,计算总多酚的含量[13]。
2.5 方法学考察以各不同浓度的对照品溶液按测定方法,绘制标准曲线。分别取葡萄糖对照品溶液、薯蓣皂苷元对照品溶液、芦丁对照品溶液和没食子酸对照品溶液1 mL各6份,按各自测定方法进行精密度验证,计算其RSD。取S1号样品6份,分别按照各自“供试品溶液的制备”,在上述试验条件下进样分析,以样品中各成分含量的RSD来评价其重复性。取已知含量的S1号样品,各成分平行6份分别加入与样品中各待测成分的量相当的对照品,按“供试溶液制备”进样测定,计算其回收率。以及取S1号样品的供试品溶液,0、2、4、6、8、10、12和24 h进样测定,以各成分含量的RSD考察其稳定性在室温放置的稳定性等,以确保方法的可靠。
2.6 统计学分析采用Ezinfo软件根据上述4种量值进行多元统计,以主成分分析(PCA)对变量进行降维并将其聚类,绘制主成分分类图。
3 结果与分析
3.1 方法学验证以各不同浓度的对照品溶液按测定方法,绘制标准曲线,得回归方程见表2,在各成分所示范围内线性关系良好。4类成分精密度RSD在0.10%~0.71%之间,精密度良好。重复性结果见表2,4类成分含量的RSD在1.0%~1.3%之间,重复性良好。回收率结果见表2。4类成分的回收率在96.8%~99.0% 之间,RSD在0.9%~1.3%之间,表明方法回收率良好。稳定性结果见表2,4类成分的RSD在0.7%~1.8%之间,表明供试品溶液在24 h内稳定性良好。

表2 4类成分含量测定方法学验证结果(n=6)
3.2 样品测定将28批中药山药(Dioscoreaopposita)和15批伪品(木薯Manihotesculenta、参薯Dioscoreaalata、褐苞薯蓣Dioscoreapersimilis、番薯Ipomoeabatatas、日本薯蓣Dioscoreajaponica),采用紫外-可见分光光度计测定吸光度,外标法计算其总多糖、总皂苷、总黄酮和总多酚的含量,结果见表3。
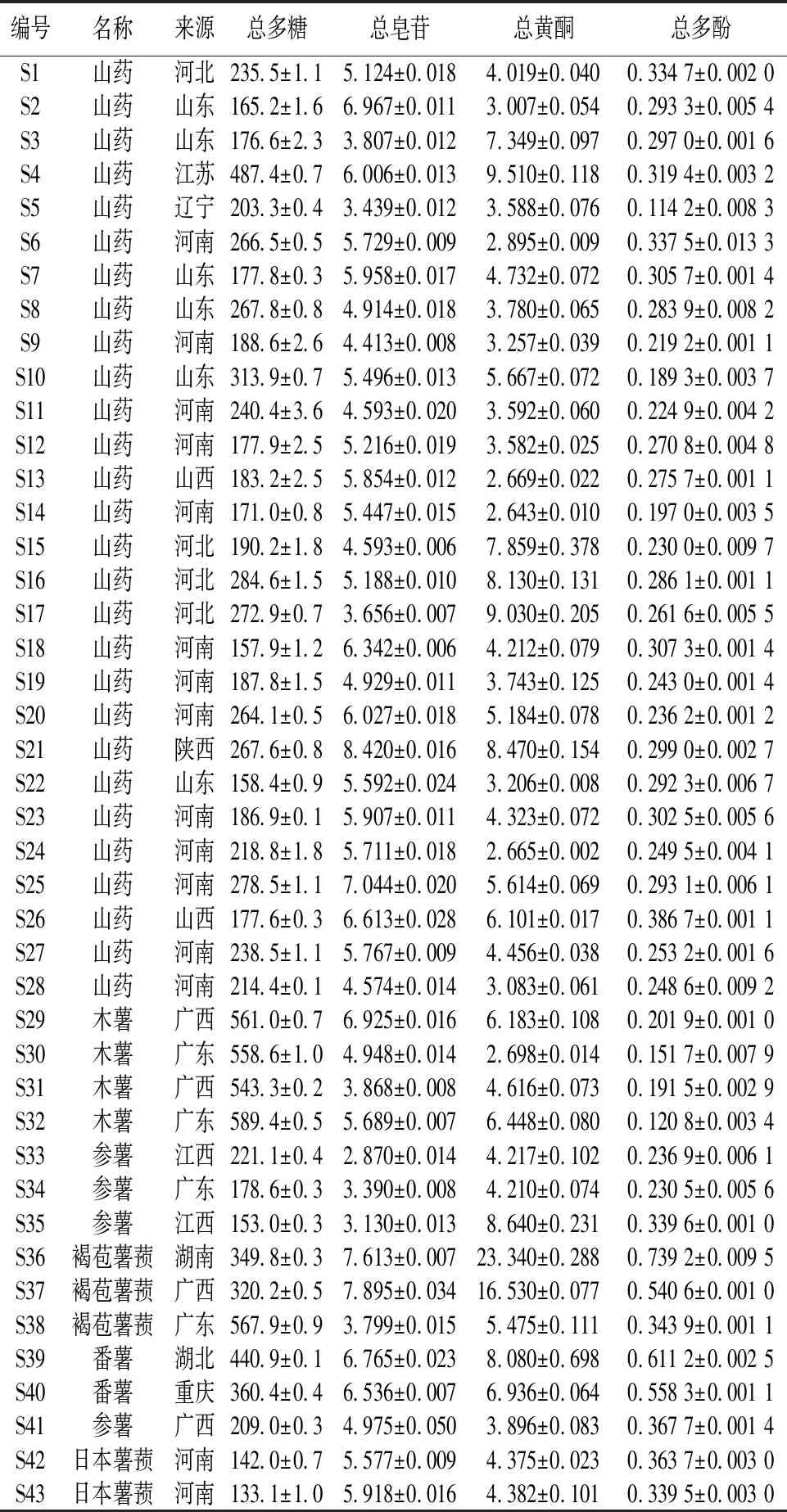
表3 43批样品中4种成分的测定结果(n=3,mg·g-1)
由表3可知,山药中含有丰富的多糖类成分,占比约为山药重量的20%(见图1A)。在所测定的4类成分中,占比超90%(见图1B)。山药及其为品种均含有4类活性成分,且总多糖含量最高。其中山药中平均含量达226.9 mg·g-1,其次为总皂苷(5.476 mg·g-1)和总黄酮(4.870 mg·g-1),总多酚(0.269 7 mg·g-1)平均含量最低。参薯中的总多糖含量略低(190.4 mg·g-1),总皂苷(3.591 mg·g-1)、总黄酮(5.240 mg·g-1)和总多酚(0.293 7 mg·g-1);日本薯蓣中的总多糖含量最低(137.6 mg·g-1),总皂苷(5.748 mg·g-1)、总黄酮(4.378 mg·g-1)和总多酚(0.351 6 mg·g-1),参薯和日本薯蓣与山药较为相似。而褐苞薯蓣的总多糖含量较高(412.6 mg·g-1)、总皂苷(5.748 mg·g-1)、总黄酮(15.11 mg·g-1)、总多酚(0.541 2 mg·g-1)均显著高于山药。其他科的伪品木薯总多糖含量最高(563.1 mg·g-1),总皂苷(5.358 mg·g-1)和总黄酮(4.986 mg·g-1)与山药相近,总多酚(0.166 5 mg·g-1)显著低于山药。另一伪品番薯总多糖含量较高(400.7 mg·g-1)、总皂苷(6.651 mg·g-1)、总黄酮(7.509 mg·g-1)、总多酚(0.584 7 mg·g-1)均显著高于山药。

A.4类成分含量;B.4类成分占比;C.山药及其伪品中总多糖含量;D.山药及其伪品中总皂苷含量;E.山药及其伪品中总黄酮含量;F.山药及其伪品中总多酚含量
3.3 山药及其伪品主成分分析采用主成分分析(PCA)的方法,基于4类成分对山药及其各类伪品进行比较。图2A 显示,山药与其伪品参薯、日本薯蓣、褐苞薯蓣、木薯、番薯的分类并不是非常明显,主要是因为产地为江苏的山药样品显示出了异常(图2A靠近“PC1”的那个样品)。由于江苏并非山药的主产区且仅有一个样品,不具备代表性,因此将其剔除,剔除后山药及其伪品各组之间明显分离(见图2B)。将所有伪品作为一组,山药作为另一组进行偏最小二乘分析(PLS-DA)的比较,同样可以发现山药和伪品之间的显著分离(见图2C),表明这两组的某些活性成分有显著差异。通过S-Plot和变量重要性图(见图2D~E),可知总多酚的含量对分类的贡献最大。因此,总多酚的含量可以作为区分山药及其伪品的一个重要指标。

A.山药及其伪品主成分分析;B.除江苏产地外,主成分分析;C.偏最小二乘分析;D.S-plot;E.变量重要性图
3.4 不同产地的山药主成分分析图2中,江苏产区的山药与其他地区的山药存在显著不同,提示需要考虑不同产地的山药成分是否存在差异。首先对山药的4种活性成分的含量进行比较,发现除江苏产地山药样品总多糖含量极高,其余3种成分的含量差异不显著(见图3A~B)。以4类成分的含量为变量对所有山药进行了主成分分析,结果显示,江苏产地的山药明显有别于主产区河南、河北、山东及非主产区山西、辽宁、陕西的山药(见图3C),也就是只有江苏的山药样品不同于其他产地的山药。当剔除江苏山药后,再次进行主成分分析,各产地的山药不能形成分类(见图3D),说明由于各产地山药的这4类活性成分中差异不大,推测其原因可能是由于山药已实现种植栽培、经品种优选后,药材品质已趋于统一。
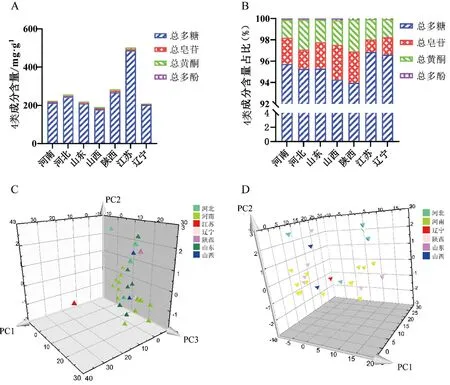
A.4类成分含量;B.4类成分占比;C.各产地主成分分析;D.除江苏产地外,其他产地主成分分析
4 讨论
研究结果显示,基于4类活性成分的含量可实现山药及其伪品各组之间的区分,并进一步得知总多酚的含量对分类的贡献最大。同时江苏产地的山药也因总多糖含量异常高而区别于其他产地的山药。多酚类成分在抗氧化、清除自由基、诱导细胞凋亡、抑制环氧化物酶、保护心脑血管、预防糖尿病等方面具有很强的作用已成为天然抗氧剂[14-15]。由于山药中的总多糖成分的含量占比极高,其主要成分为淀粉等多糖类成分,其中的抗性淀粉是其功能活性成分之一[16]。山药中活性皂苷类成分已被用作合成治疗冠心病的甾体激素和皂苷类药物的重要工业原料[17-18],而黄酮类化合物具有去除体内的氧自由基,同样作为天然的强抗氧化剂[19]。因此,提示总多酚、总多糖等活性成分含量是否可以作为山药质量研究的一个关键指标。《中国药典》2020年版(一部)[1]收载的山药质量标准仅规定了性状、显微鉴别、薄层鉴别(对照药材)、检查(水分、总灰分、二氧化硫残留量)、浸出物等项目,无含量测定项。此外,《美国草药集》、《英国药典》2023Ⅳ、《欧洲药典》11.0和《日本药局方》ⅩⅧ[9-12]同样未设立含量测定项。本试验建立了紫外分光光度法测定中药山药4类活性成分的含量测定方法,通过对活性成分总多糖及总皂苷、总黄酮和总多酚的提取条件的优化,考察了提取温度、时间、溶剂等,优化其显色条件及检测波长,建立的方法准确、可靠。通过山药中4类活性成分含量的分析,为以反映临床疗效的活性成分为控制指标的中药山药质量控制提供参考依据。
本试验建立了紫外分光光度法测定中药山药4类活性成分的含量测定方法,比较了中药山药及其伪品中总多糖、总皂苷、总黄酮和总多酚成分含量的差异并通过主成分分析(PCA)可实现山药正伪品的分类。同时对不同产地来源的山药进行比较,通过主成分分析发现各主产区之间成分含量相近,无显著品质差异。本研究为基于功效物质基础的山药质量控制以及山药种植资源的进一步开发利用提供科学依据。

