聚焦式低强度脉冲超声联合富血小板血浆局部注射修复大鼠面神经损伤效果观察
桑亚茹,张李娜,方莹,周平辉,韩跃峰
蚌埠医学院第一附属医院耳鼻咽喉头颈外科,安徽 蚌埠 233000
面神经是一种包含运动、感觉的复合神经,同时控制着面部表情肌、面部感觉以及腺体的分泌,在人类语言交流和非语言交流中具有重要作用[1]。尽管面神经损伤不会危及生命,但是其功能丧失会导致面部表情及吞咽功能障碍,不仅会影响患者的社会生活,也会对其精神健康产生重大影响[2]。目前,临床上对于面神经损伤多采取外科手术治疗和保守治疗,其中外科手术治疗可用性有限,且额外的手术干预可能会对面神经造成进一步损伤[3]。因此,面神经损伤的保守治疗对于损伤神经的恢复愈发重要[4]。目前,通过调控面神经损伤后周围的炎症免疫微环境来促进面神经修复逐渐成为面神经损伤保守治疗的研究重点。富血小板血浆(PRP)是自体血液经多次离心后获得的血小板浓缩物,血小板被激活后可以释放血小板衍生生长因子(PDGF)、胰岛素样生长因子1(IGF-1)、表皮生长因子(EGF)、血管内皮生长因子(VEGF)等多种生长因子,从而调控炎症免疫微环境,并促进细胞有丝分裂和组织再生[5-6]。聚焦式低强度脉冲超声(FLIPUS)是一种特定类型的超声,具有低强度输送并以脉冲波模式输出的特点,已被证明是一种可以用于治疗的非侵入性物理刺激[7]。但是,目前关于PRP局部注射联合FLIPUS对面神经损伤的修复作用尚未可知。为此,我们于2023年4月—5月进行了如下研究,为面神经损伤的保守治疗提供参考依据。
1 材料与方法
1.1 材料 实验动物:健康雄性SD大鼠28只,8周龄,体质量250 g;置于18~20 ℃恒温环境及12 h光/暗循环的清洁动物房内,按时给予充足的食物和水;本研究通过蚌埠医学院动物实验伦理委员会批准[伦动科批字(2022)第259号]。主要试剂及仪器:异氟烷吸入麻醉剂购自深圳瑞沃德生命科技有限公司,超声波治疗仪HANIL-TM HS-501购自韩国HANIL-TM公司,肌电诱发电位仪MEB-9404C购自日本光电公司,R500通用型小动物麻醉机购自深圳瑞沃德生命科技有限公司。
1.2 PRP制备 采用二次离心法。取健康雄性SD大鼠8只,吸入异氟烷诱导并维持麻醉,剃除前胸部毛发,消毒后常规采血针经心脏穿刺抽吸动脉血10 mL,处死大鼠。将全血合并到含有3.8%柠檬酸钠的试管中(血液∶ 柠檬酸钠为9∶ 1),取抗凝血液10 μL于玻璃试管中,加入血小板稀释剂90 μL,混匀后静置10 min,高倍镜下进行血小板计数。取剩余部分动脉血,室温下1 000 r/min离心15 min,使用移液管吸取上清液及交界面以下2 mm的全部液体至另一支离心管中;3 000 r/min离心10 min,获得贫血小板血浆(PPP)和含有血小板浓缩物的颗粒,吸出PPP后的溶液即为PRP。室温条件下将PRP在旋转平台上孵育30 min,以消除血小板结块;取PRP 10 μL于玻璃试管中,加入血小板稀释剂90 μL,混匀后静置10 min,高倍镜下进行血小板计数。每次制备的PRP均进行血小板计数,并与全血血小板计数进行比较,PRP中的血小板最终浓度约为全血血小板浓度的3倍或3倍以上才可用于后续实验。每1 mL PRP中加入10% CaCl2活化剂50 μL,混匀后37 ℃条件下孵育1 h,以产生活化的PRP;4 ℃条件下,4 000 r/min离心10 min,收集上清液,-20 ℃保存[8]。
1.3 面神经损伤模型建立及PRP、FLIPUS处理将20只健康雄性SD大鼠随机分为模型组、PRP组、FLIPUS组及PRP + FLIPUS组,每组5只。各组均建立右侧面神经损伤模型,方法如下:将大鼠吸入异氟烷麻醉诱导后,置于左侧卧位,剃除右侧面神经对应区域的毛发,碘伏消毒后沿耳后作一1.5 cm的弧形切口,逐层钝性分离颈部肌肉,识别斜方肌肌腱,进一步暴露右侧面神经主干,并进行钝性解剖[9];文氏钳钳夹右侧面神经主干30 s,并重复该步骤以覆盖远端部分,钳夹的面神经主干区域呈半透明,但面神经主干并未破裂;碘伏冲洗切口后,生理盐水冲洗2次,缝合切口;待大鼠苏醒后进行瞬目反射和胡须运动的行为学评估,以确保建模成功[10]。PRP组缝合切口前取PRP 50 μL浸渍受损面神经主干,然后缝合切口,并对神经损伤部位进行标记,其后采用局部注射的方法给予PRP 50 μL,2次/周。FLIPUS组在缝合切口并对神经损伤部位进行标记后,对面神经损伤处进行FLIPUS治疗10 min,1次/天,参数设置:脉冲占空比20%、频率1 MHz、功率密度300 mW/cm2。PRP + FLIPUS组参照上法给予PRP局部注射及FLIPUS治疗。模型组仅以特殊缝合标记面神经损伤部位,不予特殊处理。各组疗程均为28 d。
1.4 损伤面神经恢复的行为学观察 各组术后每周于固定时间由两名观察者独立进行行为学评估,包括胡须运动和瞬目反射[9]。胡须运动评分标准:胡须无运动且胡须位于后位为1分,胡须轻微颤抖且胡须位于后位为2分,胡须明显颤抖且胡须位于后位为3分,胡须正常运动但胡须位于后位为4分,胡须对称运动且胡须位于前位为5分。瞬目反射评分标准:无眨眼和闭眼为1分,眼轮匝肌收缩但无眨眼反射为2分,通过眨眼反射可以闭合50%的眼睛为3分,通过眨眼反射可以闭合75%的眼睛为4分,完全闭眼和存在眨眼反射为5分。行为学评分越高提示大鼠面神经功能恢复越好。
1.5 损伤面神经最大复合肌肉动作电位(CMAP)振幅测算 各组术前及术后第28天,使用肌电诱发电位仪行右侧面神经电生理检查。各组大鼠腹腔注射10%水合氯醛进行麻醉,将双极针记录电极插入大鼠触须肌垫,接地电极插入大鼠背部,双极刺激电极置于接近面神经从茎乳孔的出口点;对大鼠给予刺激时间为0.1 ms的刺激脉冲以产生CMAP,以达到最大CMAP振幅所需水平以上20%的电流进行输送,确定超分子刺激。在超分子刺激下记录波形,通过EMG软件记录超分子刺激下的最大CMAP振幅,计算R值。R值 = 术后最大CMAP振幅/术前最大CMAP振幅,最大CMAP振幅及R值越大越高提示面神经功能越好。各组大鼠右侧面神经电生理检查均由同一位专业人员独立操作,重复3次后取平均值[11]。
1.6 损伤面神经节段组织病理学观察 各组右侧面神经电生理检查结束后,均采用腹腔注射高剂量10%水合氯醛的方法处死。经原耳后切口再次进行切开,并逐层钝性分离颈部肌肉,暴露右侧面神经主干,取出从损伤部位到远端约0.6 cm的神经节段。标记神经节段的方向后,采用4%多聚甲醛固定,石蜡包埋,连续4 μm厚度切片。HE染色后,40倍光学显微镜下观察损伤面神经组织的神经束变性、脱髓鞘、轴突空泡化程度。每张切片随机选取10个不同部分的轴突,采用ImagePro Plus软件记录单位面积的轴突数量、直径及面积[12]。
1.7 统计学方法 采用SPSS23.0统计软件。计量资料采用S-W法检验正态性,呈正态分布以±s表示,多组间比较采用方差分析,两组间比较采用t检验,重复测量数据采用重复测量的方差分析;非正态分布以M(P25,P75)表示,两组间比较采用非参数检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠术后1~4周行为学评分比较 各组大鼠术后1~4周瞬目反射及胡须运动评分比较P均>0.05。见表1、2。行为学评分后各组大鼠均死亡1只,后续研究每组4只。

表1 各组大鼠术后1~4周瞬目反射评分比较[分,M(P25,P75)]
2.2 各组大鼠手术前后损伤面神经最大CMAP振幅及R值比较 与同组术前比较,各组大鼠术后损伤面神经的最大CMAP振幅均降低(P均<0.05)。与模型组比较,PRP组、FLIPUS组及PRP +FLIPUS组大鼠术后损伤面神经的最大CMAP振幅及R值均升高(P均<0.05),PRP组、FLIPUS组及PRP + FLIPUS组比较差异均无统计学意义(P均>0.05)。见表3、OSID码图1。
表3 各组大鼠手术前后损伤面神经最大CMAP振幅及R值比较[± s/M(P25,P75)]

表3 各组大鼠手术前后损伤面神经最大CMAP振幅及R值比较[± s/M(P25,P75)]
注:与模型组比较,*P<0.05。
组别模型组PRP组FLIPUS组PRP + FLIPUS组R值0.10 ± 0.05 0.29 ± 0.04*0.29 ± 0.03*0.31 ± 0.08*n4 4 4 4术前最大CMAP振幅(mV)9.50(5.78,10.00)7.50(7.29, 7.93)6.75(5.93, 8.54)7.72(6.87, 9.22)术后最大CMAP振幅(mV)0.65(0.58, 1.19)2.25(1.81, 2.44) *1.97(1.64, 2.59) *2.38(2.03, 2.67) *
2.3 各组大鼠损伤面神经节段组织病理情况比较 与模型组比较,PRP组、FLIPUS组及PRP +FLIPUS组神经束变性、脱髓鞘及轴突空泡化程度减轻,再生轴突增多且神经纤维排列更有序(OSID码图2)。与模型组比较,PRP组、FLIPUS组及PRP + FLIPUS组大鼠损伤面神经节段组织单位面积内的轴突数量均升高(P均<0.05),PRP组、FLIPUS组及PRP + FLIPUS组比较差异均无统计学意义(P均>0.05)。PRP组大鼠损伤面神经节段组织单位面积内的轴突直径、轴突面积均高于模型组、FLIPUS组、PRP + FLIPUS组(P均<0.05)。见表4。
表4 各组大鼠损伤面神经节段组织单位面积内的轴突数量、直径及面积比较[± s/M(P25,P75)]
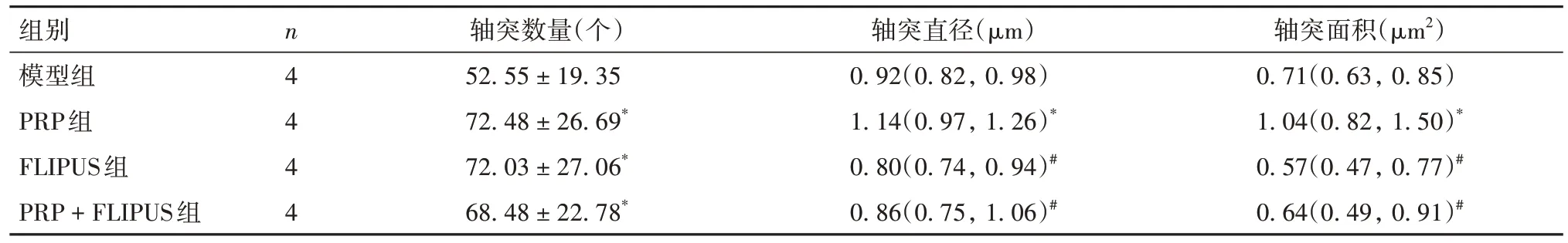
表4 各组大鼠损伤面神经节段组织单位面积内的轴突数量、直径及面积比较[± s/M(P25,P75)]
注:与模型组比较,*P<0.05;与PRP组比较,#P<0.05。
组别模型组PRP组FLIPUS组PRP + FLIPUS组轴突面积(μm2)0.71(0.63, 0.85)1.04(0.82, 1.50)*0.57(0.47, 0.77)#0.64(0.49, 0.91)#n4 4 4 4轴突数量(个)52.55 ± 19.35 72.48 ± 26.69*72.03 ± 27.06*68.48 ± 22.78*轴突直径(μm)0.92(0.82, 0.98)1.14(0.97, 1.26)*0.80(0.74, 0.94)#0.86(0.75, 1.06)#
3 讨论
面神经分支解剖位置表浅,缺乏软组织及骨骼的保护,同时其分支分布广泛且解剖位置变异较大,这些因素导致面神经在颌面部外伤及头颈外科手术中容易受到损伤[13]。面神经损伤后会引起包括干眼症、角膜炎、言语和发音障碍、进食困难、面部表情障碍等多种并发症,严重影响患者的心理健康和日常生活[14]。因此,如何有效治疗面神经损伤成为了人们愈发关注的问题,也是临床上面临的重要难题。研究表明,神经损伤程度可以分为五个级别,其中Ⅰ、Ⅱ级神经损伤的神经内膜管保持完整,神经再生是完全的,而Ⅲ、Ⅴ级神经损伤程度从神经束内神经纤维中断到神经完全离断不等。外周神经治疗旨在恢复受损神经元的结构和功能完整性,因此临床上针对Ⅰ、Ⅱ级神经损伤主要采用非手术治疗的方法来促进神经的再生,Ⅲ、Ⅴ级神经损伤则主要通过外科手术缝合和生物辅助来进行治疗[15]。但由于自体移植物获取困难、手术二次创伤可能、生物材料的排斥反应等多种因素,限制了手术治疗在面神经损伤治疗中的应用。
神经损伤的修复和再生是一个十分复杂的过程,近年来随着炎症微环境和生长因子在神经修复中的作用逐渐得到认识,多种治疗面神经损伤的非手术保守治疗方法的有效性也逐渐得到证实[16]。这些非手术保守治疗不仅可以单独用于神经损伤的治疗,还可以在神经损伤手术治疗后作为辅助治疗,成为未来临床上神经损伤治疗的主要方向。PRP是全血经离心得到的富含血小板的血浆,富含多种高浓度生长因子,且各种因子所占的比例与体内正常生长因子的比例相似,从而具有最佳的协同作用。PRP无疾病传染及免疫排斥的风险,且制备简单,国内外已有多种类型的PRP制备仪器[17]。WANG等[5]研究显示,中等浓度PRP(4.5~6.5倍PRP)和高浓度PRP(7.5~8.5倍)均可以促进坐骨神经的再生。FLIPUS强度远低于传统超声,并以低强度、脉冲式模式给予靶目标以热效应、空化效应及机械效应等无创性物理及生物刺激,从而发挥治疗作用。研究表明,FLIPUS可以改善顺铂诱导的坐骨神经功能障碍和神经变性[18]。REN等[19]研究表明,FLIPUS可以通过增强GSK-3β/β-catenin信号通路,升高细胞周期蛋白D1表达,从而促进雪旺细胞增殖。但目前PRP联合FLIPUS是否也能有效加速损伤早期面神经修复尚未可知。
本研究结果显示,各组大鼠术后1~4周瞬目反射及胡须运动评分比较差异均无统计学意义,可能与样本数量少有关;与模型组比较,PRP组、FLIPUS组及PRP + FLIPUS组大鼠术后损伤面神经的最大CMAP振幅及R值均升高,而PRP组、FLIPUS组及PRP + FLIPUS组比较差异无统计学意义,提示单独及联合应用PRP局部注射和FLIPUS均有助于恢复损伤面神经的电生理,且效果相当。本研究病理观察结果显示,与模型组比较,PRP组、FLIPUS组及PRP + FLIPUS组神经束变性、脱髓鞘及轴突空泡化程度减轻,再生轴突增多且神经纤维排列更有序,且大鼠损伤面神经节段组织单位面积内的轴突数量均升高,提示单独及联合应用PRP局部注射和FLIPUS均有助于促进面神经的再生,且效果相当。
综上所述,单独应用FLIPUS及PRP局部注射即可有效修复大鼠面神经损伤,且效果相当,二者联合应用并没有协同作用,为临床治疗外周神经损伤提供了一些理论依据。但本研究中没有确定PRP治疗的最佳给药条件及精确注射部位,且FLIPUS治疗的最佳强度、最佳治疗时间也有待于进一步研究。

