国产自膨胀式经导管主动脉瓣膜可控弯输送系统的首例应用
陈阳 陈国良 宋頔 张洪亮 王墨扬 牛冠男 周政 张倩 刘庆荣 赵振燕赵杰 张斌 丰德京 史文册 奚吉成 吴永健
1 临床资料
患者男性,61 岁,发作性气短、胸闷3 个月。症状多出现在快走时,休息约数分钟好转,无胸痛、心悸,无咳嗽、咳痰、咯血,无黑矇、头晕,活动耐量逐渐减低,夜间不能平卧。患者于2023 年5 月入当地医院住院治疗,超声心动图示中度主动脉瓣狭窄,药物治疗后好转,无夜间阵发性呼吸困难,可平卧入睡,快走时仍气短。
2023 年9 月患者症状再次加重,门诊超声心动图示重度主动脉瓣狭窄、心脏扩大、NYHA 心功能分级Ⅲ级。2023 年9 月16 日,患者于山西省心血管病医院住院。心电图示:窦性心律,左心室肥大,ST-T 改变。超声心动图示:主动脉瓣二叶式畸形,重度主动脉瓣狭窄伴轻度关闭不全;重度二尖瓣关闭不全;重度三尖瓣关闭不全;左心室室壁运动减弱;左心房、左心室、右心房扩大;升主动脉增宽;少量心包积液;左心室射血分数34%;主动脉瓣瓣口面积0.75 cm2,峰值流速416 cm/s,平均跨瓣压差47 mmHg(1 mmHg=0.133 kPa),左心室舒张末期内径57 mm。实验室检查:白细胞计数6.17×109/L,血红蛋白146 g/L,血小板计数155×109/L,血肌酐93 μmol/L,N 末端B 型利钠肽原3 057 pg/ml。冠状动脉CT 显示冠状动脉未见明显狭窄。利用3mensio软件进行CT 解剖评估,结果显示:0 型二叶式主动脉瓣,后交界融合区呈团块状钙化;左侧、右侧冠状动脉开口高度分别为17.4 mm 和19.6 mm;主动脉瓣瓣环长短径分别为27.9 mm 和21.0 mm,周长为78.2 mm,面积为461.0 mm2;无横位心;窦管交界部与升主动脉均扩张;全主动脉及双下肢入路无异常;具体测量参数见图1,多平面测量参数见图2。患者相对年轻,同时合并多种瓣膜病变,左心室射血能力极差,故外科主动脉瓣置换术风险高,因此患者拒绝外科手术。考虑到患者主动脉瓣解剖适合行经导管主动脉瓣置换术(TAVR),纠正重度主动脉瓣狭窄后其预期寿命超1 年,符合TAVR 适应证,无手术禁忌证,因此决定行过渡性TAVR 治疗[1-4]。
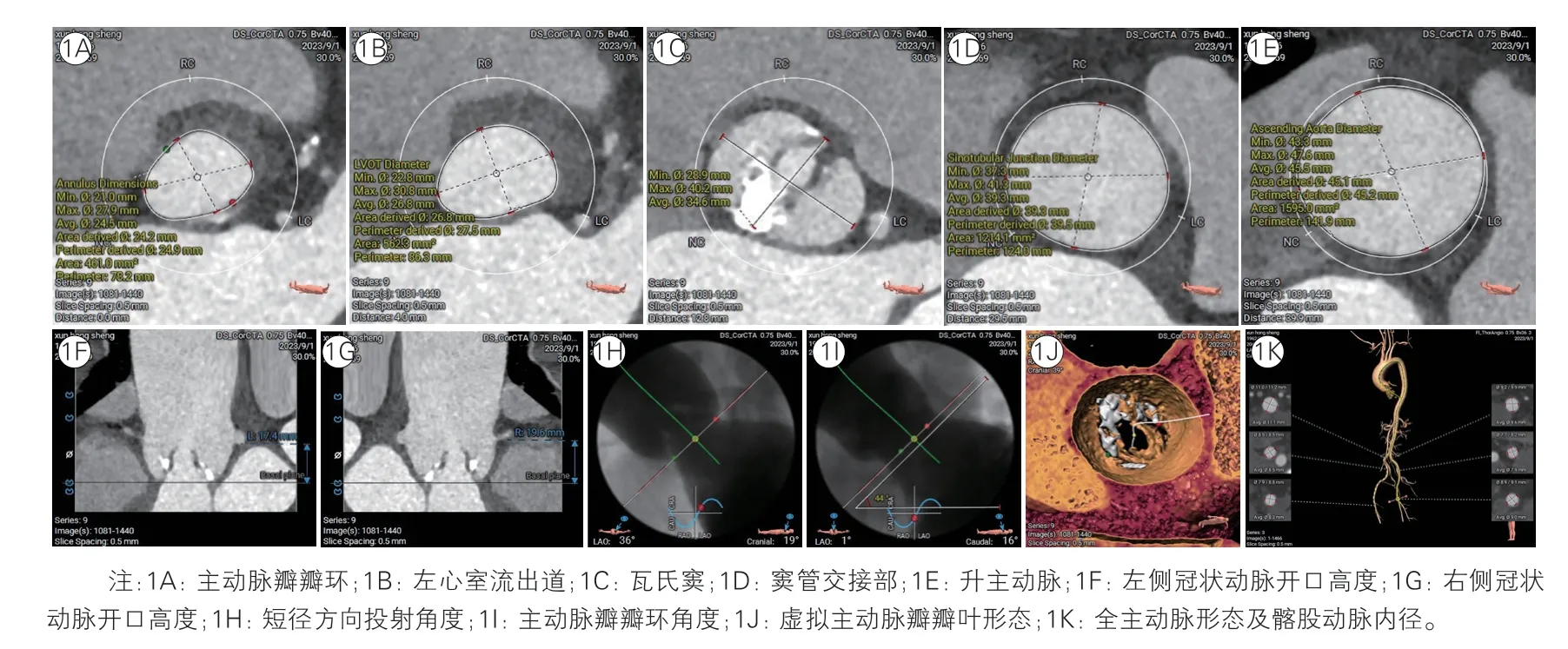
图1 患者术前CT 常规评估结果

图2 患者术前CT 多平面测量评估结果
2023 年9 月22 日,患者在全身麻醉下行TAVR(图3)。外科切开右股动脉作为主入路,置入22 F长导引鞘管(戈尔公司,美国),动脉给予肝素5 000 单位;穿刺左股动脉作为辅入路,送角度猪尾于右冠窦底,采用0 型二叶式主动脉瓣的短径方向投照体位行主动脉根部造影;AL2 导管配合直头超滑导丝进行跨瓣;成功跨瓣后交换为S 型号预塑形Angelguide 工作导丝(微创心通,上海);20 mm 球囊(微创心通,上海)对狭窄钙化的主动脉瓣预扩张;根据术前CT 瓣环上结构的测量以及术中球囊预扩张的效果,选择27 型号VitaFlow®Ⅲ可控弯输送系统(微创心通,上海,图4),输送系统到达胸主动脉,先将输送系统头段控弯,控弯后的输送系统轻松跨越主动脉弓和主动脉瓣;通过调整输送系统头段控弯使得VitaFlow®Ⅲ瓣膜精准同轴定位于瓣环水平;临时起搏器控制心室快速起搏(120 次/min),瓣膜缓慢释放至可回收极限时,电动释放按钮无法继续释放;主动脉根部造影明确瓣膜当前置入位置合适且无瓣周漏;解锁回收限定滑钮后,继续完全释放瓣膜,整个瓣膜释放过程中始终保持同轴状态,无需动态调整输送系统头段的控弯;瓣膜输送系统撤出主动脉瓣和主动脉弓时,将输送系统回调控弯,后续回收输送系统和撤出体外。主动脉瓣钙化严重导致置入瓣架形态欠佳,快速起搏(180 次/min),采用22 mm 球囊(微创心通,上海)后扩张1 次。最终主动脉根部造影显示,新置入的瓣膜位置理想且无瓣周漏。经食道超声心动图示:生物瓣膜启闭良好,瓣口面积约1.5 cm2,峰值流速203 cm/s,平均跨瓣压差9.5 mmHg,无瓣周漏。
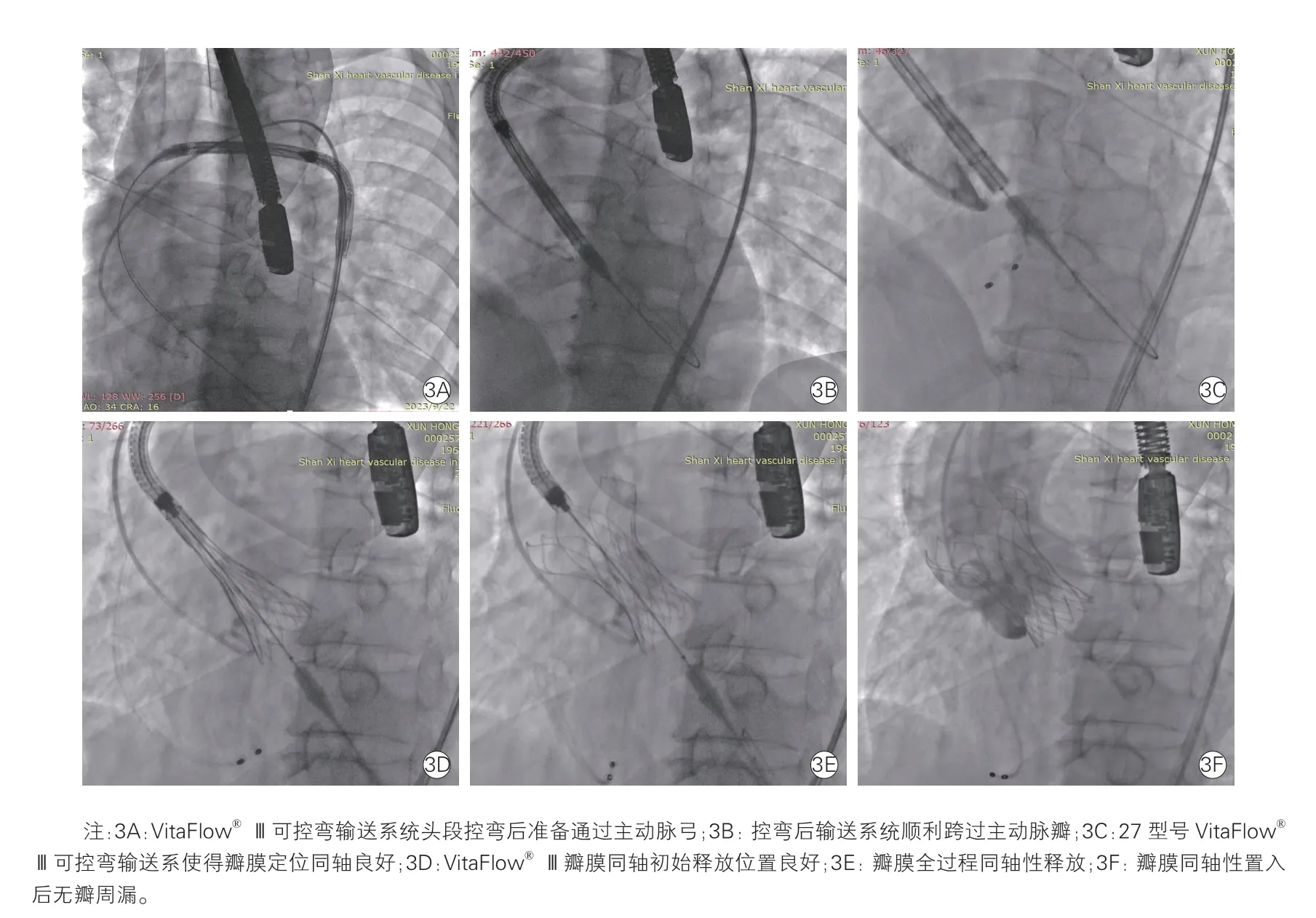
图3 应用VitaFlow®Ⅲ可控弯输送系统行经导管主动脉瓣置换术的过程

图4 VitaFlow® Ⅲ可控弯输送系统的构成及控制键
术后患者返回重症监护病房(ICU),采用阿司匹林100 mg/d 抗血小板治疗,同时接受扩容、预防感染、加强呼吸道管理、维持水电解质平衡等对症支持治疗。患者于术后3 d 转出ICU,术后6 d 出院;出院前经胸超声心动图示:生物瓣膜无异常,无瓣周漏,峰值流速240 cm/s,平均跨瓣压差11 mmHg,左心室射血分数升至44%,中重度二尖瓣反流,中度三尖瓣反流。术后随访1 个月时,患者症状消失;经胸超声心动图提示:生物瓣膜无异常,微少量瓣周漏,瓣口峰值流速186 cm/s,平均跨瓣压差 6.7 mmHg,左心室舒张末期内径51 mm,左心室射血分数上升至51%,中重度二尖瓣反流,中度三尖瓣反流。
2 讨论
目前,TAVR 治疗重度主动脉瓣狭窄应用成熟[1,4-6],术前CT评估对于指导TAVR治疗非常重要[7-12]。然而,TAVR 仍存在临床应用痛点:(1)面对严苛的解剖情况,如严重横位心、升主动脉扩张和瓣叶严重钙化时[7],瓣膜输送系统过主动脉弓和跨主动脉瓣相对困难,过度用力输送易造成主动脉血管壁损伤[13-14];(2)自膨胀式瓣膜释放时无法做到瓣膜和瓣环平面中垂线同轴,导致瓣膜释放时不稳定或瓣膜释放后不同窦部的瓣膜置入深度不同而出现瓣周漏[15],这是TAVR 术中普遍存在的问题。目前的解决方案仍存在缺陷:采用抓捕器牵拉仅能短暂调整瓣膜输送系统的头段来控制输送方向,不能保证输送系统跨瓣后释放过程中瓣膜持续的同轴性[16];采用可控弯输送系统能够调整角度,以保证瓣膜释放过程中持续同轴性,然而目前仅有进口的球囊扩张瓣膜具有可控弯输送系统[17],尚缺少国产可控弯自膨胀式瓣膜输送系统的产品应用。
国内外TAVR 技术正蓬勃发展[4,18],精细化的TAVR 操作和完美的手术结局是医患共同追求的目标。TAVR 结果的改善离不开器械的更新和改进[19],可控弯瓣膜输送系统正是为了进一步解决TAVR 术中操作不同轴的临床痛点而产生。本例患者虽无严重横位心和升主动脉扩张等严峻的解剖挑战,但其为0 型二叶式主动脉瓣且瓣叶交界区严重钙化,因此瓣膜释放存在一定的难度。在本例伴严重心力衰竭的重度主动脉瓣狭窄患者中,采用国内首个可控弯输送系统(VitaFlow®Ⅲ,微创心通,上海)不仅可轻松跨越主动脉弓及狭窄和钙化的主动脉瓣,还可通过调整输送系统头段控弯使得VitaFlow®Ⅲ瓣膜精准同轴定位于瓣环水平,从而成功完成手术。由于瓣膜输送系统跨过主动脉弓后存在系统张力,因此自膨胀式瓣膜释放过程中瓣膜与瓣环中轴线不同轴是普遍的临床痛点。VitaFlow®Ⅲ可控弯输送系统不仅适用于解剖结构极度严苛的条件如严重横位心和升主动脉扩张,同样适用于普通解剖结构的患者。应用该系统同样能提高普通解剖结构患者TAVR术中瓣膜释放的稳定性和精准性,该系统在今后TAVR 的应用中具有普遍适用性。
对于TAVR 术前经充分评估解剖难度和操作风险[7]后判定适合的患者,采用新型可控弯输送系统可大大提高TAVR 的操作效率,可使瓣膜输送系统过主动脉弓和跨主动脉瓣更顺畅,瓣膜释放过程更加同轴,瓣膜置入后更稳定,瓣膜在各个窦的置入深度更适合和匀称,在一定程度上能够减少瓣周漏的发生,使得TAVR 真正进入精细化操作时代,极大促进TAVR 技术的精细化发展。VitaFlow®Ⅲ可控弯输送系统仍延续电动操纵的释放方式[11,20],其重要的改良点在于具有国内首个可回收限制标志键,术者可大胆释放瓣膜,达到可回收限度时不可再继续释放瓣膜,只有通过控制可回收限定滑钮,才可继续完全释放瓣膜,这样使得可回收操作能够实现量化而更加安全(图4)。但可控弯输送系统所用鞘管较粗大,可能不适合入路不佳的患者[21]。目前,VitaFlow®Ⅲ可控弯输送系统的6 例首次人体临床研究已结束,其安全性和有效性有望在今后的多中心、前瞻性临床试验中得到进一步验证。
本研究已获得山西省心血管病医院药物临床试验伦理委员会批准(批件编号:2023018)。
致谢:感谢微创心通医疗科技有限公司张慧娟、陈政、单哉为本研究提供的病例资料整理及产品技术沟通等工作。
利益冲突:所有作者均声明不存在利益冲突

