国产第三代磁悬浮左心室辅助装置植入同期行二尖瓣成形术的初步评价
王志华 段晓夏 赵泽原 胡俊龙 陈志高 李建朝 王保才 程兆云
心力衰竭(心衰)是多种心血管疾病的严重表现或中晚期阶段,具有发病率高、病死率高、住院率高、患者生活质量差以及医疗花费高的特点[1]。1999~2017 年,全球心衰患病人数已从3 350 万人增长至6 430 万人[2]。2019 年Hao 等[3]研究显示,我国≥35 岁人群中约1.3%(约890 万人)患有心衰。二尖瓣反流(MR)是终末期心衰患者的常见表现,大多为功能性MR,在接受左心室辅助装置(LVAD)植入的患者中比例高达40%~70%[4]。LVAD 植入后的机械卸载通常可以通过左心室减压和衰竭心室的反向重构来减轻MR[5]。从理论上讲,无论MR 机制如何,在LVAD 植入后所有Carpentier 分型的MR程度都会减轻。但近期研究显示,LVAD 植入后仍有20%~30%的患者残留有中重度MR,严重的残余MR 会增加术后持续性肺动脉高压、右心衰竭、再入院和死亡的风险[5-6]。对于术前中重度MR 的终末期心衰患者,LVAD 植入同期行二尖瓣手术可减轻术后残余MR,改善生活质量[7]。然而,同期行二尖瓣手术会增加手术的风险和复杂性,在LVAD 植入期间是否应该同期进行仍有较多争议[8-9]。本研究回顾并总结了于我院接受国产第三代磁悬浮Corheart 6 LVAD(深圳核心医疗公司)植入同期行二尖瓣成形术(MVP)患者的近、中期随访资料,初步评价Corheart 6 LVAD 植入同期行MVP 的安全性及有效性,以期为此类患者的围术期管理提供参考。
1 资料与方法
1.1 研究对象
纳入2021 年10 月至2023 年3 月于郑州大学华中阜外医院接受Corheart 6 LVAD 植入同期行MVP 的终末期心衰患者13 例。终末期心衰的诊断标准采用《2021 年欧洲心脏病学会急慢性心力衰竭诊断和治疗指南》[10]中的定义。纳入标准:(1)年龄≥14 岁;(2)经食道超声心动图(TEE)提示重度MR:二尖瓣反流容积≥60 ml,或二尖瓣反流分数≥50%,或二尖瓣反流射流面积≥8 cm2,或有效反流口面积≥0.4 cm2[11];(3)存在不可逆性心衰病因。排除标准:(1)心衰是由未纠正的甲状腺疾病、心包疾病、肥厚型梗阻性心肌病引起或与之相关;(2)不能耐受抗凝或抗血小板治疗;(3)术前终末器官或多器官功能衰竭;(4)术前右心室功能严重不全。本研究已通过郑州大学华中阜外医院临床试验伦理委员会批准[批号:(2021)伦审第(17)号],所有患者均知情同意。
1.2 Corheart 6 LVAD
Corheart 6 LVAD 为深圳核心医疗公司组装生产的国产第三代磁悬浮LVAD,主要包括泵体、入血管、出血管、经皮线缆、控制器、电池等(图1)。泵体重90 g,直径34 mm,厚度26 mm;入血管直径20 mm,出血管直径9 mm,经皮线缆直径5.6 mm;转速2 000~5 500 r/min,最大流量10 L/min,标准功率3.5 W。适用于体表面积大于1.0 m2的成人和儿童患者。
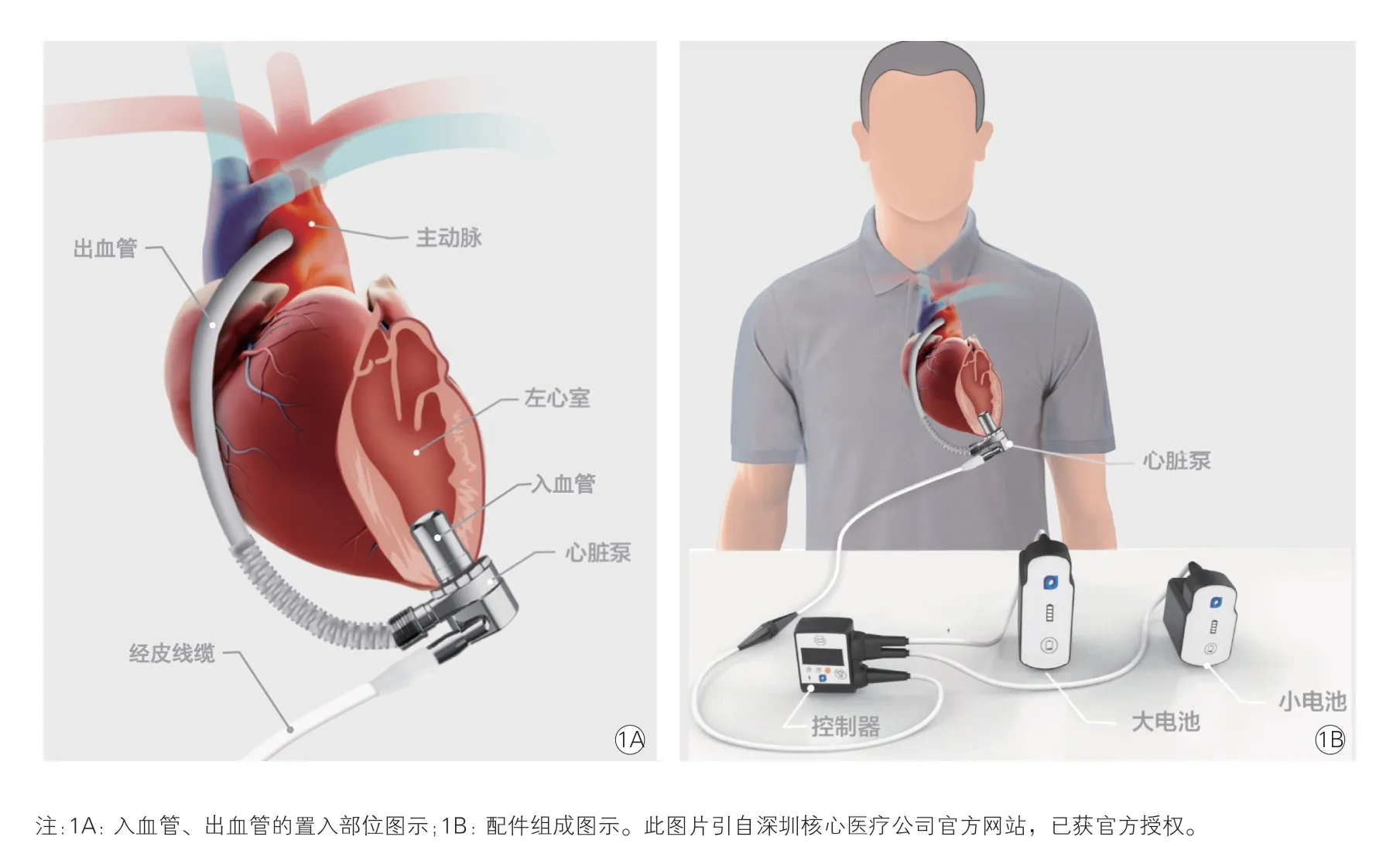
图1 Corheart 6 左心室辅助装置介绍
1.3 手术指征及方法
手术指征:对于接受LVAD 的终末期心衰患者,如TEE 提示重度MR,则计划同期行MVP;如TEE提示重度三尖瓣反流,则计划同期行三尖瓣成形术;如合并卵圆孔未闭、冠状动脉病变等,则考虑手术时间、风险、患者获益等,由多学科团队共同商讨决定。
手术方法:全身麻醉、气管插管,TEE 检查心内结构。胸骨正中切开,建立体外循环,阻断升主动脉。心脏停跳后,经房间沟入路切开左心房或经右心房-房间隔入路切开,探查二尖瓣,选择大小合适的成形环,间断缝合。注水试验提示二尖瓣关闭满意后,连续缝合关闭入路切口。将Corheart 6 LVAD 链接台下控制器进行功能测试。于左锁骨中线与肋缘下三横指平面交点处做直径约8 mm 的皮肤及皮下组织切口,钝性分离,建立经皮线缆通道。在左前降支与第2 对角支之间无血管区域标记打孔位置,缝合O 型顶环;在O 型顶环内打孔,修剪肌小梁及肌束后,置入血管和LAVD(图1A)。复温,经主动脉根部心内排气,开放升主动脉,心脏自动复跳。于升主动脉右前侧壁置侧壁钳,纵行切开约1.5 cm,连续缝合将流出管道端侧吻合于升主动脉,充分排气后开放侧壁钳(Corheart 6 LVAD 暂未启动)。经TEE 再次确认心腔内无气体残留,启动Corheart 6 LVAD。逐渐调整泵速及流量,同步渐减体外循环流量直至停机。常规止血、关胸。
1.4 临床资料收集
记录术前、术后24 h 及72 h 由Swan-Ganz 漂浮导管测量的平均动脉压(MAP)、心输出量、中心静脉压(CVP)、肺动脉收缩压(PASP)和平均肺动脉压(PAMP);所有数据均取3 次测量值的平均值并评价其变化。记录术前、术后1 周和1 个月的肌酸激酶同工酶(CK-MB)、肌红蛋白、高敏心肌肌钙蛋白T(hs-cTnT)、N 末端B 型利钠肽原(NT-proBNP)、血肌酐(Scr)及估算肾小球滤过率(eGFR)等心肌损伤和肾功能指标。收集院内、随访时的死亡和并发症事件。
1.5 随访
术后1、3、6 及12 个月门诊复查,以后每隔6个月通过门诊就诊或电话随访。了解患者临床症状、生化指标、心电图、超声心动图等资料。随访时如发现患者死亡或再入院,则向家属询问具体的原因及时间。
1.6 统计学方法
采用SPSS25.0 软件进行统计学分析。计数资料以例数表示,符合正态分布的计量资料用±s表示。符合正态分布且满足方差齐性的重复测量指标采用单因素重复测量方差分析进行组内效应分析,若满足Mauchly's 球形假设检验(P>0.05),则选择主体内效应检验对应的统计量F值和P值;若不符合球形假设检验(P<0.05),则选择多变量检验对应的统计量F值和P值。采用Bonferroni 法对检验水准α=0.05 校正后(α'=0.017)进行两两比较。校正后P<0.017 为差异有统计学意义。
2 结果
2.1 13 例患者的基线资料(表1)
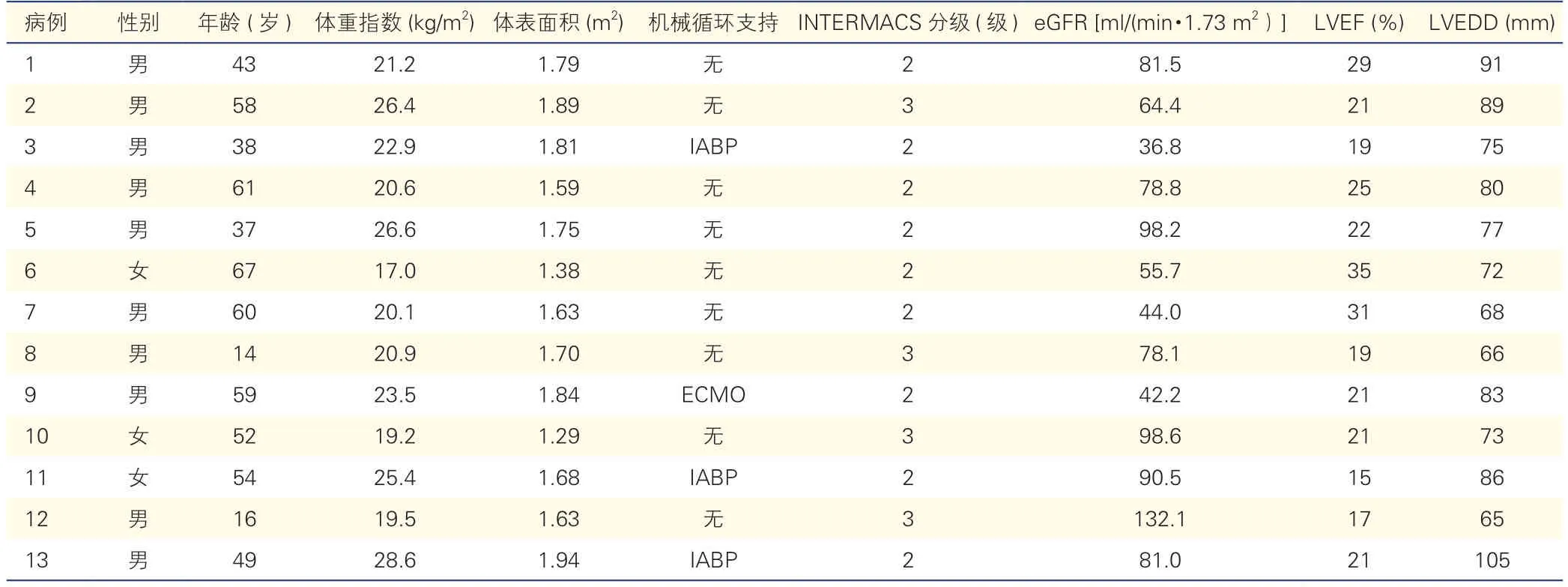
表1 13 例患者的基线资料
13 例患者终末期心衰病因均为扩张型心肌病,男10 例,女3 例;年龄14~67 岁,平均(46.8 ± 16.7)岁;体重指数17.0~28.6 kg/m2,平均(22.4 ± 3.4)kg/m2;体表面积1.29~1.94 m2,平均(1.69 ± 0.19)m2;术前主动脉内球囊反搏(IABP)支持3 例,体外膜氧合(ECMO)支持1 例;NYHA 心功能分级均为Ⅳ级,机械辅助循环支持的机构间登记(INTERMACS)分级2 级9 例,INTERMACS 分级3 级4 例;3 期慢性肾脏病[eGFR<60 ml/(min·1.73 m2)]4 例;左心室射血分数(LVEF)15%~35 %,平均(22.8 ± 5.7)%;左心室舒张末期内径(LVEDD)65~105 mm,平均(79.2 ± 11.5)mm。
2.2 13 例患者的围术期资料(表2)

表2 13 例患者的围术期资料
LVAD 植入同期行MVP 9 例,同期行MVP + 三尖瓣成形术3 例,同期行MVP + 卵圆孔未闭封堵术1 例。失血量400~1 500 ml,平均(908 ± 366)ml;手术时间290~575 min,平均(426.2 ± 84.3)min;体外循环时间148~314 min,平均(226.7 ± 48.1)min;主动脉阻断时间99~178 min, 平均(137.1 ±22.3)min;机械通气时间16~826 min,平均(159.1± 260.7)min;重症监护病房(ICU)停留时间67.1~523.7 h,平均(216.0 ± 141.3)h;术后住院时间15~72 d,平均(35.1 ± 15.4) d。5 例因急性肾损伤接受了肾脏替代治疗,1 例术后10 d 因室性心律失常接受了体外电除颤,术后14 d 出现黑便;1 例术后11 d 因胸骨后血肿二次开胸行纵隔血肿清除术;1 例合并多年胃炎病史,术后先后出现消化道出血、下肢静脉血栓形成。
2.3 安全性评价
围术期13 例患者无死亡、MR 复发、右心室衰竭、脑卒中、感染、设备血栓或故障,术后1 个月NYHA 心功能分级均改善为Ⅰ~Ⅱ级,心电图提示均为窦性心律。心肌损伤及肾功能指标评价显示,与术前相比,术后1 周hs-cTnT 升高,eGFR 降低,差异均有统计学意义(P均<0.010),CK-MB、肌红蛋白、NT-proBNP 和Scr 变化差异均无统计学意义(P均>0.017)。与术后1 周相比,术后1 个月eGFR 升高,肌红蛋白、hs-cTnT、Scr 降低,差异均有统计学意义(P均<0.017),见表3。
表3 13 例患者的心肌损伤及肾功能指标变化(±s)
注:CK-MB:肌酸激酶同工酶;hs-cTnT:高敏心肌肌钙蛋白T;NT-proBNP:N 末端B 型利钠肽原;eGFR:估算肾小球滤过率。*:术后1 周与术前相比;△:术后1 个月与术前相比;▲:术后1 个月与术后1 周相比。
项目术前术后1 周术后1 个月组内效应两两比较F 值P 值*P 值△P 值▲P 值CK-MB (ng/ml)2.2 ± 1.33.0 ± 1.82.5 ± 1.32.8970.0750.2150.891 0.307肌红蛋白 (ng/ml)35.0 ± 16.5107.1 ± 77.245.4 ± 21.35.6000.0210.0230.522 0.014 hs-cTnT (pg/ml)125.5 ± 281.91 295.6 ± 654.6278.0 ± 300.516.0010.001<0.0010.120 <0.001 NT-proBNP (pg/ml)3 815.7 ± 3 002.18 064.5 ± 7 964.72 842.1 ± 2 515.314.4110.0010.2750.798 0.042血肌酐 (μmol/L)85.8 ± 24.7126.7 ± 55.080.5 ± 19.08.0170.0070.0481.000 <0.001 eGFR [ml/(min·1.73 m2)]75.5 ± 26.951.9 ± 25.571.3 ± 27.218.000<0.0010.0030.858 <0.001
2.4 有效性评价
血液动力学指标评价显示,与术前相比,术后24 h、72 h 心输出量升高,CVP、PASP 和PAMP 降低,差异均有统计学意义(P均<0.010),见表4。
表4 13 例患者的血液动力学指标变化(±s)
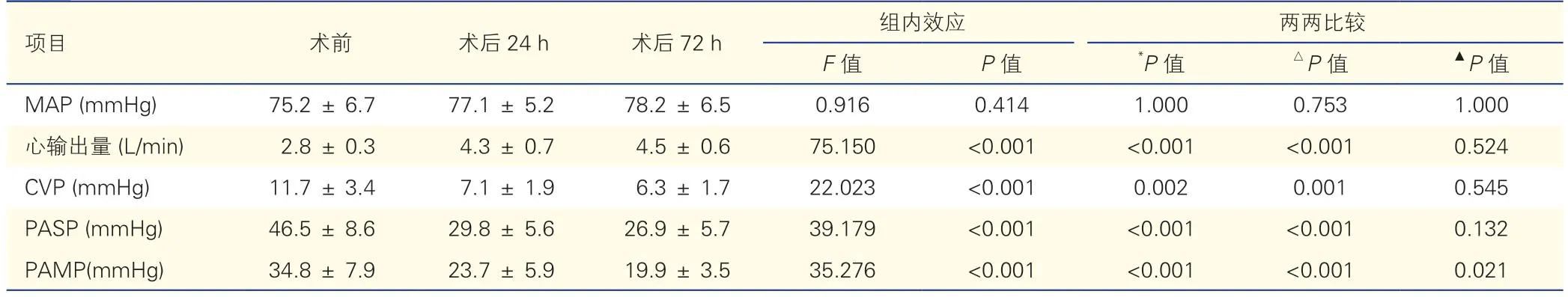
表4 13 例患者的血液动力学指标变化(±s)
注:MAP:平均动脉压;CVP:中心静脉压;PASP:肺动脉收缩压;PAMP:平均肺动脉压。*:术后24 h 与术前相比;△:术后 72 h 与术前相比;▲:术后 72 h与术后 24 h 相比。1 mmHg=0.133 kPa。
项目术前术后24 h术后72 h组内效应两两比较F 值P 值*P 值△P 值▲P 值MAP (mmHg)75.2 ± 6.777.1 ± 5.278.2 ± 6.50.9160.4141.0000.753 1.000心输出量 (L/min)2.8 ± 0.34.3 ± 0.74.5 ± 0.675.150<0.001<0.001<0.0010.524 CVP (mmHg)11.7 ± 3.47.1 ± 1.96.3 ± 1.722.023<0.0010.0020.0010.545 PASP (mmHg)46.5 ± 8.629.8 ± 5.626.9 ± 5.739.179<0.001<0.001<0.0010.132 PAMP(mmHg)34.8 ± 7.923.7 ± 5.919.9 ± 3.535.276<0.001<0.001<0.0010.021
随访超声心动图指标评价显示,与术前相比,术后1 个月、6 个月LVEF 虽升高,但差异无统计学意义(P均>0.017),而LVEDD、PASP 和PAMP 降低差异均有统计学意义(P均<0.010),见表5。
表5 13 例患者的随访超声心动图指标变化(±s)
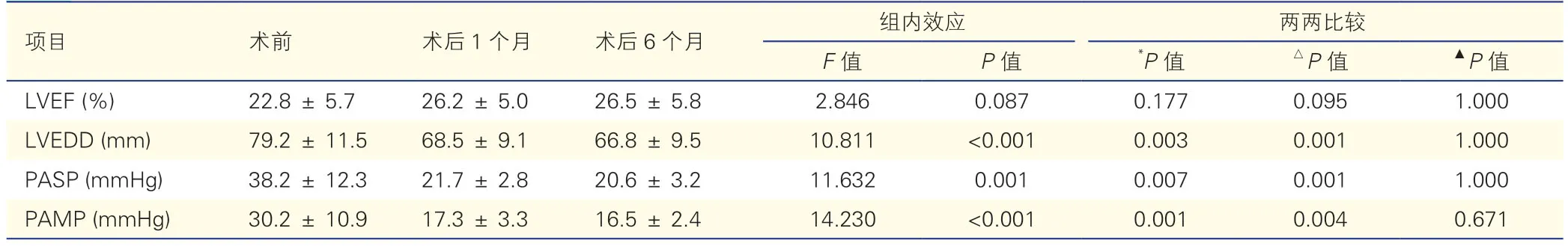
表5 13 例患者的随访超声心动图指标变化(±s)
注:LVEF:左心室射血分数;LVEDD:左心室舒张末期内径;PASP:肺动脉收缩压;PAMP:平均肺动脉压。*:术后1 个月与术前相比;△:术后6 个月与术前相比;▲:术后6 个月与术后1 个月相比。1 mmHg=0.133 kPa。
项目术前术后1 个月术后6 个月组内效应两两比较F 值P 值*P 值△P 值▲P 值LVEF (%)22.8 ± 5.726.2 ± 5.026.5 ± 5.82.8460.0870.1770.0951.000 LVEDD (mm)79.2 ± 11.568.5 ± 9.166.8 ± 9.510.811<0.0010.0030.0011.000 PASP (mmHg)38.2 ± 12.321.7 ± 2.820.6 ± 3.211.6320.0010.0070.0011.000 PAMP (mmHg)30.2 ± 10.917.3 ± 3.316.5 ± 2.414.230<0.0010.0010.0040.671
2.5 随访资料
13 例患者随访6.9~24.1 个月,平均随访(14.2± 5.6)个月,成功随访11 例(84.6%),无中重度MR 复发、右心衰竭;2 例死亡,1 例术后3 个月死于新型冠状病毒肺炎,1 例术后4 个月余死于心脏骤停。5 例再入院,1 例术后1 个月余因心悸、心房颤动再入院;1 例术后5 个月余因黑便、剑突下脓肿再入院;1 例术后6 个月余因新型冠状病毒肺炎再入院;2 例分别于术后7 个月、9 个月余因经皮线缆处感染再入院。
3 讨论
LVAD 植入同期行MVP 会增加主动脉阻断时间、体外循环时间等,可能会导致心肌缺血性损伤和更多的并发症。本研究中心肌损伤指标评价显示,术后1 周CK-MB、 肌红蛋白和NT-proBNP 较术前升高差异均无统计学意义,并且术后1 周已开始下降,说明术中的心肌损伤在术后1 周已开始恢复,同期行MVP 可能不会造成严重的心肌缺血性损伤。13 例患者围术期无死亡、无MVP 相关的并发症,术后心输出量较术前显著升高,肺动脉压显著降低,血液动力学指标显著改善,早中期随访无中重度MR 复发、右心衰竭,说明LVAD 植入同期行MVP 是安全可行的。
目前关于LVAD 植入同期行MVP 的手术适应证仍有较多争议。2013年国际心肺移植学会(ISHLT)机械循环支持指南[9]不建议在LVAD 植入期间对重度MR 的患者常规行二尖瓣修复或置换术(Ⅲ类推荐,C 级证据)。然而,2019 年欧洲心胸外科协会(EACTS)长期机械循环支持专家共识[8]指出,对于选定的患者,可以考虑同期行二尖瓣修复术(Ⅱb类推荐,C 级证据)。2023 年ISHLT 指南[14]指出,可以考虑同期行二尖瓣修复或二尖瓣生物瓣置换术(Ⅱb 类推荐,C 级证据)。目前越来越多的研究显示,LVAD 植入同期干预中重度MR 可持续改善MR,显著降低肺血管阻力、晚期右心衰竭和因心衰再入院的风险[7]。Okoh 等[6]的一项回顾性研究显示,以LVAD 作为终点治疗的中重度MR 患者术后早中期生存率较低,这些患者均未同期行二尖瓣手术。然而,Robertson 等[7]对美国INTERMACS 数据库的分析显示,同期行二尖瓣手术可以显著降低肺血管阻力和肺动脉收缩压,以LVAD 作为终点治疗并同期行二尖瓣手术的中重度MR 患者术后有长期生存优势。国外研究显示,术前重度肺动脉高压是导致心脏移植术后发生急性右心功能衰竭的重要危险因素,会显著增加术后早期死亡率[15]。综上,对于术前合并重度MR、重度肺动脉高压、接受LVAD 植入作为终点治疗或心脏移植前桥接治疗的终末期心衰患者,同期行MVP 可能是有益的。
本研究显示,出血、心律失常和急性肾损伤是术后早期最常见的并发症。然而,最近的两项系统评价显示,LVAD 植入后的消化道出血主要与胃肠道动静脉畸形(29%)和胃炎病史(22%)相关,LVAD植入后的凝血-纤溶系统异常激活、抗凝和抗血小板治疗等内外在因素也会增加其发生率,而其他因素是次要的[16-17]。杜娟等[13]的研究显示,术前存在的心房颤动、室性心律失常是影响术后室性心律失常发生的独立危险因素。Cantillon 等[18]认为LVAD术后室性心律失常的发生机制主要与基础疾病有关。本研究5 例患者术后因急性肾损伤接受了肾脏替代治疗,其中4 例术前合并有3 期慢性肾脏病[eGFR<60 ml/(min·1.73 m2)]。Asleh 等[19]报道了类似的结果,54 例患者于LVAD 植入后接受了肾脏替代治疗,其中45 例(83%)术前合并有3 期慢性肾脏病。术后早期的急性肾损伤可能主要与术前肾功能不全状态相关,与同期行MVP 可能无直接关联。然而,术前肾功能不全不是LVAD 植入的绝对禁忌证。对于术前合并有肾功能不全的患者,术后早期更应关注其肾功能变化。术前全面评估基础疾病,术后严密监测对于预防术后早期并发症至关重要。
我国没有经历第一、二代LVAD,目前的国产LVAD 均为第三代磁悬浮或液力悬浮系统[20]。然而,Kanwar 等[21]的研究显示,磁悬浮HMⅢLVAD 与轴流式HMⅡLVAD 在二尖瓣功能恢复效果上存在差异,HMⅢLVAD 患者术后2 年残余MR 的发生率显著较低。Kanwar 等[21]认为,HMⅢLVAD 的独特性,包括固有的脉动性,可能有助于通过改善收缩期二尖瓣瓣叶的对合以减少MR。虽然HM II LVAD 实现了更大的左心室卸载,但过度的左心室腔内收缩压降低会造成二尖瓣后瓣叶活动受限,从而会增加MR。然而,目前还无法确定磁悬浮LVAD 减少残余MR 的具体原因,需要进一步研究。
目前的研究大多是关于第二代LVAD 植入同期行MVP 对生存率和再入院率的影响,未来需要进一步研究第三代LVAD 植入同期行MVP 对患者运动耐量、生活质量及远期预后的影响。此外,目前的指南和专家共识推荐级别较低,LVAD 植入同期行MVP 的手术指征有较多争议,未来需要进一步研究确定哪些患者可以获益于同期的MVP,以及同期行MVP 的最佳指征。
本研究的局限性:(1)本研究为单中心回顾性研究,样本量较小,缺乏空白对照组,研究结果仍需大样本的随机对照试验进一步验证;(2)随访时间较短,需通过长期随访进一步明确远期效果;(3)围术期血液动力学资料不完整,本中心术后未常规记录肺毛细血管楔压和肺血管阻力。
综上所述,国产第三代磁悬浮Corheart 6 LVAD植入同期行MVP 是安全可行的,术后近中期无中重度MR复发,肺动脉压显著降低,血液动力学显著改善。未来仍需进一步研究确定同期行MVP 的最佳指征。
利益冲突:所有作者均声明不存在利益冲突

