CARTO 三维标测零射线下射频导管消融术治疗主动脉窦起源室性早搏的临床研究
田竞宇 朱正宇 王睿峥 田云丽 黄晶 王炎
频发室性早搏可形成室性早搏性心肌病导致心力衰竭,早期有效治疗可以改善患者的症状,延缓病程进展[1]。射频导管消融术治疗主动脉窦起源室性早搏(ASC-PVC)可以达到根治的效果,但主动脉窦解剖结构复杂,射频导管消融术治疗ASC-PVC有一定难度,并有损伤冠状动脉(冠脉)及希氏束的风险。目前,ASC-PVC 的常规治疗方法是应用三维标测系统构建主动脉窦模型后行激动顺序标测寻找最早激动靶点,再行冠脉造影或主动脉窦造影并目测靶点与冠脉开口的距离后酌情进行消融。该手术过程繁琐,目测评估靶点与冠脉开口的距离并不准确,当靶点位置发生变化时也无法反复造影明确靶点与冠脉开口的关系。近年来,有研究称CARTO标测零射线下射频导管消融术治疗ASC-PVC 有较好的疗效[2],但没有在零射线方法学层面上进行系统的分析与阐述。心腔内超声(ICE)可引导射频导管消融术治疗主动脉瓣置换术后起源于主动脉窦内、左心室尖峰部起源室性心律失常[3]。 ICE 引导完全零射线下射频导管消融术治疗ASC-PVC 安全、有效[4],但手术耗材费用升高,显著增加患者的经济负担,未提高手术成功率。本研究评估了CARTO三维标测零射线下射频导管消融术治疗ASC-PVC的临床效果。
1 资料与方法
1.1 研究对象
纳入 2020 年1 月至2023 年1 月期间贵州省人民医院及华中科技大学同济医学院附属同济医院的66 例ASC-PVC 患者,其中男性37 例,年龄14~75 岁。入选标准:(1)符合2020室性心律失常中国专家共识[5]中射频导管消融术治疗室性心律失常的标准;(2)符合ASC-PVC 心电图诊断标准[6-7],24 小时动态心电图提示室性早搏总数>10 000 次/24 h,应用抗心律失常药物无效的症状明显的患者。排除标准:存在射频导管消融术禁忌证:(1)严重的心、肺、肝、肾功能异常,凝血机制异常;(2)心肌梗死病程<6 个月或急性病毒性心肌炎;(3)脑血管意外病程<6 个月;(4)恶性肿瘤;(5)胸廓严重畸形;(6)年龄>85 岁。本研究通过贵州省人民医院伦理委员会批准(批号:2017089),术前停用抗心律失常药物至少5 个半衰期,电生理检查及射频导管消融术治疗前签署知情同意书。
1.2 研究分组及手术方法
患者入院后完善术前常规检查,超声心动图检查房室大小及左心室收缩功能,并分析主动脉窦底造影患者的左、右冠脉开口与主动脉窦的解剖位置关系(图1A)。术中患者取平卧位,常规消毒铺敷,利多卡因局部麻醉生效后常规穿刺股动脉,置入8 F 短鞘管,沿短鞘送入冷盐水灌注消融导管(Biosense Webster 公司,美国),应用快速解剖建模(fast anatomic mapping,FAM)构建主动脉窦及冠脉开口模型。32 例患者按照常规方法应用CARTO 3 系统(美国强生)构建主动脉窦模型并在激动顺序标测下寻找室性早搏最早激动靶点(图1B)为常规组,通过消融导管中空管道注入对比剂行靶点处造影,明确靶点与冠脉开口的距离与位置关系。 34 例患者在零射线下应用消融导管FAM 构建主动脉窦与冠脉开口模型为治疗组。根据主动脉窦不同部位与冠脉开口的距离将左冠窦、右冠窦各分为四区(图1 C):1 区是冠状动脉开口周围5 mm 以内区域;2 区是主动脉窦内与冠脉开口上下缘平齐且离冠脉开口大于5 mm 的区域;3 区是1、2 区下缘到主动脉窦底的区域;4 区是冠脉开口内区域,为消融放电的绝对禁区。 控弯调整导管位置分别到达左、右冠脉开口附近,当导管前端阻抗陡然增加时可标定为冠脉开口,此时略微往前送导管时可以FAM 构建出冠脉的血管走行,消融导管头端阻抗也会持续进行性升高,通过消融导管阻抗变化规律再次快速定位确认冠脉开口后(图1D)在零射线下行室性早搏电激动顺序标测及消融治疗。两组患者均于主动脉窦内激动顺序标测找到理想消融靶点[8](图2)并明确靶点与冠脉开口的距离后酌情进行消融。
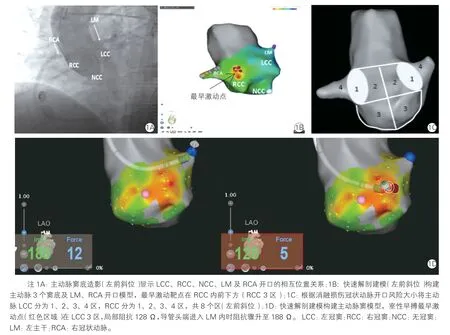
图1 主动脉窦底与左、右冠状动脉的X 线影像、三维建模、主动脉窦内激动标测靶点位置与消融风险分区

图2 主动脉窦底三维建模、室性早搏激动顺序标测及靶点在主动脉窦内的分区位置
消融放电参数:两组患者预置功率模式能量30~35 W,温度43℃,试放电10 s。放电后室性早搏逐渐消失为消融有效标志,早搏完全消失后,再巩固消融60~90 s。
手术成功标准及手术参数收集:以消融术后室性早搏消失且静脉滴注异丙肾上腺素观察30 min 室性早搏不再出现为即刻成功。术后 1、3、6 个月门诊复查,术后6 个月室性早搏减少>80%,不适症状明显改善为近期成功。复发定义是术后6 个月室性早搏减少<80%,不适症状再次出现。手术参数包括总手术时间、主动脉窦内操作时间、术中对比剂用量、X 线曝光时间、手术即刻成功率、术中并发症(如急性心肌梗死、房室阻滞、股动脉假性动脉瘤)、主动脉窦不同分区的阻抗、消融成功靶点位置。
1.3 统计学方法
应用SPSS 22.0 统计软件进行统计学分析。计量资料以±s表示,组间比较采用t检验,多组比较采用方差分析,并采用S-N-K 法进行多重比较;计数资料以例(%)表示,组间比较采用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者术前临床资料比较(表1)
表1 两组患者术前临床资料比较( ±s)
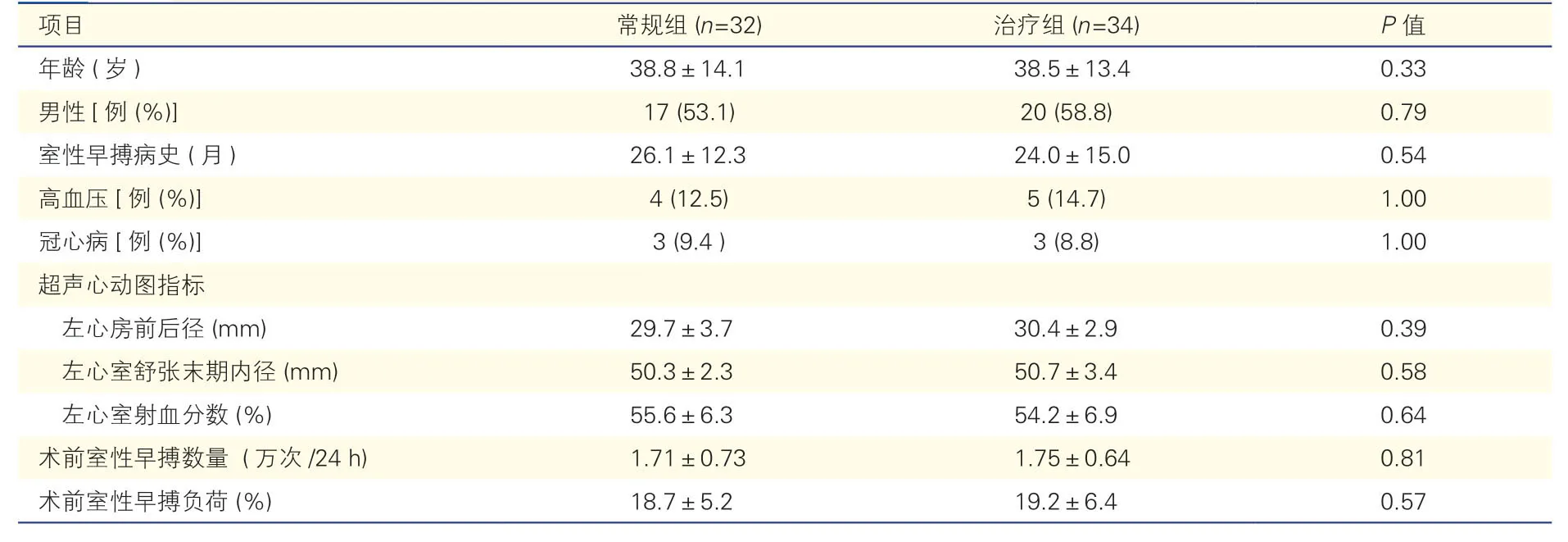
表1 两组患者术前临床资料比较( ±s)
项目常规组 (n=32)治疗组 (n=34)P 值年龄 (岁)38.8±14.138.5±13.40.33男性[例 (%)]17 (53.1)20 (58.8)0.79室性早搏病史 (月)26.1±12.324.0±15.00.54高血压[例 (%)]4 (12.5)5 (14.7)1.00冠心病[例 (%)]3 (9.4 )3 (8.8)1.00超声心动图指标左心房前后径 (mm)29.7±3.730.4±2.90.39左心室舒张末期内径 (mm)50.3±2.350.7±3.40.58左心室射血分数 (%)55.6±6.354.2±6.90.64术前室性早搏数量 (万次/24 h)1.71±0.731.75±0.640.81术前室性早搏负荷 (%)18.7±5.219.2±6.40.57
两组患者的术前临床资料包括年龄、男性患者比例、室性早搏病史、高血压患者比例、冠心病患者比例、超声心动图指标、术前室性早搏数量、术前室性早搏负荷的差异均无统计学意义(P均>0.05)。
2.2 两组患者手术资料比较(表2)
表2 两组患者手术资料比较(±s)

表2 两组患者手术资料比较(±s)
分组即刻成功[例(%)]近期成功[例(%)]总手术时间(min)主动脉窦内操作时间(min)对比剂用量(ml)X线曝光时间(s)并发症[例(%)]常规组(n=32)30 (93.8)29 (90.6)66.91±5.9450.31±5.1813.26±3.4725.3±3.91(3.1)治疗组(n=34)32 (94.1)30 (88.2)58.76±4.9443.12±4.49001(2.9)P 值1.0001.000<0.001<0.001<0.010<0.0101.000
常规组与治疗组的即刻成功率(93.8% vs.94.1%)与近期成功率(90.6% vs. 88.2%)差异均无统计学意义(P均>0.05)。治疗组总手术时间、主动脉窦内操作时间均少于常规组(P均<0.001)。治疗组未使用对比剂,常规组对比剂用量为(13.26±3.47)ml,治疗组导管标测与消融时未使用射线,常规组X线曝光时间为(25.3±3.9)s,两组患者均未发生急性心肌梗死,治疗组发生股动脉假性动脉瘤1 例,常规组发生一过性二度房室阻滞1 例,术中并发症发生率差异无统计学意义(P>0.05)。
2.3 治疗组患者主动脉窦4 个分区的阻抗分析(表3)
表3 治疗组患者主动脉窦4 个分区的阻抗比较(±s,n=34)

表3 治疗组患者主动脉窦4 个分区的阻抗比较(±s,n=34)
注:与同项目1、2、3 区阻抗比较 *P<0.001。
项目1 区阻抗(Ω)2 区阻抗(Ω)3 区阻抗(Ω)4 区阻抗(Ω)左冠窦137.37±5.50131.80±6.34131.72±6.22180.54±7.94*右冠窦134.54±6.49133.88±5.67135.06±4.57 194.11±10.59*
消融导管在主动脉窦1、2、3 区移动时阻抗差异均无统计学意义(P均>0.05),从1 区、2 区、3区进入4 区,阻抗均显著升高(P均<0.001)。
2.4 两组患者主动脉窦内消融成功靶点分布(表4)
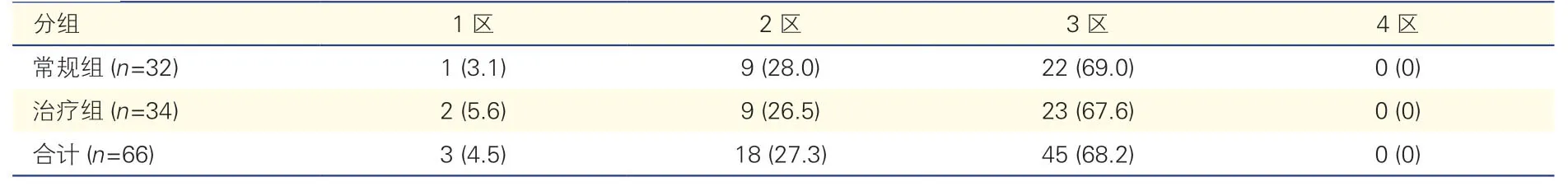
表4 两组患者主动脉窦内消融成功靶点分布[例(%)]
66 例患者中,多数患者的主动脉窦内消融成功靶点主要分布于3 区(68.2%)和2 区(27.3%),极少数患者的靶点位于1 区(4.5%),未见靶点分布于4区的病例。
本组病例中无1 例室性早搏起源于无冠窦。治疗组与常规组各分区消融成功靶点分布的差异均无统计学意义(P均>0.05)。
3 讨论
射频导管消融术是治疗主动脉窦起源心律失常的常规方法,但主动脉窦解剖较复杂,与冠脉、希氏束等重要组织结构毗邻[9-10]。射频导管消融术治疗ASC-PVC 有损伤冠脉导致严重并发症的的风险[11]。通常,射频导管消融术治疗主动脉窦起源的心律失常须先行主动脉根部造影或冠脉造影,明确冠脉开口位置与靶点的距离后酌情消融治疗。该手术过程相对比较繁琐,目测评估靶点与冠脉开口的距离并不严谨,当靶点位置发生变化时也无法反复造影明确靶点与冠脉开口的关系,不能实时精确地衡量消融靶点与冠脉开口的距离,手术连贯性较差,时间偏长。
本研究在术中先采用FAM 构建主动脉窦部及冠脉开口模型,当消融导管指向冠脉开口区域,在其头端阻抗骤然上升瞬间且与FAM 构建的冠脉位置吻合时可进一步确认冠脉开口位置,此时如继续前送导管则阻抗会呈进行性增加,这样就完成了对冠脉开口位置的三重认证,为零射线下定位冠脉开口提供了安全、可靠的依据。当冠脉开口发生变异时,利用导管头端阻抗骤然上升规律也可以实时判断导管是否在异常开口的血管内,而单纯冠脉造影往往不能准确、快速的发现异常的血管开口的位置。本研究66 例患者中未见起源于无冠窦的室性早搏,即使有起源于无冠窦的室性早搏,由于无冠窦离左、右冠脉开口远,标测与消融时也不用冠脉造影,只需避开希氏束即可。point-to-point 模式构建主动脉窦模型有助于精准定位靶点,但局部组织结构的解剖位置关系难以全面的展示。而采用FAM 建模能够快速重建主动脉窦及左、右冠脉开口,把模型精度调到12~15 之间,压力控制在5~10 g 时,模型假腔小,导管空间位置的误差小,能够充分展示主动脉窦的精细解剖结构。
主动脉无冠窦毗邻心房,故室性早搏极少起源于无冠窦[12],而主动脉左、右冠窦有较多心室肌纤维的包绕,故ASC-PVC 分布的常见区域为主动脉左、右冠窦。本研究依据主动脉窦与冠脉开口的解剖学关系将左右冠窦各分为4 个区,消融导管在1、2、3区内阻抗数值平稳变化,从1 区跨入4 区时阻抗变化幅度陡然增加提示消融导管进入冠脉开口。主动脉窦各区域因与冠脉开口距离不同,消融风险也不相同:1 区是冠脉开口外5 mm 的区域,当靶点距离冠脉开口距离<5 mm 时是放电消融可能损伤冠脉开口的危险区域[13],需结合术者手术经验谨慎评估消融风险,必要时X 线造影再次评估靶点与冠脉开口的关系后再酌情制定治疗方案,如损伤冠脉开口的风险过高时应及时终止手术;2 区位于主动脉窦内与冠脉开口上下缘平齐且离冠脉开口大于5 mm,多无重要的血管或传导束等结构,消融时不需要借助造影等方式进行定位,毕竟凭借肉眼通过冠脉造影评判靶点与冠脉开口的距离并不准确,当靶点发生变化时也不可能反复做冠脉造影来评判风险。3 区为1、2 区下缘到主动脉窦底的区域,其距离冠脉开口远,除了希氏束或左前分支外无其他重要结构,希氏束或左前分支有特殊的电位标志而易于区分。当导管在3区窦底部时其摆动小,稳定性好,只要避开希氏束与分支电位,整体消融风险可控。本研究中分布于2、3 区的靶点占比最高(95.5%),考虑与左、右冠窦底有较多心室肌细胞分布、缠绕有关,离左、右冠窦底越远心室肌细胞分布越少,则室性早搏异位兴奋灶的分布比例也相应减少。从以上数据可知对于大多数ASC-PVC 患者,行射频导管消融术时可不做冠脉造影,其消融风险并未增加。对于室性早搏起源于1 区的少部分患者应精细标测,能否消融需要结合术者的经验综合判断,必要时要在X 线造影下确认靶点的位置信息后谨慎决定手术策略;4 区是冠脉开口内的区域,在此区域放电可导致冠脉口损伤甚至冠脉闭塞,故4 区为消融放电的绝对禁区。在本研究中未见位于4 区的靶点,提示靶点位于此区域的可能性较小,但实际手术操作中仍需仔细甄别,轻柔操作,谨慎放电消融,避免损伤冠脉开口。标测与消融时将主动脉窦进行精细分区,有助于术中快速判断、评估与决策,选取合适的消融策略与方法,提高手术效率与成功率,也便于术后记录、分析。
零射线下射频导管消融术使术者从铅衣的束缚中解脱出来,减少手术疲劳感,降低腰椎、骨关节等疾病的发生风险[14]。
综上所述,根据阻抗变化规律定位出冠脉开口,将主动脉窦内的消融靶点按其离冠脉距离进行精细分区,可以协助术者快速识别消融风险的高低,实现零射线下标测及消融治疗ASC-PVC。本研究的局限性在于纳入病例数相对较少,为前瞻性的非随机对照研究,研究结果可能受到潜在偏倚因素的影响;术者需要具备一定的冠脉造影手术操作经验。另外,本研究纳入的患者均为心脏结构、收缩功能均基本正常的患者,未分析心脏扩大、左心室收缩功能减低患者主动脉窦的阻抗变化规律,也未进一步比较老年患者与年轻患者主动脉窦内的阻抗差异。今后需纳入更多的病例,随访更长时间进一步论证零射线下射频导管消融术治疗ASC-PVC 的安全性与可行性。
利益冲突:所有作者均声明不存在利益冲突

