不同病因二尖瓣反流经导管缘对缘修复术后心脏逆重构分析和超声心动图应用经验
骆志玲 董晓丽 郭秋哲 王远征 李金 周运飞 余双兰 朱达 王首正 潘湘斌
二尖瓣反流是最常见的心脏瓣膜病,国外研究统计,在75 岁以上老年人中二尖瓣反流发病率可高达10%[1]。传统外科修复或置换是中重度二尖瓣反流的主要治疗手段,但由于高龄、严重合并症和心功能差等高危因素,实际接受外科手术的二尖瓣反流患者仅5%。伴随人口老龄化及心血管疾病谱改变,二尖瓣反流治疗需求巨大[2-3]。
二尖瓣经导管缘对缘修复术(TEER)是目前应用最广泛,循证医学证据最多的二尖瓣微创介入治疗新技术。在欧美国家指南中,对于无法接受外科手术或外科手术高危的功能性二尖瓣反流(FMR)或退行性二尖瓣反流(DMR)患者,TEER 的应用已成为Ⅱa 类推荐[4]。超声心动图可实现对心腔结构、瓣膜、血流的实时三维显示,在二尖瓣TEER 术前评估、术中引导监测、术后随访等环节中发挥关键作用。
近年来的研究提示,FMR 和DMR 在病因、瓣膜病变特征、心室重构和心功能改变等方面有明显差别,导致不同病因二尖瓣反流患者接受TEER 的转归可能存在差异[5]。
目前我国二尖瓣TEER 技术处于快速发展阶段,已经有多个国产器械进入临床研究。本研究拟通过回顾性分析在云南省阜外心血管病医院接受TEER的中重度二尖瓣反流患者术前和术后6 个月的超声心动图数据,评估不同二尖瓣反流病因TEER 对瓣膜功能、心脏逆重构和心功能的转归,并总结超声心动图在TEER 中的应用经验。
1 资料与方法
1.1 研究对象与分组
回顾性分析2022 年7 月至2023 年2 月在云南省阜外心血管病医院成功行二尖瓣TEER 且完成6 个月随访的中重度二尖瓣反流患者93 例,其中男性49例(52.7%),女性44 例(47.3%)。根据病因及瓣膜结构将患者分为FMR 组(n=71)和DMR 组(n=22)[6-7]。
入选标准:(1)在我院接受经股静脉二尖瓣TEER 的中重度FMR 或DMR(≥3+级)的患者;(2)完成6 个月的随访;(3)术前和术后6 个月的超声心动图数据完整。排除标准:(1)手术方式和途径变更;(2)死亡或失访患者;(3)超声心动图数据不完整。TEER 纳入排除标准参照国内外指南推荐[4,6]。
本研究为回顾性研究,相关TEER 技术开展均获得云南省阜外心血管病医院伦理委员会批准(伦理 号:2022-001-01,2022-010-01,2022-003-01,2022-030-01),患者均签署知情同意书/手术同意书。
1.2 手术及超声心动图引导方法
在经食道超声心动图(TEE)+射线或单纯TEE引导下,采用经股静脉房间隔穿刺途径完成手术。首先,食管中段双心房切面及X-Plane 引导房间隔穿刺,穿刺点位于房间隔后上方,穿刺点距离二尖瓣环4.0~4.5 cm,穿刺完成后植入左心房导丝,超声心动图引导下将输送鞘植入左心房约1.5~2.0 cm,并引导缘对缘瓣膜修复输送系统进入左心房;在食道中段大动脉短轴切面下,引导输送系统调弯,监测器械顶端的位置,避免损伤左心耳等心脏结构;在食道中段交界联合切面及X-Plane 实时引导下,结合二尖瓣三维超声心动图,将二尖瓣夹准确输送至病变目标区域,调整二尖瓣夹方向使其垂直瓣膜对合缘;引导捕获二尖瓣叶,并确保夹持足够长度的瓣叶,关闭二尖瓣夹;评估二尖瓣夹稳定性、瓣叶张力、二尖瓣残余反流程度及瓣口压差,释放二尖瓣夹。评估钳夹效果及残余反流,如有必要,采用同样方式置入第二枚二尖瓣夹。手术完成后,TEE 监测下撤离输送系统及引导导管,关闭股静脉穿刺口(图1)。
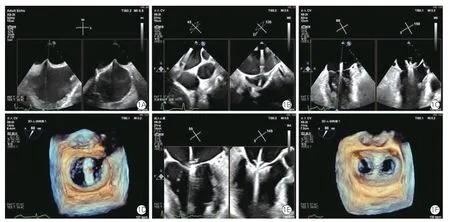
注:1A:食管中段上下腔静脉双心房切面及X-Plane 引导房间隔穿刺;1B:食管中段大动脉短轴切面引导输送系统调弯;1C:食道中段交界联合切面及X-Plane 在瓣上调整器械轴向;1D:三维超声心动图引导下调整二尖瓣夹方向使其垂直瓣膜对合缘;1E:交界联合切面及X-Plane 引导夹持二尖瓣叶;1F:三维超声心动图显示二尖瓣夹稳定,瓣叶组织桥明显,双孔面积正常。TEER:经导管缘对缘修复术。图1 超声心动图引导二尖瓣TEER 手术流程
手术器械主要选用国产二尖瓣TEER 器械,包括Clip2EdgeTM系统(御瓣医疗,上海)、ValveclipTM系统(纽脉医疗,上海)、SQ-KyrinTM系统(申淇医疗,上海)及KokaClipTM系统(科凯医疗,南通)等,上述国产器械目前均处于临床研究阶段,均获得临床研究机构伦理批件。
1.3 观察指标
患者基本信息:年龄、性别、体表面积、NYHA心功能分级、术前合并症、心脏手术史等。
术前1~3 d 及术后6 个月经胸超声心动图(TTE)检查测量指标包括:二尖瓣反流等级、Simpson 法估测左心室射血分数(LVEF)、左心室舒张末期容积(LVEDV)、左心室收缩末期容积(LVESV)、左心房容积指数(LAVI)、二尖瓣有效瓣口面积(MVA)、二尖瓣平均跨瓣压差(MPG)、二尖瓣舒张早期血流峰值速度(E)、E/二尖瓣环舒张早期峰值速度(E/e’)、左心室整体纵向应变(GLS)、肺动脉收缩压(PASP)。
术前1~3 d 及术中TEE(二维)检查测量指标:二尖瓣前后叶长度、瓣叶脱垂部位、脱垂高度和宽度、对合缘高度和对合深度、瓣叶栓系和瓣叶钙化情况;TEE(三维)测量指标:瓣环直径,包括前后径及内外径、瓣环周长、瓣叶面积。
二、三尖瓣反流等级参照国内外指南推荐,结合反流半定量和至少一个定量指标(有效反流口面积、反流缩流颈、近端等速表面积、反流面积分数等),将二尖瓣反流等级分为0~4+级,将三尖瓣反流等级分为0~5+级[8-9]。
1.4 统计学方法
应用SPSS25.0 进行统计学分析。正态分布计量资料以±s表示,自身前后及组间比较采用配对样本及两样本t检验,非正态分布计量资料以M(Q1,Q3)表示,非正态分布资料及等级资料采用配对样本秩和检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 不同病因二尖瓣反流患者基线资料比较
与FMR 组比,DMR 组患者年龄较大,高血压比例较高,NYHA 心功能分级Ⅲ级Ⅳ级比例较低(P均<0.05)。两组患者在性别、体表面积、心房颤动、糖尿病、冠心病等合并症方面差异均无统计学意义(P均>0.05),具体见表1。既往接受冠状动脉介入治疗患者14 例,FMR 组患者既往行冠状动脉旁路移植术1 例,DMR 组患者既往行主动脉瓣生物瓣膜置换和房间隔缺损修补术各1 例。
表1 两组患者术前基线资料比较[例(%),±s]
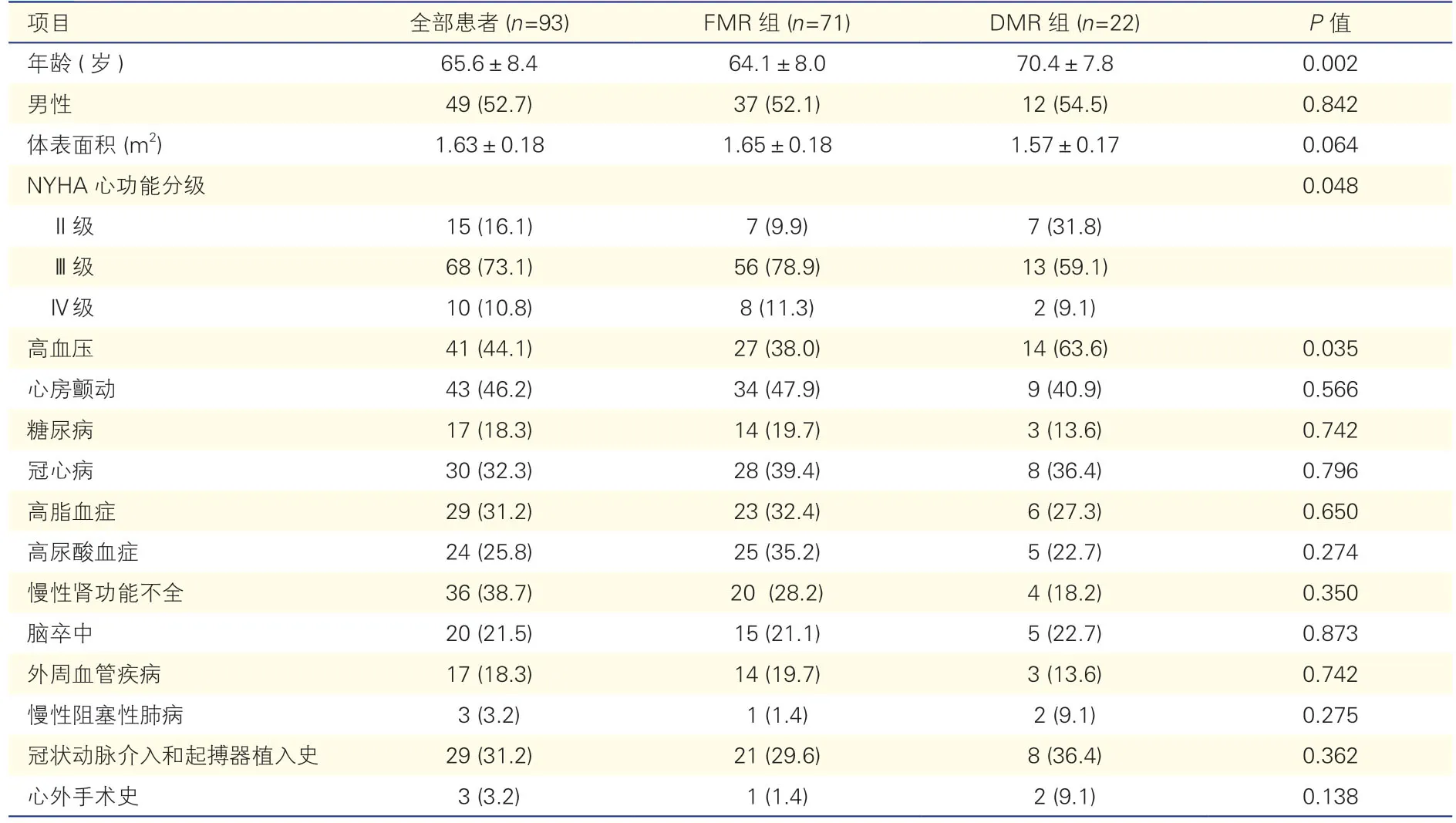
表1 两组患者术前基线资料比较[例(%),±s]
注:FMR:功能性二尖瓣反流;DMR:退行性二尖瓣反流。
项目全部患者 (n=93)FMR 组 (n=71)DMR 组 (n=22)P 值年龄 (岁)65.6±8.464.1±8.070.4±7.80.002男性49 (52.7)37 (52.1)12 (54.5)0.842体表面积 (m2)1.63±0.181.65±0.181.57±0.170.064 NYHA 心功能分级0.048Ⅱ级15 (16.1)7 (9.9)7 (31.8)Ⅲ级68 (73.1)56 (78.9)13 (59.1)Ⅳ级10 (10.8)8 (11.3)2 (9.1)高血压41 (44.1)27 (38.0)14 (63.6)0.035心房颤动43 (46.2)34 (47.9)9 (40.9)0.566糖尿病17 (18.3)14 (19.7)3 (13.6)0.742冠心病30 (32.3)28 (39.4)8 (36.4)0.796高脂血症29 (31.2)23 (32.4)6 (27.3)0.650高尿酸血症24 (25.8)25 (35.2)5 (22.7)0.274慢性肾功能不全36 (38.7)20 (28.2)4 (18.2)0.350脑卒中20 (21.5)15 (21.1)5 (22.7)0.873外周血管疾病17 (18.3)14 (19.7)3 (13.6)0.742慢性阻塞性肺病3 (3.2)1 (1.4)2 (9.1)0.275冠状动脉介入和起搏器植入史29 (31.2)21 (29.6)8 (36.4)0.362心外手术史3 (3.2)1 (1.4)2 (9.1)0.138
2.2 不同病因二尖瓣反流患者心脏结构和功能比较
两组患者二尖瓣反流等级差异无统计学意义(P>0.05)。与FMR 组比,DMR 组患者二尖瓣前叶长度较短,对合缘高度较低,对合深度较浅,瓣叶栓系比例较低,瓣环内外径较短,LVEDV、LVESV 较小,LVEF 较高、左心室GLS 绝对值较高,E/e’较低(P均<0.05)。两组患者瓣叶均无明显钙化,在二尖瓣E 峰、MVA、瓣叶面积、LAVI 和PASP 方面差异均无统计学意义(P均>0.05),具体见表2。DMR 组患者中,20 例(90.9%)脱垂部位以A2、P2 区为主,2例(9.1%) 位于交界区,脱垂高度(6.11±2.18)mm,脱垂宽度(9.47±4.73)mm。
表2 两组患者术前超声心动图参数比较(±s)

表2 两组患者术前超声心动图参数比较(±s)
注:FMR:功能性二尖瓣反流;DMR:退行性二尖瓣反流;LVEDV: 左心室舒张末期容积; LVESV: 左心室收缩末期容积;LAVI:左心房容积指数;E:二尖瓣舒张早期血流峰值速度;MPG:二尖瓣平均跨瓣压差;MVA:二尖瓣有效瓣口面积;LVEF: 左心室射血分数;GLS:整体纵向应变;E/e’:E/二尖瓣环舒张早期峰值速度;PASP:肺动脉收缩压。1 mmHg=0.133 kPa。
项目FMR 组 (n=71)DMR 组 (n=22)P 值二尖瓣反流等级[例 (%)]0.922 3+级25 (35.2)8 (36.4)4+级46 (64.8)14 (63.6)三尖瓣反流等级[例 (%)]0.486 1+级45 (63.4)12 (54.5)2+级19 (26.7)8 (36.4)3+级4 (5.6)1 (4.5)4+级3 (4.2)1 (4.5)二尖瓣 (二维)前叶长度 (mm)28.68±4.0824.55±3.290.000后叶长度 (mm)17.31±3.9216.77±3.530.567对合缘高度 (mm)4.73±1.261.86±1.250.000对合深度 (mm)9.36±2.826.32±1.770.000瓣叶栓系[例 (%)]20 (28.2)1 (4.5)0.043二尖瓣瓣环 (三维)前后径 (mm)35.60±5.5633.88±6.030.218内外径 (mm)39.93±5.7836.32±4.390.008周长 (mm)124.58±17.81117.59±17.690.111瓣叶面积 (cm2)14.28±3.6314.40±3.380.890左心大小LVEDV (ml)165.68±70.0299.14±41.440.000 LVESV (ml)112.26±55.8339.95±19.320.000 LAVI (ml/m2)72.10±33.5568.19±26.660.607心功能E (m/s)0.98±0.331.12±0.380.099 MPG (mmHg)1.58±1.051.59±1.070.926 MVA (cm2)5.78±1.255.55±1.130.286 LVEF (%)34.61±8.0859.62±8.550.000左心室GLS (%)-8.63±3.65-18.47±4.450.000 E/e’16.82±6.4212.44±4.270.006 PASP (mmHg)37.16±12.4538.04±16.800.789
2.3 手术情况
在顺利完成二尖瓣TEER 手术及随访的93 例患者中,78 例患者在TEE+射线引导下完成手术,15 例患者在单纯TEE 引导下完成手术。91 例患者TEE 监测切面满意,并完成手术,其余2 例患者因心脏明显扩大及位置改变,无法获取标准的食道中段交界联合切面,经三维超声心动图的Multiview 模式顺利完成手术。1 例房间隔修补术后患者采用射频辅助房间隔穿刺技术。9 例FMR 及3 例DMR 患者置入了2 枚二尖瓣夹,其余患者置入1 枚。所有患者术后即刻二尖瓣反流程度均降至2+级及以下。术中1 例FMR 患者发生瓣叶穿孔,行二尖瓣穿孔封堵术,术后患者二尖瓣反流1+级;2 例患者发生穿刺点部位假性动脉瘤。无心脏破裂、二尖瓣夹脱落、栓塞等并发症发生。
2.4 不同病因二尖瓣反流患者手术效果比较
两组患者TEER 术后6 个月二尖瓣反流等级均较术前明显降低,NYHA 分级均明显改善(P均<0.05);FMR 组患者LVEDV、LVESV、LAVI、PASP 均较术前明显降低(P均<0.05);DMR 组患者LVEDV、LVESV、LAVI、PASP 较术前差异均无统计学意义(P均>0.05);两组患者MVA 明显下降,E/e’和MPG 均较术前增高(P均<0.05),LVEF、左心室GLS 较术前差异均无统计学意义(P均>0.05),具体见表3。
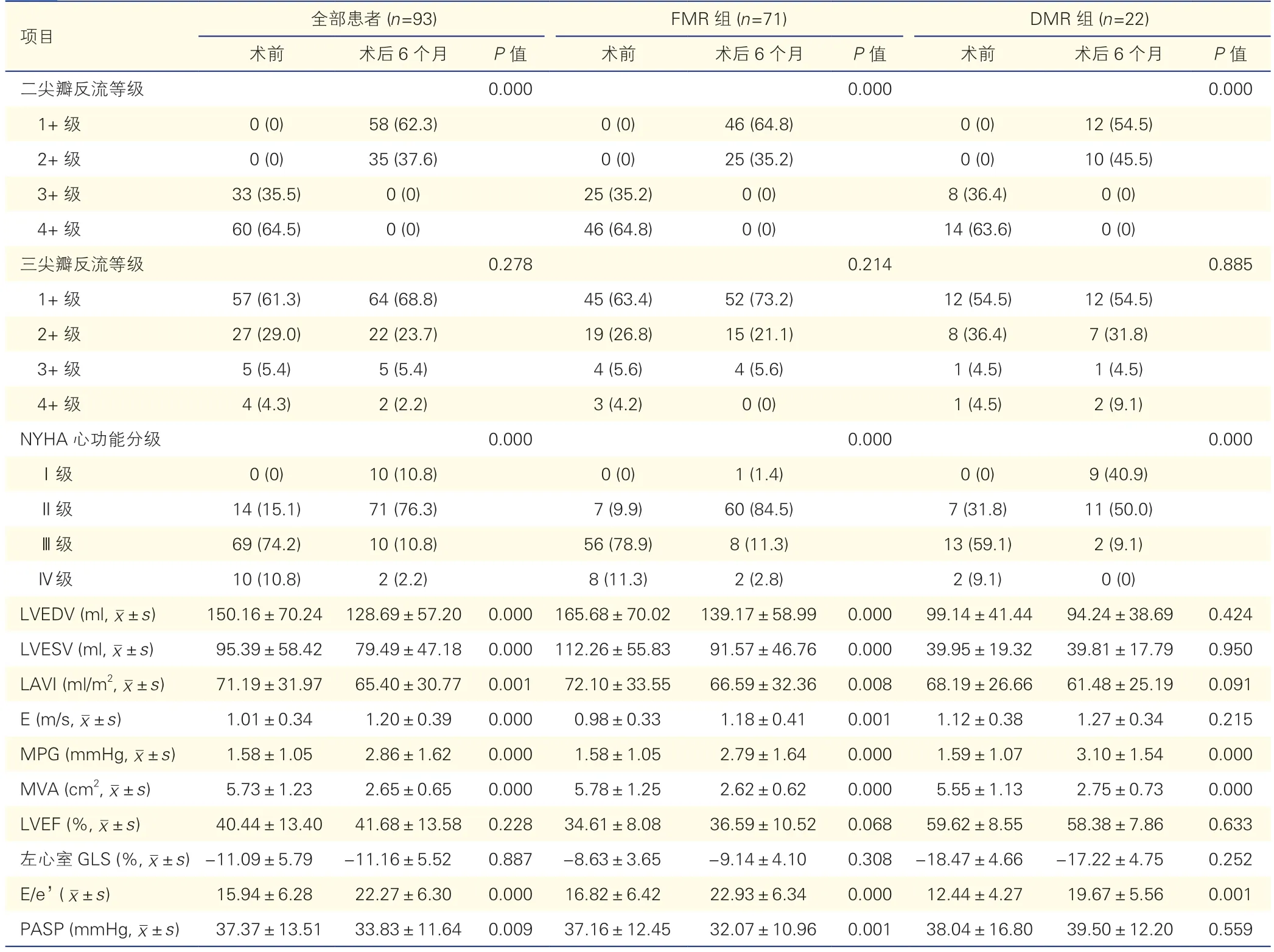
表3 两组患者手术前后超声心动图参数比较[例(%)]
两组患者手术前后差值比较结果显示,与FMR组比,DMR 组患者ΔLVEDV、ΔLVESV、ΔPASP的绝对值 较小(P均<0.05),ΔLAVI、ΔE、ΔMPG、ΔMVA、ΔLVEF、Δ 左心室GLS 和ΔE/e’差异均无统计学意义(P均>0.05),具体见表4。
表4 手术前后两组患者心脏结构和功能变化情况比较(±s)
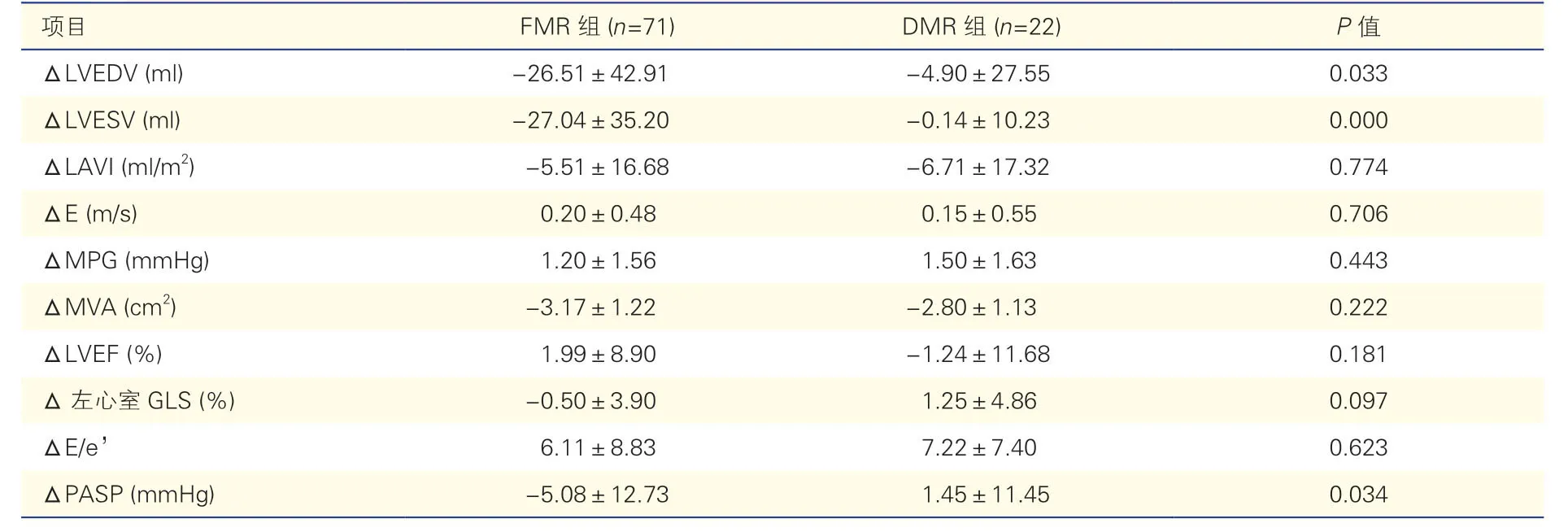
表4 手术前后两组患者心脏结构和功能变化情况比较(±s)
注:FMR:功能性二尖瓣反流;DMR:退行性二尖瓣反流;LVEDV: 左心室舒张末期容积; LVESV: 左心室收缩末期容积;LAVI:左心房容积指数;E:二尖瓣舒张期早期血流峰值速度;MPG:二尖瓣平均跨瓣压差;MVA:二尖瓣有效瓣口面积;LVEF: 左心室射血分数;GLS:整体纵向应变;E/e’:E/二尖瓣环舒张早期峰值速度;PASP:肺动脉收缩压。Δ:术后6 个月减术前超声心动图测值。1 mmHg=0.133 kPa。
项目FMR 组 (n=71)DMR 组 (n=22)P 值ΔLVEDV (ml)-26.51±42.91-4.90±27.550.033 ΔLVESV (ml)-27.04±35.20-0.14±10.230.000 ΔLAVI (ml/m2)-5.51±16.68-6.71±17.320.774 ΔE (m/s)0.20±0.480.15±0.550.706 ΔMPG (mmHg)1.20±1.561.50±1.630.443 ΔMVA (cm2)-3.17±1.22-2.80±1.130.222 ΔLVEF (%)1.99±8.90-1.24±11.680.181 Δ 左心室GLS (%)-0.50±3.901.25±4.860.097 ΔE/e’6.11±8.837.22±7.400.623 ΔPASP (mmHg)-5.08±12.731.45±11.450.034
3 讨论
二尖瓣反流是整体人群中发病率最高的心脏瓣膜疾病,根据2010 年人口普查数据保守估计,我国有720 万二尖瓣反流患者,而每年瓣膜病手术量不足10 万台,二尖瓣反流的治疗需求巨大[10]。二尖瓣TEER 作为针对二尖瓣反流的微创介入治疗新技术,为广大无法接受外科手术或外科高危患者提供了新的治疗选择,经过20 余年的发展,其手术有效性和安全性不断得到验证,同时,适应证逐步拓展。2023 年美国COPAT 实验5 年结果指出:与药物治疗相比,TEER 可有效降低中重度二尖瓣反流患者的心力衰竭所致住院和全因死亡率,术后器械相关并发症发生率低,TEER 已成为治疗二尖瓣反流的重要手段[11-12]。
本研究回顾性分析了本中心接受二尖瓣TEER的不同病因二尖瓣反流患者的早期疗效,结果显示,二尖瓣TEER 术后早期患者反流程度明显减少,心功能得到显著改善,与国内外报道一致[13-14]。本研究部分患者在单纯超声心动图、非X 线引导下顺利完成手术,提示超声心动图影像技术在TEER 中具有显著的优越性,是不可或缺的监测手段,为进一步优化二尖瓣介入手术方案,减少医患辐射损伤,提供了可行的方法学参考[15]。
本研究总结超声心动图应用的经验主要包括:(1)术前详细评估患者瓣叶结构有利于制定适合的手术策略;(2)术中TEE 引导房间隔穿刺是手术关键步骤之一,部分患者房间沟房壁反折明显,或因房间隔膨出瘤导致穿刺中房间隔明显贴近左心房壁,需要密切关注上述特点,以免穿破心房壁;(3)在器械输送及调弯过程中,TEE 顺逆旋转探头密切监测器械顶端位置及走行方向,防止心脏损伤;(4)在瓣叶夹持过程中,确保夹子垂直二尖瓣对合缘是保障钳夹效果的关键,对于偏内、外交界区部位病变,通过减少或增加切面角度,更易获得标准的交界联合切面;(5)如果器械声影明显干扰瓣叶显示,可调整交界联合切面的角度,使钳夹区域得到清楚显示;(6)对于瓣环扩大明显,瓣叶较薄的患者,钳夹瓣叶过程中需观察瓣叶张力是否过高,如钳夹张力过高,需适当释放张力,避免瓣叶穿孔;(7)对于部分无法获取标准交界联合切面的患者,可以通过Multiview三维重建技术完成引导。
由于FMR 的病因多为缺血性、扩张性心肌病和心房颤动等,心脏收缩功能降低、左心室扩大、乳头肌移位、瓣环扩张等病理生理改变是导致二尖瓣反流的主要原因[16],而DMR 的反流原因为瓣膜脱垂、连枷等病变,心脏重构发生较晚[17]。因此不同的二尖瓣反流病因可导致瓣叶、瓣环和心脏大小呈现不同的改变,本研究结果显示,FMR 组患者左心室收缩与舒张功能降低更明显,左心室扩大和瓣环扩张更显著,瓣叶对合深度更深,瓣叶更易栓系,而DMR 组患者因瓣叶脱垂导致对合缘高度较低。
既往对于二尖瓣TEER 的研究提示,不同患者术后心脏逆重构和心功能转归不一致,Schrage 等[18]研究发现TEER 术后的心脏逆重构与患者基础LVEF相关,LVEF>40%的患者左心室的收缩功能改善,左心室容积缩小;Spieker 等[19]通过心脏磁共振成像对比二尖瓣TEER 手术前后左心室容积变化,发现34%的FMR 患者术后左心室明显逆重构(左心室容积指数较基线下降15%),左心室逆重构的患者术前左心室容积指数较小;而Yoon 等[20]研究发现不同病因的二尖瓣反流患者术后早期不仅左心室较术前明显缩小,左心房容积指数也明显减小。本研究中FMR 组患者术后表现出明显的左心房、左心室逆重构,而DMR 组患者术后左心房、室容积变化不明显,可能的原因是,虽然不同病因的二尖瓣反流均伴随术后反流程度的降低,左心容量负荷的减少,发生一定程度的逆重构,但FMR 组患者左心扩大更明显,逆重构的空间较大。既往研究发现二尖瓣TEER 术后,患者的NYHA 心功能分级改善,大部分患者LVEF 较术前无明显改变或略降低[21-22],本研究中两组患者术后NYHA 心功能分级均获得显著改善,但LVEF 和左心室GLS 均无明显变化,提示对于TEER 术后患者心功能转归的判定,可能要综合评估临床和超声心动图指标。同时,两组患者术后E/e’均较术前升高,考虑其原因是二尖瓣口面积下降,舒张期压差及前向流速(MPG、E 峰)升高所致,提示,E/e’不适合作为TEER 术后患者心脏舒张功能的评价指标。
本研究为单中心回顾性研究,样本量较小,仅观察了二尖瓣TEER 患者术后6 个月的心脏逆重构、心功能和瓣膜功能情况,所观察到的现象需要通过前瞻性的更大样本研究加以验证。
结论:对于不同病因的中重度二尖瓣反流患者,二尖瓣TEER 是有效的治疗方法,可降低患者术后早期反流程度并改善心功能。FMR 与DMR 患者术前瓣膜结构存在差异,FMR 组患者术后左心房、室逆重构更明显。超声心动图是二尖瓣TEER 治疗术前评估和术中引导过程的重要影像学手段。
利益冲突:所有作者均声明不存在利益冲突

