根皮素对肺癌细胞增殖与凋亡的影响
宫慧,张艺蓝,刘政,王会
锦州医科大学食品与健康学院(锦州 121001)
肺癌是一种严重危害人群身体健康的且有很高死亡率的疾病,目前居我国癌症死亡的第一位[1]。从天然植物中寻找高效、低毒、安全的抗肺癌药物是目前抗癌研究的热点。根皮素(Phloretin)在自然界中广泛存在于草莓、梨、苹果等水果的根皮与果皮中,是一种带有二氢查耳酮结构的黄酮类化合物,化学结构中存在多个羟基,其结构式如图1所示。根皮素具有多种生物学活性,能够抑制皮肤中黑色素生成和聚合,具有增白效果[2-3],能够清除生物体内自由基,具有抗氧化功能[4],能够调节血管的张力,具有保护血管作用[5]。根皮素具有对前列腺癌、乳腺癌、消化道肿瘤等多种肿瘤的抑制作用[6-8],目前有关根皮素对肺癌细胞增殖及凋亡的研究较为少见。此试验研究了根皮素对肺癌细胞A549的增殖及凋亡的影响,为进一步研究根皮素诱导肺癌细胞凋亡的分子机制提供试验依据。
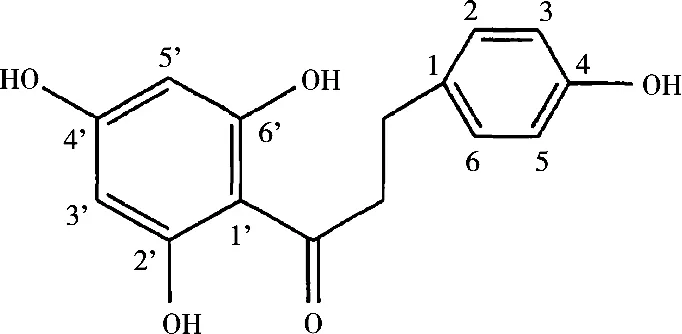
图1 根皮素的结构式
1 材料与方法
1.1 材料与仪器
人肺癌A539细胞(中国农业科学院北京畜牧兽医所遗传资源实验室);根皮素(纯度≥99.99%)、喜树碱(纯度≥98.0%):Sigma公司;胎牛血清、DMEM高糖培养基(美国GIBCO有限公司);碘化丙啶(propidium iodide,PI,美国Sigma公司);Fluo-3/AM(美国Invitrogen公司);JC-1探针、Annexin V-TIC Apoptosis Density试剂盒(美国BD有限公司)。
Multiskan FC酶标仪(美国Thermo fisher公司);BB15 CO2培养箱(德国Heraeus公司);FC-500流式细胞仪(美国Beckman公司);IX-71倒置相差显微镜(日本Olympus公司)。
1.2 试验方法
1.2.1 细胞培养
A549细胞培养于DMEM高糖培养基(含10%胎牛血清)中,培养环境为37 ℃、5% CO2、饱和湿度。使用0.25%的胰酶对汇合度为70%~80%细胞进行消化后按1∶2或1∶3的比例传代培养。
1.2.2 药物配制
使用二甲基亚砜(Dimethyl sulfoxide,DMSO)溶解喜树碱和根皮素配制成储备原液,于-20 ℃保存。进行试验时,储备原液分别溶解于DMEM培养基中(DMSO终浓度小于0.05%),使得培养基中根皮素质量浓度分别为10,20,40和80 μg/mL,喜树碱质量浓度分别为6,12和24 μg/mL。
1.2.3 细胞毒性分析
将常规消化细胞制成单细胞悬液,细胞(浓度为3×104个/mL)接种于96孔培养板,每孔180 μL。在细胞内进入对数生长期之后,分别换用含有10,20,40和80 μg/mL根皮素的培养基培养,并设有空白对照组(含终浓度为 0.05% DMSO的培养基处理)和阳性对照组(分别用6,12和24 μg/mL喜树碱处理),每组设5个复孔。培养时间分别为12,24,36和48 h,每孔添加20 μL 5 mg/mL的3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐[3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT),继续培养4 h,吸出孔中的液体。将200 μL DMSO注入96孔板的每个孔中,采用酶标仪测定吸光度,波长设置为490 nm。
1.2.4 细胞形态学观察
在六孔板中接种细胞悬液,密度为3.0×105个/孔,待细胞贴壁进入对数生长期,每孔分别用含10,20,40和80 μg/mL根皮素的培养基处理细胞24 h,同时设置空白对照组(用含浓度为0.5% DMSO的培养基处理)和阳性对照组(24 μg/mL喜树碱处理细胞)。倒置相差显微镜观察。
1.2.5 Annexin V-FITC及PI 染色测定凋亡率
采用常规方法收集处理组(根皮素处理质量浓度10,20,40和80 μg/mL)、阳性对照组(喜树碱处理质量浓度27.84 μg/mL)及空白对照组(用含浓度0.5%DMSO的培养基处理)分别处理12,24,36和48 h的细胞,稀释细胞使其浓度为5.0×105细胞/样品,每个样品加入100 μL缓冲液重悬,同时加入5 μL AnnexinVFITC及5 μL PI,混匀。避光孵育15 min,应用流式细胞仪定量检测。
1.2.6 细胞周期检测
采用常规方法收集处理组(根皮素处理质量浓度10,20,40和80 μg/mL)及空白对照组(用含浓度0.5% DMSO的培养基处理)处理24 h的细胞,稀释细胞使其浓度为5.0×105细胞/样品,在4 ℃条件下用70%无水乙醇处理细胞12 h。经PBS漂洗,加入0.5 mL PI染液处理8 min,应用流式细胞仪检测。
1.2.7 线粒体膜电位检测
采用常规方法收集处理组(根皮素处理质量浓度10,20,40和80 μg/mL)及空白对照组(用含浓度0.5% DMSO的培养基处理)处理24 h的细胞,稀释细胞使其浓度为5.0×105细胞/样品,加入0.5 mL JC-1染液,于37 ℃孵育10 min,经PBS洗涤、悬浮,应用流式细胞仪检测。
1.2.8 细胞内钙离子浓度的测定
采用常规方法收集处理组(根皮素处理质量浓度10,20,40和80 μg/mL及空白对照组(用含浓度0.5%DMSO的培养基处理)处理24 h的细胞,稀释细胞使其浓度为5.0×105细胞/样品。加入Fluo-3/Am(终浓度为7 μmol/L),于37 ℃孵育25 min,设置阴性对照(无Fluo-3/Am处理)。经PBS漂洗、重悬,应用流式细胞仪检测。
1.2.9 数据处理
应用SPSS 17.0统计软件对数据进行统计分析,正态计量数据用“X±S”表示,组间两两比较采用t检验。P<0.05表示差异有统计学意义。
2 结果与分析
2.1 细胞毒性分析
MTT法是细胞毒性分析的经典方法,可以准确检测细胞存活和增殖情况。A490值反映活细胞数量,A490值小指示活细胞少。根皮素对A549细胞生长的影响如表1所示。根皮素处理细胞12 h,处理组与空白对照组比较,80 μg/mL处理组A490值减小,差异显著(P<0.05)。40 μg/mL处理组A490值大于20 μg/mL处理组,组间比较差异不显著,20 μg/mL处理组A490值大于10 μg/mL处理组,组间比较差异不显著,推测出现这种现象的原因可能是12 h处理时间内两个浓度的根皮素未对细胞产生差异的毒性影响。根皮素处理细胞24 h,40和80 μg/mL处理组与空白对照组比较,A490值减小,差异显著(P<0.05)。根皮素处理细胞36、48 h,20,40,80 μg/mL处理组分别与空白对照组相比,A490值均减小,差异极显著(P<0.01)。在相同处理时间,随着处理组浓度增大其A490值逐渐减小,指示活细胞数下降,呈现浓度相关性。喜树碱处理的阳性对照组细胞A490值也呈现量效关系。根皮素处理组与阳性对照组比较,具有较强的细胞毒性,为凋亡作用研究奠定基础。
表1 根皮素对A549细胞生长的影响(,n=3)
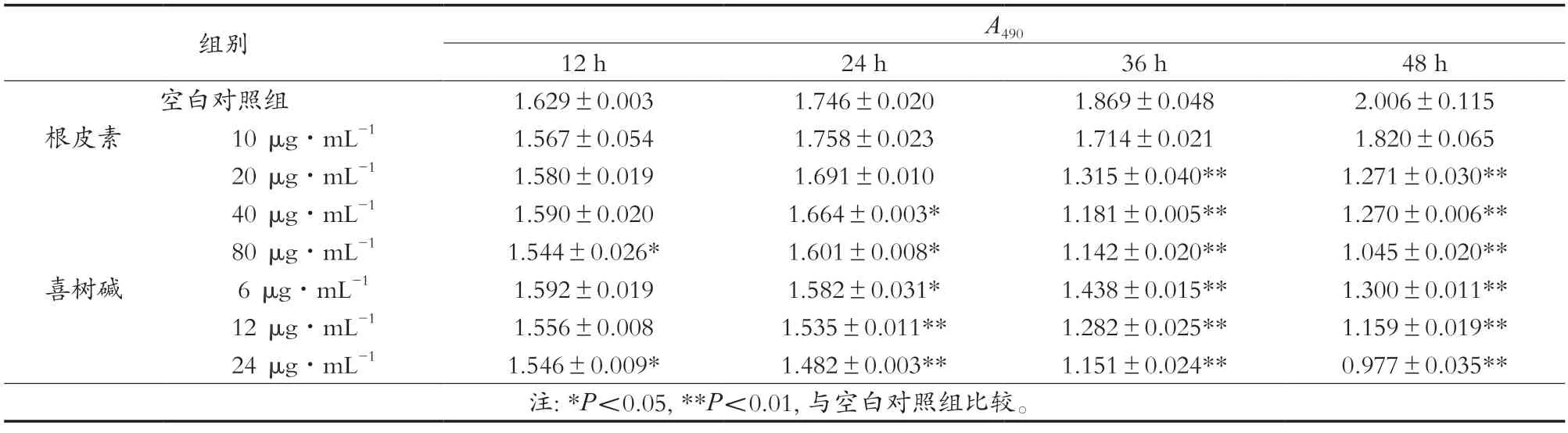
表1 根皮素对A549细胞生长的影响(,n=3)
2.2 细胞形态学观察
对照组细胞贴壁生长,胞体饱满、排列紧密,立体感、折光度好,边缘清晰。80 μg/mL根皮素处理组胞体皱缩,出现空泡,胞间连接消失,出现细胞碎片,部分细胞表现出凋亡晚期甚至坏死特征。阳性对照喜树碱24 μg/mL处理组细胞凋亡情况与根皮素80 μg/mL处理组相近(图2)。
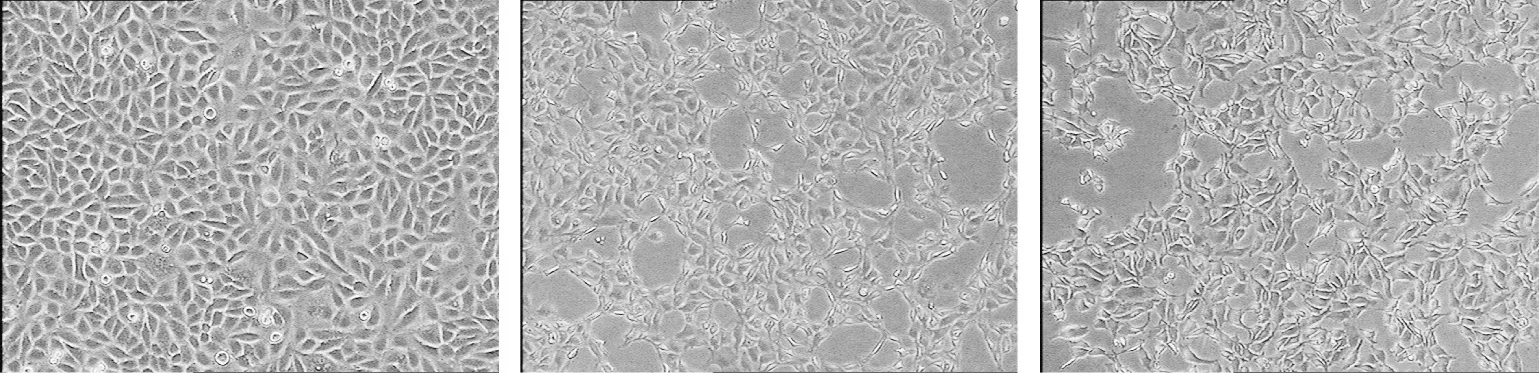
图2 根皮素处理细胞A549 48 h细胞形态(40×)
2.3 细胞凋亡率的测定
应用流式细胞术结合Annexin V-FITC/PI双标记法定量分析细胞凋亡。
细胞经处理12 h,40和80 μg/mL根皮素处理组与空白对照组相比,凋亡率增高,差异极显著(P<0.01)。细胞处理24和36 h时,20 μg/mL根皮素处理组与空白对照组比较,凋亡率上升,差异显著(P<0.05)。40和80 μg/mL根皮素处理组与空白对照组相比,凋亡率上升,差异极显著(P<0.01)。细胞处理48 h时,20,40和80 μg/mL根皮素处理组与空白对照组相比,凋亡率上升,差异极显著(P<0.01)。根皮素浓度和凋亡率之间呈浓度依赖性。各处理时长的80 μg/mL根皮素处理组凋亡率小于阳性对照喜树碱24 μg/mL处理组(表2),根皮素表现出良好的诱导A549细胞凋亡的作用。
表2 根皮素处理A549细胞凋亡率(,n=3)单位:%

表2 根皮素处理A549细胞凋亡率(,n=3)单位:%
2.4 细胞周期检测
细胞周期是细胞生命活动的重要事件之一,其时相紊乱会影响细胞增殖进程从而扰乱生命活动,药物对细胞周期的影响具有时相特异性。此研究通过PI标记结合流式细胞法测定细胞周期的变动,结果显示,根皮素作用细胞24 h,20 μg/mL根皮素处理组和空白对照组相比,在G1期细胞中的数目增加,差异显著(P<0.05)。处于S期细胞的数目减少,差异显著(P<0.05)。40和80 μg/mL根皮素处理组和空白对照组相比,在G1期细胞的数目增加,差异极显著(P<0.01)。处于S期细胞的数目减少,差异极显著(P<0.01)。80 μg/mL根皮素处理组与空白对照组相比,在G2期细胞的数目减少,差异极显著(P<0.01)。细胞在经根皮素处理后周期停滞于G1期,从而阻滞了DNA合成,并呈现出剂量依赖性(表3)。
表3 根皮素处理A549细胞24 h,细胞周期的变化(,n=3)单位:%

表3 根皮素处理A549细胞24 h,细胞周期的变化(,n=3)单位:%
2.5 线粒体膜电位检测
线粒体对细胞凋亡起着重要的作用,线粒体膜电位的降低是细胞凋亡过程的早期事件。细胞经根皮素处理24 h,20,40和80 μg/mL根皮素处理组与空白对照相比,线粒体膜电位降低差异极显著(P<0.01)(表4)。根皮素处理浓度与线粒体膜电位呈现量效关系。
表4 根皮素处理A549细胞24 h,线粒体膜电位变化(,n=3)

表4 根皮素处理A549细胞24 h,线粒体膜电位变化(,n=3)
2.6 细胞内游离钙离子测定
钙离子作为第二信使影响细胞的增殖、死亡等一系列生命现象,细胞内游离钙离子被认为可以启动细胞凋亡。细胞经根皮素作用24 h,10 μg/mL根皮素处理组与空白对照比较,胞内游离钙离子浓度升高差异显著(P<0.05)。20,40和80 μg/mL根皮素处理组与空白对照比较,胞内游离钙离子浓度升高,差异极显著(P<0.01)(表5)。根皮素处理浓度与胞内游离钙离子浓度呈现量效关系。
表5 根皮素处理A549细胞24 h,胞内Ca2+浓度的变化(,n=3)
3 讨论与结论
多基因调控失调使得细胞增殖失控和凋亡受阻是肿瘤的发生和发展的本质。细胞凋亡是生物体在生理或病理情况下,为了维持内环境稳态,由基因控制的自发性的有序的细胞死亡。对凋亡机制研究发现,引起癌症细胞凋亡是防治癌症的有效手段之一。根皮素是一类有抑制癌细胞增殖潜力的类黄酮物质,可诱发癌细胞凋亡[9]。
先前研究表明根皮素可以抑制肝癌细胞增殖,且抑制作用呈现剂量依赖性[10-11],此研究表明与先前研究相似,根皮素抑制肺癌细胞A549生长,并呈现浓度依赖性,凋亡率测定结果与细胞形态学分析及细胞毒性研究结果一致。
研究表明细胞无限增殖、恶性转化是导致肿瘤发生的原因之一[12],因此,利用药物影响细胞周期进程抑制细胞增殖、促使细胞凋亡是抗癌症作用的突破口之一。研究结果表明:根皮素使得A549细胞周期进程发生改变,细胞停滞在G1期,导致细胞无法进入S期与G2期,细胞分裂受阻,发生凋亡作用。先前研究表明,根皮素可以干预白血病K562细胞周期,抑制细胞增殖,从而引起白血病细胞的凋亡[13]。
线粒体是能够进行氧化磷酸化的半自主性细胞器,是细胞的能量工厂,线粒体功能对细胞乃至整个机体具有重要意义。线粒体和细胞凋亡之间存在着密切的关联,其功能失调可引发细胞凋亡,如膜电位的降低就导致了膜通透性转运孔打开,这也是细胞凋亡级联反应中较早出现的生物化学反应,此后,线粒体中的细胞色素C,凋亡诱导因子如AIF等进入胞质,便开启了凋亡过程[14]。根皮素是一类解偶联剂,能够控制线粒体的氧化磷酸化过程,ATP合成被干扰,无法产生能量,从而导致细胞坏死[15]。文章中线粒体膜电位检测结果表明,根皮素作用A549细胞使得线粒体膜电位下降,且根皮素处理浓度与线粒体膜电位下降呈现量效关系。
在生理状态下胞内大部分Ca2+与蛋白质结合形成结合钙,存在线粒体与内质网中,只有很少一部分游离Ca2+。当细胞受到外界刺激时结合钙转变为游离Ca2+作为第二信使,在机体生命活动的细胞的反应、基因的表达等多方面发挥重要作用,游离Ca2+的大量聚集是导致细胞凋亡发生的原因之一[16]。
此研究结果显示,当根皮素处理A549细胞时,胞内游离Ca2+浓度增多,钙稳态被打破,根皮素诱导A549细胞发生了凋亡作用。同时检测到线粒体膜电位下降,推断胞质内游离Ca2+来源之一为内质网内结合钙,但其具体机制有待进一步的研究。
综上所述,根皮素可抑制肺癌A549细胞增殖、促进其凋亡,其机制可能为打破正常的细胞周期进程与钙离子稳态从而诱导细胞凋亡的。

