Fe-N-C单原子纳米酶用于比色-电化学法检测H2O2
胡丽君,李佳慧,翟艳玲
(青岛大学 化学化工学院,山东 青岛 266071)
0 引言
过氧化氢(H2O2)是一种常见的氧化剂,可参与许多化学、生物、制药、临床和环境过程[1-3]。H2O2是氧的一种不完全还原代谢物,在活细胞内具有多种生理和病理作用[4]。因此,为了更好地了解H2O2的生物学效应,开展生物环境中H2O2的快速、灵敏、准确的测定至关重要。目前对生化分析中H2O2的浓度的几种测定方法有液相色谱[5]、化学发光[6]、荧光[7-9]、电化学技术[10]和比色法[11-13]等。这些分析技术中,比色法以其简单、成本低、实用性强等优势而备受关注。此外,比色法检测分析物可通过肉眼观察,无需任何仪器即可实现目视检测[14]。大多数情况下,H2O2的比色检测是基于酶促反应中辣根过氧化物酶的催化活性[15]。过氧化物酶是最先进的生物催化剂,它通过2H+/2e-转化过程催化H2O2还原为H2O[16]。它们的活性位点是五配位血红素系统,包括一个组氨酸残基作为轴向配体和一个卟啉辅助因子[17]。过氧化物酶独特的几何/电子结构在调节催化活性和选择性方面起着关键作用[18]。然而,天然酶成本高、难回收、易失活等缺点限制了其实际应用[19]。
在过去的几年中,得益于纳米技术、生物技术、催化科学和计算设计的快速发展,在用高性能纳米材料模拟新的酶活性、调节纳米酶活性、阐明催化机制和扩大潜在应用方面取得了重大进展[16]。与传统的类似酶相比,纳米酶具有催化效率高、耐热、耐酸碱稳定性好、制备规模大、价格低等优点。这些特点不仅弥补了天然酶昂贵、不稳定的缺点,也克服了以往类似酶催化效率低的问题[20],其中具有原子分散金属位点的单原子纳米酶可以模拟酶的活性中心。基于最大的原子利用效率和强的金属负载相互作用,单原子纳米酶的催化活性和选择性显著高于传统的纳米材料。此外,明确定义的活性金属位点有利于深入理解构效关系,这为在原子尺度上合理设计先进的类酶催化剂提供了潜在的指导。因此,纳米酶具有广泛应用的潜力,相关的应用研究也在不断引起关注[21]。此外,纳米级材料具有独特的纳米级尺寸[22]、大的比表面积,可与其他物种结合用于生物识别。因此,基于比色法开发有效的模拟酶对于生物传感和制药过程具有重要意义。
本研究采用硬模板法合成了具有分级多孔结构的Fe-N-C单原子纳米酶,与不含Fe的NC纳米酶相比[23],Fe-N-C纳米酶具有高效的过氧化物酶活性。所制备的Fe-N-C单原子纳米酶具有良好的分散性和稳定性。以Fe-N-C单原子纳米酶作为过氧化物酶模拟物,开发了H2O2的比色检测方法。基于简单Fe-N-C单原子纳米酶的比色平台实现了对H2O2的高灵敏检测,表明本工作所发展的Fe-N-C单原子纳米酶在生物催化和生物分析方面具有很大的潜力。
1 实验部分
1.1 试剂及材料
3,3’,5,5’-四甲基联苯胺(TMB)和葡萄糖氧化酶(GOX)购自上海阿拉丁生化科技股份有限公司;氯化锌(ZnCl2)、醋酸(HAc)、乙酸钠(NaAc)、H2O2、四水氯化亚铁(FeCl2·4H2O)、氢氟酸(HF)、乙醇、氢氧化钠(NaOH)均购自国药化学试剂有限公司;胶体二氧化硅悬浊液购自默克公司。
1.2 实验过程
通过冷冻干燥和煅烧进行样品的制备,将含有氨基葡萄糖盐酸盐(2 g)、ZnCl2(334 g)、FeCl2·4H2O(150 mg)、胶体二氧化硅悬浮液(5 mL,2 g SiO2)充分混合搅拌至均匀。然后,将溶液冷冻干燥得到Fe@SiO2粉末。在N2条件下加热到900 ℃并保温2 h。最后,用质量分数为10%的HF水溶液以及去离子水洗涤所得样品,经离心干燥得到Fe-N-C纳米酶。为了对比,在同样条件下不添加FeCl2·4H2O合成了N掺杂碳基纳米酶,即NC纳米酶[23]。
1.3 Fe-N-C纳米酶的过氧化物酶活性和动力学测定
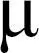
1.4 材料表征和测试
用X射线衍射仪(XRD,D8 DISCOVER,德国布鲁克)表征材料的物相组成。用日本电子株式会社的扫描电子显微镜(SEM,JSM-6010plus/LA)和透射电子显微镜(TEM,JEM-1400)表征材料微观形貌;用X射线光电子能谱仪(XPS,Thermo ESCALAB 250XI,美国赛默飞世尔科技公司)表征材料的无毒组成和价态。
电化学测试使用传统的三电极体系,电化学工作站的型号为CHI 660E(上海辰华)。电解液为0.1 mol/L N2饱和PBS(pH=7.4)溶液,参比电极为Ag/AgCl电极(饱和KCl溶液),对电极为碳棒,工作电极为制备的Fe-N-C纳米酶[24]。
2 结果与讨论
2.1 形貌与结构表征
使用日本电子株式会社JEM-1400透射电子显微镜对制备的Fe-N-C纳米片进行TEM和HRTEM表征。如图1(a, b)所示,在TEM图像中观察到制备好的Fe-N-C样品具有良好的多孔纳米结构以及丰富的褶皱形貌。图1(c)是在像差校正的高角度环形暗场扫描TEM (AC-HAADFSTEM)图像,可以识别出明亮和孤立的金属原子,证实了单个铁原子在Fe-N-C纳米酶上的原子分散[23]。

图1 Fe-N-C的(a)TEM图像、(b)高分辨TEM图像和(c)球差校正高分辨透射电子显微镜图
通过XPS谱研究Fe-N-C的元素组成以及价态。如图2(a)所示,Fe-N-C具有明显的Fe特征峰,但是该Fe特征峰未在NC中出现。如图2(b)所示,从Fe 2p的高分辨XPS谱图分析可以得知,在711.3 eV和724.5 eV处的两个峰,分别对应Fe 2p3/2和Fe 2p1/2。此外,Fe 2P的XPS谱图中还存在Fe2+2p3/2(710.8 eV),Fe3+2p3/2(714.2 eV),Fe2+2p1/2(273.2 eV)和Fe3+2p1/2(725.9 eV),这说明Fe-N-C材料中的同时存在Fe2+和Fe3+[25]。通过高分辨率N 1s谱来识别Fe-N-C中N的掺杂类型,如图2(c)所示,397.9、398.5、399.1、400.1、403.3处的峰分别对应于吡啶-N、FeNx、吡咯-N、石墨-N、氧化-N。从XPS谱图可以看出Fe-N-C具有明显的FeNx部分[26-28],说明Fe可以通过与芳香N络合从而以单原子形式分散,原子利用率高、活性位点明确。从图2(d)所示的C 1s谱中可明显看出,纳米酶Fe-N-C含有较多的sp3-C成分,这说明Fe-N-C的结构中存在较多缺陷[29],反应接触面积大。
图2 (a)Fe-N-C的XPS谱图和Fe-N-C中(b)Fe 2p、(c)N 1s和(d)C 1s的谱图
图3为Fe-N-C和N-C的XRD谱图。通过对比碳的XRD衍射卡片(JCPDS No. 26-1076),可以得到Fe-N-C的XRD图谱中25°的衍射峰归属于石墨碳的(002)晶面。未观察到铁基纳米颗粒相关的衍射峰,进一步验证了Fe-N-C纳米酶结构中的Fe以单原子形式存在[30]。
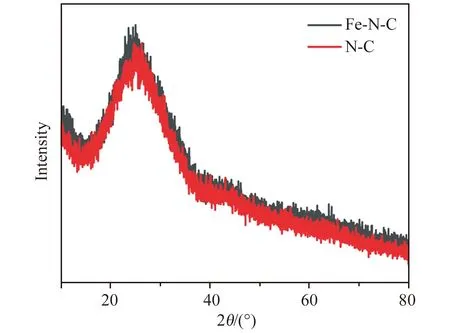
图3 Fe-N-C和N-C的XRD谱图
2.2 比色法检测H2O2

表1 Fe-N-C纳米酶和NC纳米酶对H2O2、TMB的稳态动力学结果
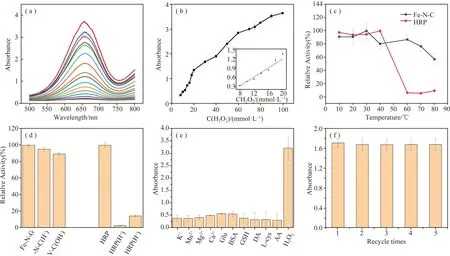
图4 (a)Fe-N-C纳米酶在不同浓度的H2O2中对TMB进行氧化得到的紫外-可见吸收光谱以及(b)相应校准曲线; (c) Fe-N-C纳米酶和HRP的耐温性能;(d)Fe-N-C纳米酶和HRP在1 mol/L HCl和1 mol/L NaOH孵育1 h后的过氧化物酶活性比较;(e)Fe-N-C纳米酶对不同底物的响应,五次实验平均值;(f)Fe-N-C纳米酶的循环使用稳定性
2.3 电化学检测H2O2

图5 (a)不同浓度H2O2存在时Fe-N-C和N-C纳米酶的循环伏安曲线;(b)在-0.15 V下,i-t曲线; Fe-N-C和NC对不同浓度H2O2的安培响应;(c)-0.15 V时,对Fe-N-C纳米酶连续加入H2O2的安培响应
3 结论
采用二氧化硅模板法合成了具有多孔结构的Fe-N-C单原子纳米酶,并且与对照样品NC纳米酶各自对H2O2进行比色检测。在检测H2O2中,Fe-N-C纳米酶催化H2O2氧化TMB的产生的吸光度与H2O2浓度之间存在较好的线性相关性。除此之外,作为一种概念应用,将基于Fe-N-C的传感器用于对H2O2的灵敏电化学检测,在生物传感器应用中具有较好的应用前景。

