一株3,5,6-三氯-2-吡啶酚降解菌Delftia sp. DFT的分离鉴定及降解途径研究
贾 楠,岳彩旭,吕雪茹,王雪婷,丁 宁,王圣惠
(聊城大学 生命科学学院,山东 聊城 252059)
0 引言
3,5,6-三氯-2-吡啶酚(TCP)属于氯代吡啶类化合物,它是化学农药毒死蜱、甲基毒死蜱、绿草定及绿草定-2-丁氧基乙酯的高毒难降解残留物[1-3]。TCP在环境中的半衰期为65~360天[4],目前已被世界公认为持久性有机污染物[5]。相比于母本化合物,TCP具有更高的水溶性和移动性,更易进入地表水体和土壤,从而造成大面积的扩散和污染[6-8]。然而,近十年来,由于毒死蜱及绿草定类化学农药的大量生产和超量使用,TCP的污染问题日趋严重[9-11],进而对生态环境和人类健康构成了严重威胁[12,13]。
微生物降解是消除毒死蜱残留的关键环节。然而,由于TCP具有抑菌活性,它不但能抑制本身的微生物降解,还能抑制其母体以及其他有机污染物的生物降解[14]。TCP的这种特性加重了环境中有机污染物的积累,严重影响了生态系统的自我修复能力[15]。早期TCP 降解菌的筛选是从毒死蜱降解菌中分离、鉴定并被进一步加以研究。近年来,国内外科研工作者已从长期施用毒死蜱的农田土壤、蔬菜大棚土壤和农药污水处理厂曝气池中,分离了多株好氧TCP降解菌株。主要包括MicrococcusluteusML[16],Paracoccussp. TRP[17],SerratiaandTrichosporonspp.[18],BacilluslatersprorusDSP[19],Ralstoniasp. T6[20],Cupriavidussp. DT-1[21],Cupriavidussp. P2[22],Pseudomonassp. AY-1[23],Rhodotorulaglutinisspp.andRhodotorularubraspp.[24],BacillusthuringiensisMB497[25],Pseudomonassp. CB2[26],Xanthomonassp. 4R3-M1,Pseudomonassp. 4H1-M3[27]和Ochrobactrumsp. JAS2[28]等。最新研究发现,在缺氧或厌氧的条件下TCP可以被微生物菌群彻底降解,且添加NanoFe3O4能加速TCP的缺氧或厌氧生物降解[29,30]。
在好氧条件下,TCP降解菌株主要通过还原脱氯和氧化脱氯的方式降解 TCP。在还原脱氯过程中,TCP 逐次脱掉吡啶环结构上的3个氯原子,分别生成5,6-二氯-2-吡啶酚,6-氯-2-吡啶酚和2-羟基吡啶,如菌株BacilluslatersprorusDSP、Cupriavidussp. DT-1以及Ochrobactrumsp. JAS2[19,21,28]。在氧化脱氯过程中,TCP 脱去3个氯原子生成一种绿色代谢产物3,6-羟基吡啶-2,5-二酮,随后被完全矿化,如菌株Ralstoniasp. strain T6和Cupriavidussp. P2[20,22]。在缺氧或厌氧的条件下,微生物菌群主要通过还原脱氯途径,将TCP降解为6-氯-2-吡啶醇,再进一步脱氯生成2-羟基吡啶,最后被矿化[29]。最近有研究报道,BacillusthuringiensisMB497 还可以通过反硝化途径对TCP进行降解[25]。目前,还有部分研究报道了一些新的TCP代谢产物[31,32],但TCP的代谢机制仍不清楚。
为了研究TCP完整的微生物代谢途径,本课题组从毒死蜱及TCP污染的农田土壤中分离出一株TCP降解菌株,随后对该菌株进行了分子生物学鉴定、TCP降解性能检测以及代谢产物鉴定,在此基础上初步推测了该菌株可能的TCP代谢途径。这将为微生物降解TCP机制的研究提供理论依据。
1 材料和方法
1.1 实验试剂
检测标准品:TCP购买自毕得医药,纯度99 %(中国上海)。6-氯-2-吡啶醇(≥97%)和2-羟基吡啶(≥97%)购自上海麦克林生化科技有限公司(中国上海)。3,5-二氯-2-吡啶醇(≥98%)购自阿拉丁试剂(上海)有限公司(中国上海)。
其余试剂:无水乙醇(≥99.5%)、氢氧化钠(≥96%)和乙酸(≥99.5 %)购自烟台远东精细化工有限公司(中国山东);甲醇(HPLC)购自赛默飞世尔科技(中国)有限公司(中国上海);其余药品和试剂均为分析纯。
1.2 实验方法
1.2.1 培养基配方。下列培养基配置时除特殊说明外,均用蒸馏水定容至1 000 mL,121 ℃灭菌30 min,固体培养基在此配方的基础上加入2 %(w/v)琼脂粉末。富集培养基(LB培养基):胰蛋白胨10 g/L、氯化钠10 g/L、酵母提取物5 g/L。无机盐培养基(MSM培养基):硝酸铵 1.0 g/L、氯化钠0.5 g/L、磷酸二氢钾0.5 g/L、磷酸氢二钾1.5 g/L、硫酸铵0.5 g/L、硫酸镁0.5 g/L、酵母提取物0.05 g/L。
1.2.2 TCP降解菌的分离鉴定。TCP降解菌株是从毒死蜱污染的农田土壤中分离出来的。土壤样品为山东省聊城市长期喷洒毒死蜱的旱地和韭菜种植场的表层土壤(0~20 cm)混合物。将TCP富集培养物用无菌水稀释至合适浓度后涂布在LB平板上(TCP 100 mg/L),放入35 ℃恒温恒湿培养箱中培养至平板上长出边缘清晰的单菌落。挑取单菌落转接入MSM平板上(TCP 50 mg/L),放入35 ℃恒温恒湿培养箱中培养,此时生长的菌落为具有TCP降解能力的目标菌株。
将菌株接种至LB液体培养基中37 ℃、150 r/min培养至OD600 nm≈0.6,8 000 r/min离心5 min收集菌体,采用全式金柱式细菌基因组DNA抽提试剂盒提取。
PCR扩增:采用细菌通用引物:27F (5′-AGAGTTTGATCCTGGCTCAG-3′)、1492R (5′-GGTTACCTTGTTACGACTT-3′) 对菌株进行 16S rDNA 扩增。取PCR产物在0.8%琼脂糖凝胶上进行电泳。将PCR产物送至金唯智测序公司测序,根据所获得的16S rDNA序列上传至GenBank中获得登录号 OK 602639.1。用MEGA 4.0软件对16S rDNA进行系统发育分析。
1.2.3 生物降解性能研究。将菌株在LB培养基预培养至对数生长期(OD600 nm≈0.8),8 000 r/min离心5 min收集菌体,用等体积的无菌PBS洗涤菌体两次,控制菌体湿重在0.1 g。之后转移至200 mL MSM培养基中(TCP 50 mg/L),以不接入微生物的纯培养基做对照,37 ℃ 150 r摇床培养。所有处理设置三组平行,保证实验准确性和重复性。
1.2.4 菌株降解其他氯代吡啶类化合物的研究。选取其他氯代吡啶类化合物:3,5-二氯-2-吡啶酚、6-氯-2-吡啶醇、2-羟基吡啶,进行菌株降解性能研究。将培养至合适的菌株(培养条件同1.2.3)接入MSM培养基(含50 mg/L 3,5-二氯-2-吡啶酚、25 mg/L 6-氯-2-吡啶醇、50 mg/L 2-羟基吡啶)中,以未接种菌株的纯代谢产物作为对照组,37 ℃ 150 r/min摇床培养,定期收集培养液并进行HPLC检测。所有处理设置三组平行,保证实验准确性和重复性。
2 结果与分析
2.1 菌株DFT的分离鉴定
从毒死蜱及TCP污染的农田土壤中分离得到几株细菌,通过菌株在LB以及以TCP为唯一碳源的无机盐固体培养基中的生长状态,得到生长最好的一株细菌命名为DFT。该菌株能在以TCP(50 mg/L)为唯一碳源的无机盐平板上生长良好,如图1所示,初步证明菌株DFT具有降解TCP的能力。随后,以菌株DFT基因组为模板,采用细菌扩增通用引物,PCR扩增菌株DFT的16S rDNA序列并测序分析。将菌株DFT的16S rDNA序列在NCBI数据库中进行Blast比对分析,选择相关序列,采用MEGA 4.0软件的Neighbor joining邻位归并法构建系统发育树(bootstrap>95%),如图2所示。菌株DFT与Delftiatsuruhatensisstrain NBRC 16741的16S rDNA序列相似性为100% (图2),初步将菌株DFT鉴定为代尔夫特菌属(Delftia. sp),其Genbank登入号为OK_602639.1。

图1 菌株DFT在MSM(TCP 50 mg/L)固体培养基上生长的菌落形态
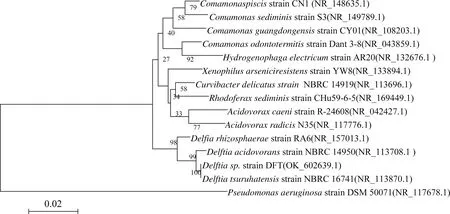
图2 菌株DFT(Genbank:OK_602639.1 )的系统发育分析
2.2 菌株DFT对TCP降解性能检测
将菌株DFT接种到以TCP(50 mg/L)为唯一碳源的MSM培养基中,不同的时间点取样,检测菌株DFT生长及其对TCP的降解情况,如图3所示。 在以TCP为唯一碳源的培养液中,菌株DFT有明显的生长,其OD600 nm的吸光度值从初始的0.037(0 h)升到了0.108(48 h)。在菌株生长的同时伴随着TCP的降解,菌株DFT能在48 h内对50 mg/L TCP的降解率达34.28%。这些结果表明,菌株DFT能够以TCP为唯一碳源生长,并表现出了较高的TCP降解性能。
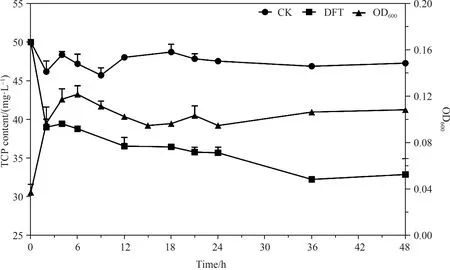
图3 菌株DFT的生长降解曲线
2.3 TCP代谢产物鉴定
收集不同时间点菌株DFT对TCP的降解产物,采用液质联用技术(LC-MS)检测并鉴定TCP的降解产物。在菌株DFT降解TCP过程中,共检测到12种可能的TCP 代谢产物,其在液相色谱中的保留时间为0.361~6.313 min(图4)。这12种代谢产物去质子化的准分子离子如表1所示。
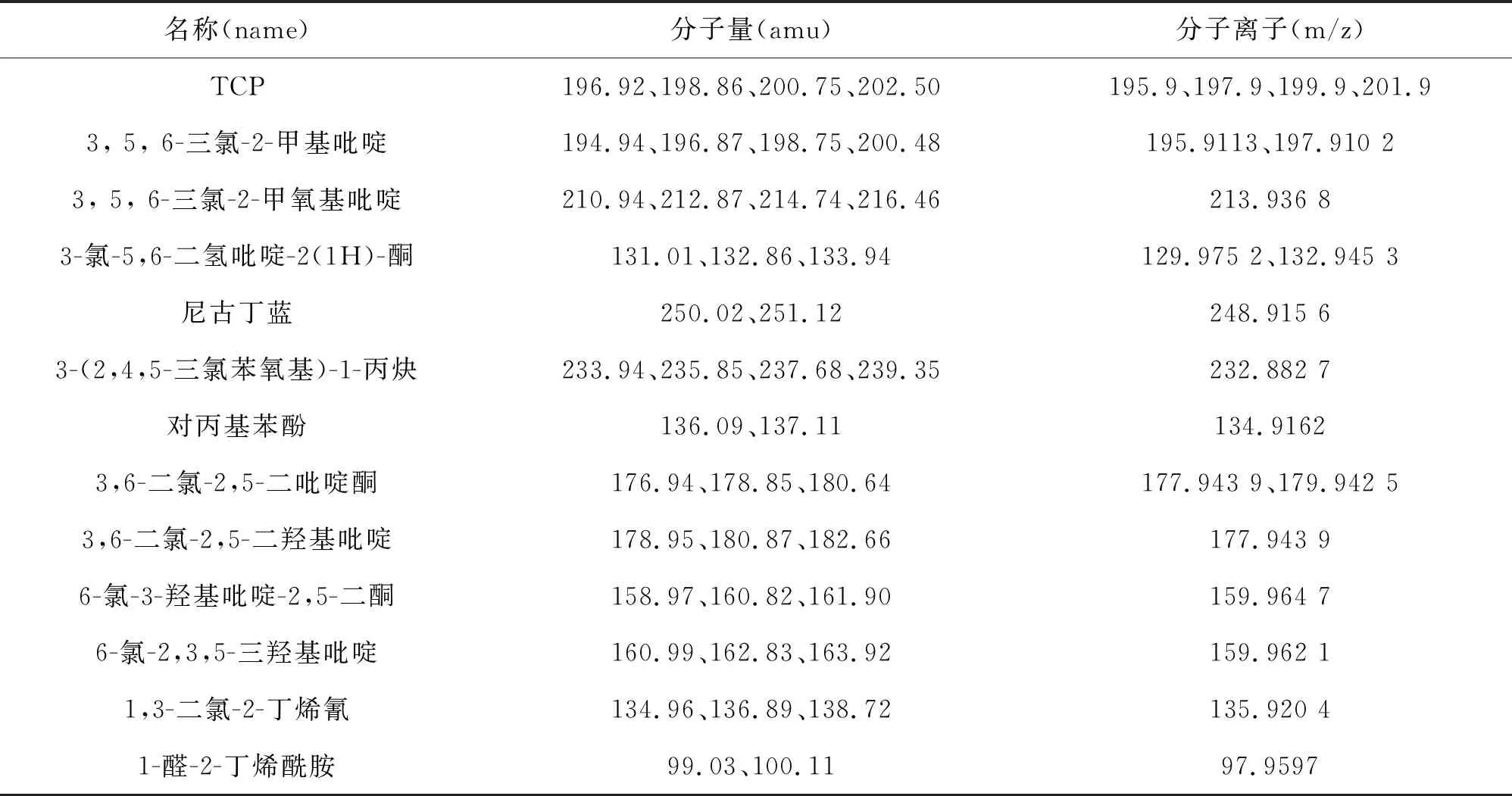
表1 菌株DFT的TCP代谢产物分析

图4 菌株DFT降解TCP过程中中间代谢产物的高效液相色谱分析
其中TCP的去质子化分子离子在m/z=195.913 2 (M-H)-、197.910 2 (M-H)-、199.906 9 (M-H)-和201.903 3 (M-H)-〔图5(a)〕。去质子化分子离子在m/z=195.911 3 (M-H)-和m/z=197.910 2 (M-H)-处的产物被鉴定为3,5,6-三氯-2-甲基吡啶〔图5(b)〕、m/z=213.936 8 (M-H)-处的产物被鉴定为3,5,6-三氯-2-甲氧基吡啶〔图5(c)〕。这两种代谢产物被鉴定为TCP烷基化反应的代谢产物,最终这两种产物被进一步转化为CO2[14]。
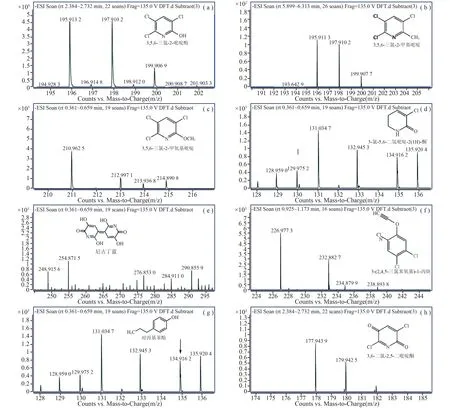
注:(a) TCP; (b) 3, 5, 6-三氯-2-甲基吡啶; (c) 3, 5, 6-三氯-2-甲氧基吡啶; (d) 3-氯-5,6-二氢吡啶-2(1H)-酮; (e) 尼古丁蓝; (f)3-(2,4,5-三氯苯氧基)-1-丙炔; (g) 对丙基苯酚; (h) 3,6-二氯-2,5-二吡啶酮; (i) 3,6-二氯-2,5-二羟基吡啶; (j) 6-氯-3-羟基吡啶-2,5-二酮; (k) 6-氯-2,3,5-三羟基吡啶; (l) 1,3-二氯-2-丁烯氰; (m) 1-醛-2-丁烯酰胺
m/z=129.972 5 (M-H)-和132.945 3 (M-H)-处的产物被鉴定为3-氯-5,6-二氢吡啶-2(1H)-酮〔图5(d)〕、m/z=248.915 6 (M-H)-处的产物被鉴定为尼古丁蓝〔图5(e)〕。这些代谢产物被鉴定为菌株Cupriavidussp. DT-1的TCP还原脱氯代谢产物[21]。
去质子化分子离子在m/z=232.882 7 (M-H)-处的产物被鉴定为3-(2,4,5-三氯苯氧基)-1-丙炔〔图5(f)〕。去质子化分子离子在m/z=134.916 2 (M-H)-处的产物被鉴定为对丙基苯酚〔图5(g)〕。这两种代谢产物曾在菌株BacillusthuringiensisMB497代谢TCP的过程中有报道[25]。
去质子化分子离子在m/z=177.943 9 (M-H)-和m/z=179.942 5 (M-H)-处的产物被鉴定为3,6-二氯-2,5-二吡啶酮〔图5(i)〕或3,6-二氯-2,5-二羟基吡啶〔图5(h)〕、m/z=159.964 7 (M-H)-和m/z=159.962 1 (M-H)-处的产物被鉴定为6-氯-3-羟基吡啶-2,5-二酮〔图5(j)〕或6-氯-2,3,5-三羟基吡啶〔图5(k)〕、m/z=135.920 4 (M-H)-处产物被鉴定为1,3-二氯-2-丁烯氰〔图5(l)〕、m/z=97.959 7 (M-H)-处产物被鉴定为1-醛-2-丁烯酰胺〔图5(m)〕。这些代谢产物在菌株CupriavidusnantongensisX1T、Ralstoniasp. T6、Cupriavidussp. P2降解TCP过程中被发现[4,20,22]。
2.4 TCP代谢途径推测
根据上述质谱结果,初步推测菌株DFT可能存在四种TCP的降解方式(图6)。第一种是烷基化途径,在菌株DFT降解TCP过程中,发生烷基化反应,生成3, 5, 6-三氯-2-甲基吡啶或3, 5, 6-三氯-2-甲氧基吡(图6 ①),最终转化为CO2[14]。第二种是反硝化途径,菌株DFT代谢TCP生成3-(2,4,5-三氯苯氧基)-1-丙炔和对丙基苯酚(图6②),最终对丙基苯酚被矿化生成CO2和H2O。 目前研究发现,BacillusthuringiensisMB497在代谢TCP的过程中也存在这种代谢方式[25]。第三种是还原脱氯途径,菌株DFT将TCP还原脱氯为3-氯-5,6-二氢吡啶-2(1H)-酮,并最终转化为尼古丁蓝被降解(图6③)。菌株DFT的这种TCP降解方式与Cupriavidussp. DT-1菌株对TCP的降解途径相似[21]。 第四种是水解-氧化脱氯途径,菌株DFT通过水解及氧化脱氯依次将TCP转化为 3,6-二氯-2,5-二吡啶酮、3,6-二氯-2,5-二羟基吡啶、6-氯-3-羟基吡啶-2,5-二酮、6-氯-2,3,5-三羟基吡啶、1,3-二氯-2-丁烯氰、1-醛-2-丁烯酰胺(图6④)。据文献报道,菌株CupriavidusnantongensisX1T、Ralstoniasp. T6、Cupriavidussp. P2、PseudomonasnitroreducensAR-3也通过水解-氧化脱氯代谢TCP[4,20,22,33]。

图6 菌株DFT降解TCP的四种可能代谢途径
2.5 菌株DFT对其它氯代吡啶类化合物的降解
菌株DFT不但能降解TCP,还能降解其它氯代吡啶类化合物。将菌株DFT接种在同时含有3,5-二氯-2-吡啶醇(50 mg/L)、6-氯-2-吡啶醇(25 mg/L)和2-羟基吡啶(50 mg/L)的无机盐培养液中,不同时间点取样,其降解情况如图7所示。在7天内,菌株DFT能够代谢45.4% 的3,5-二氯-2-吡啶醇(50 mg/L)、65.0%的6-氯-2-吡啶醇(25 mg/L)和38.0% 的2-羟基吡啶(50 mg/L)。随着时间的延长,3,5-二氯-2-吡啶酚和6-氯-2-吡啶醇被逐渐降解,在120 h后达到稳定。2-羟基吡啶在降解过程中浓度先增加后降低,推测可能是菌株DFT前期先脱氯降解3,5-二氯-2-吡啶酚和6-氯-2-吡啶醇过程中产生了2-羟基吡啶,从而导致2-羟基吡啶降解初期有明显积累,但随着降解时间延长,2-羟基吡啶浓度不断减低并被降解。以上结果表明,菌株DFT能够降解其他吡啶类化合物,具有明显的脱氯和降解吡啶环的能力。
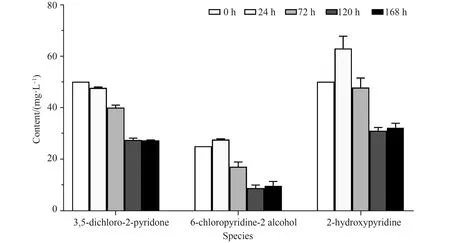
图7 菌株DFT降解其他氯代吡啶类化合物
3 讨论
3.1 Delftia菌属对环境污染物的修复性能
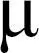
3.2 TCP的微生物代谢途径
不同的微生物对TCP的代谢途径不尽相同,据报道TCP主要有四条不同的代谢途径,分别是水解-氧化脱氯途径、还原脱氯途径、反硝化途径及烷基化途径[14,16,48-52]。目前文献已报道,微生物能通过烷基化途径降解TCP[14];Cupriavidussp. DT-1通过还原脱氯途径降解TCP[21];CupriavidusnantongensisX1T、Ralstoniasp. T6、Cupriavidussp. P2通过水解-氧化脱氯途径降解TCP[4,20,22];BacillusthuringiensisMB497通过反硝化途径降解TCP[25]。 上述报道仅发现在同一菌中,可能只存在一种TCP的代谢途径[4,6,8,25,26]。最近有研究报道BacillusthuringiensisMB497在代谢TCP过程中存在反硝化脱氯途径和脱氯酶和氧化酶参与的脱氯反应两种不同的TCP代谢方式[25]。还有研究发现,MicrococcusluteusML菌可能同时存在水解氧化脱氯和反硝化两种TCP代谢途径[16]。目前,关于TCP代谢途径的关键基因报道较少。Cao等人在CupriaviduspauculusP2的突变株文库中筛选到有关TCP降解的基因:单加氧酶基因(tcpAl)和黄素还原酶基因(tcpBl),共同催化了TCP的水解脱氯反应,最终生成3,6-二酮-2,5-二羟基吡啶[22]。Li等人从菌株Ralstoniasp. strain T6中得到两个TCP降解基因簇tcpRXA和dhpRIJK,其中tcpRXA基因簇编码产生的酶能够使TCP转化为3,6-二酮-2,5-二羟基吡啶,dhpRIJK编码产生的酶能够进一步转化为5-氨基-2,4,5-三氧戊酸,最终被矿化[20]。同样在菌株CupriavidusnantongensisX1T中tcpA和fre是降解TCP的两个关键基因,编码产生的酶能够催化化 3,6-二氯-2,5-二羟基吡啶的邻位和间位脱氯[4]。据文献调研,目前尚未见到关于TCP四种代谢通路中涉及的关键基因表达情况的任何分析报道,下一步的研究仍需要完善这些信息。
3.3 Delftia sp. DFT 降解TCP的代谢途径
在本研究中,我们通过代谢组学检测分析发现,菌株DFT降解TCP过程中既有部分烷基化反应代谢产物、部分反硝化反应代谢产物、部分还原脱氯代谢产物,还有比较完整的TCP水解-氧化脱氯代谢产物。基于菌株的代谢组学分析,我们初步推测四种不同的TCP代谢方式可能共同参与了菌株Delftiasp.DFT对TCP的生物降解。下一步可能还需要借助基因组和转录组学的数据进一步验证TCP的完整代谢通路。
4 结论
本研究分离鉴定了一株能降解TCP的Delftiasp.DFT,该菌株能在48 h内对50 mg/L的TCP降解率达34.28%,同时也能降解3,5-二氯-2-吡啶醇、6-氯-2-吡啶醇和2-羟基吡啶等其他氯代吡啶类化合物。TCP代谢途径分析表明,水解-氧化脱氯途径、还原脱氯途径、反硝化途径及烷基化反应可能共同参与了菌株DFT对TCP的降解。据文献调研,这是首次在Delftiasp. 菌中发现有四种可能的TCP代谢途径的报道,这为纯培养物中TCP降解机制的研究提供了新的参考信息。

