环糊精糖基转移酶JSL-1的鉴定及功能研究
李 茹,丁欣杰,商金海,秦林雪,魏 铠,王 月,李 攀
(聊城大学 药学院,山东 聊城 252059)
环糊精糖基转移酶(Cyclodextrin glycosyltransferase,CGTase)是α-淀粉酶家族的成员之一,属于水解酶类。CGTase具有多种功能,可以催化水解反应、环化反应、歧化反应以及偶合反应[1]。然而CGTase通常显示出较小的水解活性,主要催化环化、偶联和歧化这三种反式糖基化反应[2]。环化反应在工业上常用于环糊精的生产,是CGTase的特征性反应,通过催化淀粉类底物,将直链糖的还原性末端与非还原性末端通过α-1,4-糖苷键首尾相连形成环状的环糊精分子(Cyclodextrin, CD)[3]。大多数CGTase由各种微生物在细胞内产生,主要来源为芽孢杆菌[4]。
常见的环糊精分子有α-环糊精(α-CD)、β-环糊精(β-CD)以及γ-环糊精(γ-CD),分别具有6、7、8个葡萄糖基[5]。环糊精具有亲水性表面以及独特的疏水性空腔,能够溶于水,且承载疏水性的客体分子,进而改变客体分子的溶解性、稳定性等物理化学性质。因此,在化妆品、制药、食品、化学工业等领域都具有广泛的应用[6,7]。α-CD具有相对较小的内腔和对酶水解的高抗性,在食品工业中有着广泛的应用[8]。由于α-CD产量低、价格高,其市场占有率远低于其他CD[9]。目前,通过新酶筛选以及蛋白质工程,提高CGTase的生产性能,有望降低α-CD的生产成本,从而获得更实惠的α-CD[10]。
水稻是人类最主要的粮食作物之一,在解决全球粮食短缺问题中起着十分重要的作用[11]。随着生活质量不断提升,人们在饮食上的要求也逐渐提高,优质大米越来越受到消费者的认可和欢迎。目前我国大力推进优质水稻品种的培育和种植,旨在培育更优质、更受市场欢迎的水稻[12]。淀粉是水稻的主要组成部分,包括直链淀粉和支链淀粉,约占水稻干重的70%~80%,其中直链淀粉是影响水稻营养价值和品质的重要因素。一般来说,水稻中直链淀粉含量越低,水稻的外观品质以及食味品质更好[13,14]。直链淀粉含量在5%~15%的水稻属于低直链淀粉水稻,食品风味最佳,广受消费者喜爱;直链淀粉含量在15%~20%之间的水稻食味品质较好,也是市面上最常见的水稻种类;而直链淀粉含量大于20%的水稻食味品质较差[15]。因此,进一步深入研究水稻直链淀粉的影响因素及其作用机制,有利于水稻品质的改善,同时对优质稻米品种培育以及水稻经济价值的提高都具有重要的意义。
本研究通过克隆B.toyonensisP18中环糊精糖基转移酶基因JSL-1,构建原核表达载体及植物过表达载体,获得纯化酶蛋白及JSL-1转基因水稻株系,对其酶活力、产物特异性、酶学性质以及JSL-1与水稻淀粉品质的关系进行了研究,为JSL-1的工业化生产以及稻米品质的改良提供了参考依据。
1 材料与方法
1.1 材料与试剂
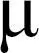
1.2 仪器与设备
Arhat 96梯度PCR仪购自上海创未生物技术有限公司;LDZM-60KCS立式压力蒸汽灭菌锅购自上海申安医疗机械厂;XM-1000T一体式超声波细胞破碎仪购自小美超声仪器(昆山)有限公司;DC-0506低温恒温槽购自江苏天翎仪器有限公司;K2025高效液相色谱系统购自海能未来技术集团股份有限公司;Bio-TekELX800酶标仪购自山东博科再生医学有限公司;JJ-2高速组织捣碎匀浆机购自上海达洛科学仪器有限公司;5810R高性能通用台式离心机购自赛默飞世尔科技(上海)有限公司;T700AS紫外可见分光光度计购自北京普析通用仪器有限责任公司;CL-60T超声波清洗机购自济南通海机械设备有限公司;PHS-3C pH计购自上海精密科学仪器有限公司;BJPX-SGT10恒温摇床购自济南泰医生物技术有限公司。
1.3 方法
1.3.1 pGEX4T-JSL-1原核表达载体构建及重组菌鉴定。JSL-1基因序列可从NCBI数据库中查阅,登录号为CP064876.1,由南京金斯瑞生物科技有限公司完成基因合成。根据JSL-1全长cDNA序列设计引物,正向引物序列5′-tccgcgtggatccccgaattcATGAAAGAAAAAGATAGGCTTAAATTTAG-3′(含有EcoR I酶切位点);反向引物序列5′-gatgcggccgctcgagtcgacTTAAGTCTCAACCAGGATAGTTTTTT-3′(含有SalI酶切位点)。以pGEX4T为蛋白表达载体,酶切后载体片段与JSL-1全长序列进行连接,得到重组质粒pGEX4T-JSL-1,通过热激法转化到大肠杆菌DH5α感受态细胞中,涂布至含Amp+的抗性LB培养基,于37℃恒温培养箱放置过夜,挑选阳性克隆并提取质粒进行酶切验证,随后送至北科基因检测(山东)有限公司测序,测序正确的质粒转化到BL21(DE3)感受态细胞,37 ℃放置过夜,挑取单菌落再次验证后进行保菌[16]。
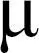
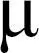
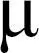
1.3.5 最适pH、最适温度测定。最适pH测定:为了测定JSL-1的最适pH,配制摩尔浓度为0.05 mol /L的甘氨酸-氢氧化钠缓冲液,利用酸度计调节缓冲液至不同pH(4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0、12.0),在不同pH的反应体系中分别进行酶促反应,测定JSL-1的酶活力,将最高酶活力定为100%,分别计算各体系中JSL-1的相对酶活力,从而确定最适反应pH值[19]。
最适温度测定:在最适pH条件下,分别将不同反应体系置于20、30、40、50、60、70 ℃进行酶促反应,测定JSL-1的酶活力,将酶活性最高者定义为100%,计算相对酶活力,从而确定该酶的最适温度[20]。
1.3.6 转基因水稻的获取。稻米中淀粉含量是影响稻米品质的重要因素,为了进一步探讨JSL-1与稻米淀粉的关系,参考温莉娴[21]的博士毕业论文进行转基因水稻的获取。首先,构建正义表达载体,以获取的JSL-1基因为模板进行基因扩增。正向引物为5′-caggtcgactctagaggatccATGAAAGAAAAAGATAGGCTTAAATTTAG-3′(含有BamH I酶切位点),反向引物为5′-cgatcggggaaattcgagctcTTAAGTCTCAACCAGGATAGTTTTTT-3′(含有SacI酶切位点)。用限制性内切酶BamH I和SacI对目的基因及植物双元载体pCAMIBA3300进行双酶切。将载体和目的片段相连接并鉴定出正确的阳性克隆质粒,然后采用电转化法将质粒转化到根癌农杆菌EHA105菌株中,然后侵染野生型日本晴水稻胚性愈伤组织,选择相对表达量较高的愈伤组织进行下一步实验[22,23]。经三代培养获得纯合转基因水稻。
1.3.7 稻米淀粉提取。称取10 g稻米,干燥后置于0.14%亚硫酸氢钠水溶液中,固液比为1∶5,浸泡过夜。研磨稻米至糊状,于200目尼龙网过滤后收集到15 mL离心管,冲洗尼龙网两次,将冲洗的溶液也加入离心管,3 000 r/min离心20 min,弃去上清液。超纯水吹打沉淀,使得沉淀悬浮,3 000 r/min再次离心20 min,弃上清。重复上一步骤三次,将沉淀置于烘箱中快速烘干,粉碎机粉碎后过100目筛,即得水稻淀粉[24,25]。
1.3.8 直链淀粉含量测定。绘制标准曲线:四个标准直链淀粉含量分别为1.5%、10.4%、17.5%、26.5%。准确称取四种直链淀粉标准品各100 mg,各标准品中依次加95%的无水乙醇1 mL和1 mol/L氢氧化钠溶液9 mL,煮沸20 min至样品完全溶解,冷却后定容至100 mL。分别吸取5 mL改性淀粉样品溶液,依次加入1 mol/L冰醋酸1 mL和0.2%的稀碘液2 mL,定容至100 mL,静置20 min后,在620 nm处测吸光度。以四个直链淀粉浓度为横坐标,吸光度为纵坐标绘制标准曲线。
含量测定:准确称取各株系水稻淀粉样品各100 mg,操作步骤同上。根据各样品测得的吸光度和直链淀粉标准曲线,计算直链淀粉含量[26,27]。
1.3.9 淀粉透光率、冻融稳定性及淀粉糊老化程度测定。淀粉透光率测定:首先配制1%的水稻淀粉溶液:准确称取0.2 g水稻淀粉,加入20 mL蒸馏水并混匀,恒温水浴锅95 ℃振荡20 min用于淀粉糊化,取出后静置冷却30 min,620 nm处测吸光度,4 ℃放置24 h,620 nm处再次测定吸光度[28]。
淀粉冻融稳定性测定:取淀粉透光率测定时处理的淀粉糊,分装至做好标记的离心管中,称量离心管和淀粉糊的质量,放入冰箱中,-20 ℃冷冻24 h后取出,室温下解冻后进行离心,设置为3 000 r/min,离心20 min后去水并称量沉淀的质量,然后计算析水率[29]。析水率按公式进行计算:析水率=(糊重-沉淀)/糊重×100%。
淀粉糊老化程度测定:取处理后的淀粉糊进行分装,并做好标记,放入4 ℃冰箱中,每隔一定时间取出,记录上清液的体积,直至上清液体积不再发生变化,根据上清液的体积变化率反应水稻淀粉老化程度[30]。
1.4 数据分析
所有实验均进行三次独立的生物学重复,数据统计及图表绘制均利用Microsoft Office Excel 2010完成。差异显著*P<0.05,差异极显著**P< 0.01。
2 结果与分析
2.1 重组JSL-1-pGEX4T表达载体构建
结果如图1所示,泳道S1与S2在2085 bp处有显示条带,将其进行胶回收后,连接到中间载体PBSK中,送测序,发现100%测序正确,表明JSL-1基因被成功克隆。为了将其连接到原核表达载体pGEX4T中,我们将JSL-1-PBSK进行双酶切后,泳道S3与S4在2 958 bp与2 085 bp各有一条带,其中2 958 bp为PBSK载体条带,2 085 bp为基因JSL-1片段。将泳道S3、S4中2 085 bp胶回收,经过基因重组后,连接到pGEX4T中,菌液PCR验证,泳道S5与S6在2 085 bp处有显示条带。提取JSL-1-pGEX4T重组质粒,进行双酶切,泳道7与8在4 969 bp与2 085 bp各有一条带,其中4 969 bp为pGEX4T载体条带,2 085 bp为基因JSL-1片段,表明挑取的JSL-1-pGEX4T-BL21重组菌株为阳性,重组质粒JSL-1-pGEX4T已成功转化到感受态细胞BL21(DE3)中。

注:泳道M为DNA marker;泳道S1、S2为基因JSL-1 PCR扩增条带;泳道S3、S4为质粒JSL-1-PBSK双酶切片段;泳道S5、S6为PCR扩增JSL-1-pGEX4T阳性菌液;泳道S7、S8为JSL-1-pGEX4T重组质粒双酶切片段。红色方框中为目标片段JSL-1。

注:泳道M为蛋白marker;泳道S1为诱导温度20 ℃,IPTG 浓度1.0 mmol/L,诱导时间3 h;泳道S2为诱导温度20 ℃,IPTG 浓度 1.0 mmol/L,诱导时间24 h时;泳道S3为诱导温度20 ℃,IPTG 浓度0.5 mmol/L,诱导时间24 h;泳道S4为诱导温度20 ℃,IPTG 浓度 0.0 mmol/L,诱导时间24 h。红色方框为目标蛋白JSL-1。
2.2 重组JSL-1-pGEX4T蛋白表达和纯化
为了获得重组JSL-1-pGEX4T蛋白,经过反复摸索,发现在诱导温度为20 ℃,IPTG浓度为1.0 mmol/L,诱导时间为24 h时,目的蛋白条带为68.6 kua(泳道S2),未诱导对照组无明显蛋白条带(泳道S4),表明JSL-1基因诱导表达成功(图 2)。
2.3 产物特异性分析
通过分析环糊精糖基转移酶JSL-1与1%可溶性淀粉反应产物的类型及生成量,从而确定该酶的产物特异性。由图3可知,该酶的主要产物为α-CD,在60 min时产量达到最高,约为1.05 g/L,随后α-CD的产量随着时间推移而呈现下降趋势。β-CD和γ-CD为该酶催化生成的次产物,且β-CD产量高于γ-CD的产量。反应进行到60 min时,淀粉环化率约为33%,其中产生的α-CD占总CD的67%。说明环糊精糖基转移酶JSL-1主要催化淀粉进行环化反应生成α-CD。
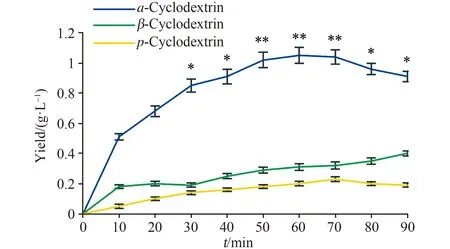
注:*P<0.05,**P<0.01;n=3。 Note: *P<0.05, **P<0.01; n=3.
2.4 JSL-1最适pH及最适温度
pH对于酶催化活性有较强的影响。在pH 4.0~12.0的范围内测定JSL-1的最适反应pH,从图4(a)中可以看到,在pH 4.0~8.0的范围内,JSL-1酶活力不断上升,随后酶活力随着pH的升高而不断降低。JSL-1的最适pH为8.0,在此pH下JSL-1催化淀粉生成环糊精的能力最强,即环化能力最强。
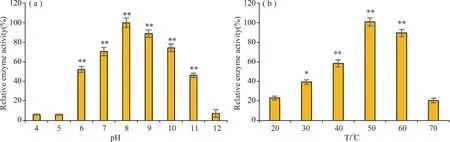
注:*P<0.05,**P<0.01;n=3。 Note: *P<0.05, **P<0.01; n=3.
在最适pH条件下,在20~70 ℃的范围内测定JSL-1的最适反应温度。从图4(b)中可以得知,在20~50 ℃温度范围内,酶活力随着温度的上升而增加,随后JSL-1的酶活力随着温度的上升而逐渐下降,最终失活,这表明温度过高不利于JSL-1进行环化反应。50 ℃时酶活力达到最大,为该酶最适反应温度,且在45~60 ℃范围内均有较高的相对酶活力,相对酶活力保持在近80%以上。
2.5 JSL-1转基因水稻获取
构建好植物过表达载体后通过农杆菌转化法侵染日本晴水稻,卡那霉素三代筛选获得转基因纯合水稻株系。对各转基因水稻株系通过qRT-PCR验证JSL-1基因的相对表达水平(图5),并选择JSL-1表达量较低的OE3株系、表达量适中的OE7株系、以及表达量较高的OE12株系进行下一步研究。
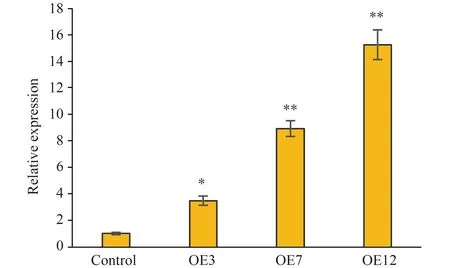
注: *P<0.05, **P<0.01; n=3. Note: *P<0.05, **P<0.01; n=3.
2.6 直链淀粉含量测定
直链淀粉标准曲线绘制结果如图6(a)所示,标准曲线回归方程为y=0.013 3x+0.066 6,线性相关系数为R2=0.998 9,其中x代表直链淀粉含量(%),y代表620 nm处的吸光度(Abs),从图中可以看出,吸光度和直链淀粉含量具有良好的线性关系。各株系直链淀粉含量如图6(b)所示,其中野生型水稻的直链淀粉含量达到18.2%,OE3直链淀粉含量为14.7%,OE7直链淀粉含量为12.8%,OE12直链淀粉含量为10.9%。随着JSL-1基因表达水平上升,直链淀粉含量下降,逐渐向低直链淀粉水稻发展。可能是由于环糊精糖基转移酶JSL-1发生环化反应,催化水稻中的直链淀粉生成环糊精,从而造成水稻中直链淀粉含量下降。
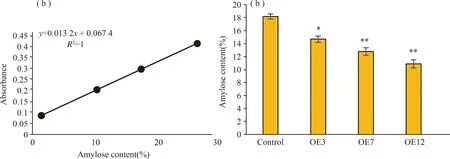
注: *P<0.05, **P<0.01; n=3. Note: *P<0.05, **P<0.01; n=3.
2.7 淀粉透光率、冻融稳定性、老化程度测定
用淀粉透光率来表示转基因水稻淀粉的透明度,结果如图7(a)所示。随着JSL-1基因表达量的增加,淀粉的透光率也增加。淀粉的透光率受直链淀粉含量影响,直链淀粉含量越高,淀粉容易发生凝沉从而造成透光率下降[31]。淀粉透光率越高,淀粉亮度越好。因此,随着JSL-1基因表达量增加,水稻淀粉溶液外观品质越好。
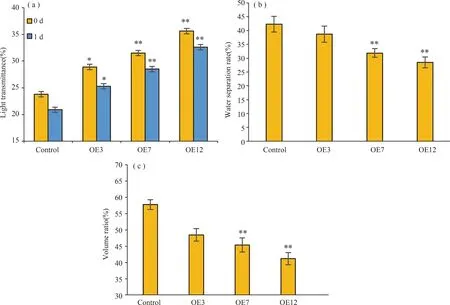
注: *P<0.05, **P<0.01; n=3. Note: *P<0.05, **P<0.01; n=3.
如图7(b)所示,转基因水稻淀粉冻融稳定性用淀粉的析出率来表示,析出率越高代表淀粉冻融稳定性越差。随着JSL-1基因表达量的上升,淀粉析出率下降。也就是说淀粉冻融稳定性随着JSL-1基因的表达量的增加而增加。通过以往的研究可知,淀粉冻融稳定性增加,可以提高水稻在低温储存中的稳定性,以及其加工食品冷藏时的稳定性。因此提高水稻中JSL-1的表达量有利于水稻淀粉在低温中保存。
各株系水稻淀粉上清液体积比如图7(c)所示,转基因水稻淀粉老化程度用淀粉上清液体积比来表示,体积比越高代表淀粉老化程度越高。随着JSL-1基因表达量的增加,上清液的体积比减小,淀粉老化程度下降。这与JSL-1基因表达量对淀粉透光率以及冻融稳定性影响结果相一致。老化是淀粉最常见的性质之一,也是导致食品老化的重要原因,老化后的淀粉会变浑浊,严重影响食品的外观品质,存放质量以及口感风味等。因此,JSL-1基因表达量越高,越有利于水稻淀粉及其加工食品货架期的延长。
3 结论
本项研究克隆了来源于B.toyonensisP18环糊精糖基转移酶基因JSL-1,并对其功能进行了初步研究。结果表明JSL-1主要催化直链淀粉生成α-CD,该酶最适pH为8.0,最适温度为50 ℃。由于环糊精在食品、药品、化妆品等多个领域有着广泛的应用,因而对JSL-1的产物特异性及酶学性质具有一定研究意义。在转基因水稻株系中,随着JSL-1基因表达水平的增加,水稻中直链淀粉含量增加,水稻淀粉透光率、冻融稳定性增加,水稻淀粉老化程度下降。已有研究表明,水稻中直链淀粉含量与水稻的食味品质成负相关,决定系数高达92%。因此JSL-1转基因水稻不仅可以提高水稻的食味品质,同时可以改善水稻的外观品质以及冷藏存储的稳定性。对环糊精糖基转移酶JSL-1的一系列研究为将来提高催化产物的专一性以及环糊精的生产工艺的改良奠定了基础,同时为对低直链淀粉水稻的育种提供了优质的基因资源,为水稻品质的改良提供了新的思路。

