生物法合成熊去氧胆酸研究进展
张 雪,张 悦,刘梦雨,栾浩妮,宋 鹏,周正松,王 飞,徐 伟
(1.聊城大学 生命科学学院,山东 聊城 252059;2. 山东奥克特生物科技有限公司, 山东 聊城 252800)
0 引言
熊去氧胆酸(UDCA)是一种内源性胆汁酸,具有溶解胆结石,治疗胆汁淤积、胆源性胰腺炎、原发性胆管炎、结肠炎(癌)、(非)酒精性肝炎、原发性胆汁性肝硬化、药物性肝炎和改善肝移植效果的作用[1]。最新研究发现,UDCA还可介导并影响癌症基因组中致癌信号通路调控,用于癌症治疗[2];可特异性调控细胞凋亡阈值,诱导细胞自噬和凋亡,抑制癌细胞生长[3];在治疗进行性神经系统疾病时,UDCA还能够改善受损线粒体功能,发挥神经保护作用[4]。新冠期间,UDCA还被证实具有降低新冠感染率和重症率的临床效果[5]。
UDCA是从北极熊胆汁中发现的一种天然活性产物,1902年由Hammarsten命名,后续研究证实,UDCA与其它内源性胆汁酸相比,在治疗胆囊和肝脏疾病方面表现出更好疗效。目前,UDCA是美国食品和药物管理局(FDA)唯一批准治疗原发性胆汁性肝硬化的药物。生物法合成UDCA相对于化学合成具有绿色、高效和安全等特点。因此,利用胆汁酸类底物生物合成UDCA逐渐成为研究发展方向。生物法合成UDCA主要有游离酶催化合成和全细胞合成[6]。游离酶催化合成以鹅去氧胆酸(CDCA)或胆酸(CA)为底物,通过多酶级联催化合成UDCA;全细胞合成是在微生物培养过程中加入CDCA或石胆酸(LCA)底物,利用微生物全细胞催化将底物转化为UDCA。
1 游离酶催化合成UDCA
游离酶催化合成UDCA以CDCA、CA或者LCA为出发底物,其中大部分研究主要集中在CDCA和CA。一方面,CDCA和CA来自家禽(鸡、鸭、鹅)和牛胆汁,原料资源丰富,价格便宜;另一方面,CDCA和CA转化合成UDCA使用的羟基类固醇脱氢酶催化效率高,而目前真正实现全过程酶催化合成UDCA的只有底物CDCA。
1.1 CDCA底物合成UDCA
CDCA C-7羟基差向异构化后即转化为UDCA。以CDCA为底物合成UDCA涉及两种关键酶:7α-羟基类固醇脱氢酶(7α-HSDH)和7β-羟基类固醇脱氢酶(7β-HSDH)。7α-HSDH催化CDCA氧化脱氢生成7-酮石胆酸(7-KLCA),7β-HSDH进一步催化7-KLCA加氢还原生成UDCA,如图1所示。
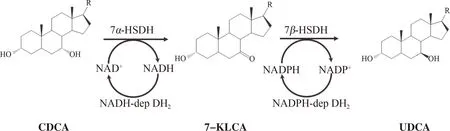
注:R=4-戊酸;蓝色方框:C-7羟基。 Note: R= 4-valeric acid; Blue box: C-7 hydroxy.
7α-HSDH和7β-HSDH同属短链脱氢酶/还原酶(SDR)家族,早期发现的7α-HSDHs大部分从好氧菌或厌氧菌中分离得到。近年来,通过同源比对[7-9]或宏基因组学方法[10]从黑熊粪便中发现的7α-HSDH数量较多,已报道的7α-HSDHs如表1所示。
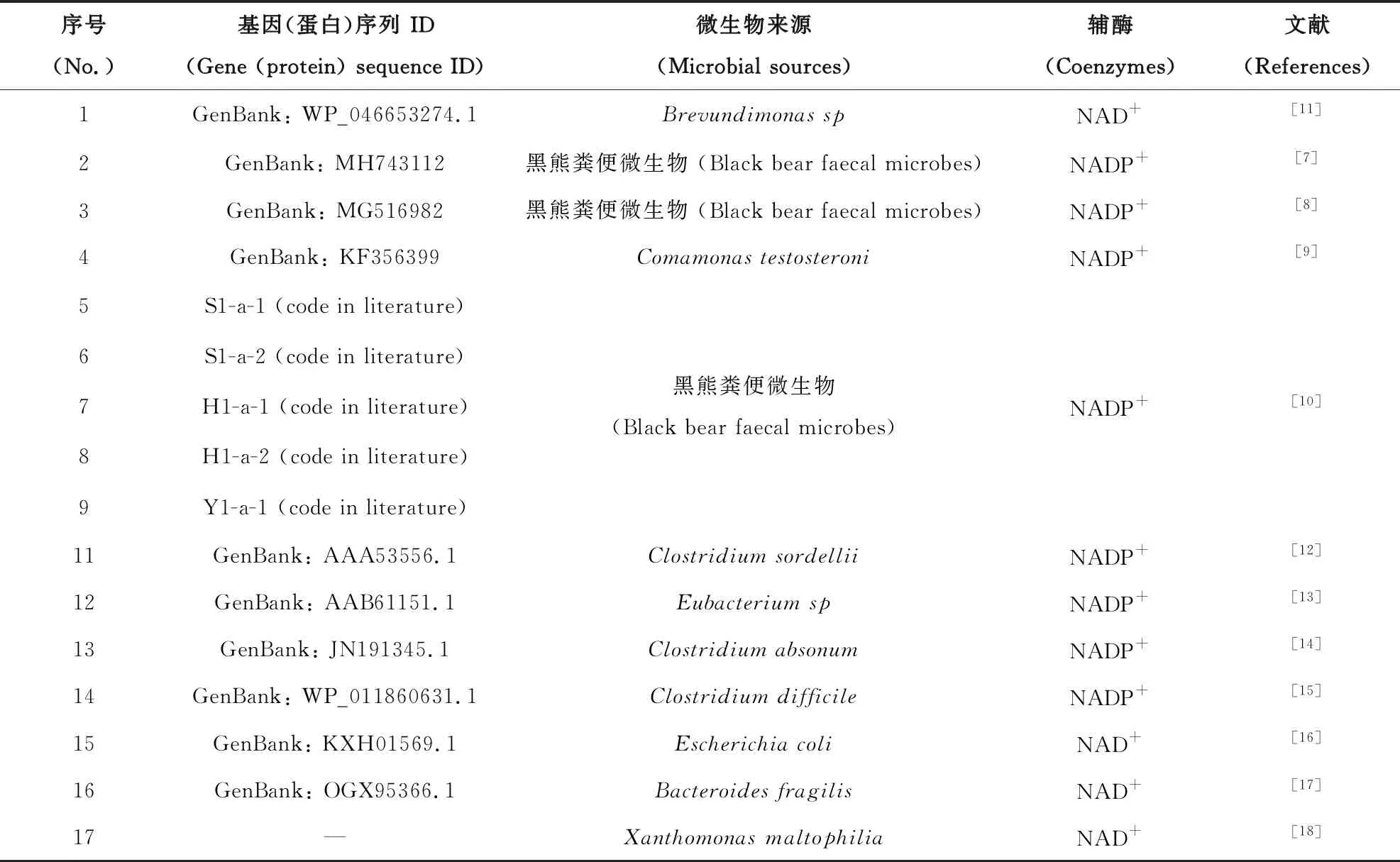
表1 已报道的7α-HSDH
除了上述功能验证的7α-HSDHs,在NCBI RefSeq数据库中搜索“7-α-hydroxysteroid dehydrogenase”关键词,已能搜寻到1 200多个条目。
与7α-HSDH不同,用于生物转化的7β-HSDH报道数量较少,如表2所示,而且7β-HSDH的比酶活和酶稳定性都较差[19,20],只有一个来源于野生型Clostridiumabsonum的7β-HSDH用于UDCA工业化合成工艺中[21,22];7β-HSDH几乎都以NADPH为辅酶,目前为止,只发现四种NAD+依赖性7β-HSDH:蛋白序列已报道的三种分别来自Lactobacillusspicheri[23]、Roseococcussp.[24]和CandidatusLigilactobacillus[25];另一种蛋白序列鲜见报道的来自Xanthomonasmaltophilia[18]。
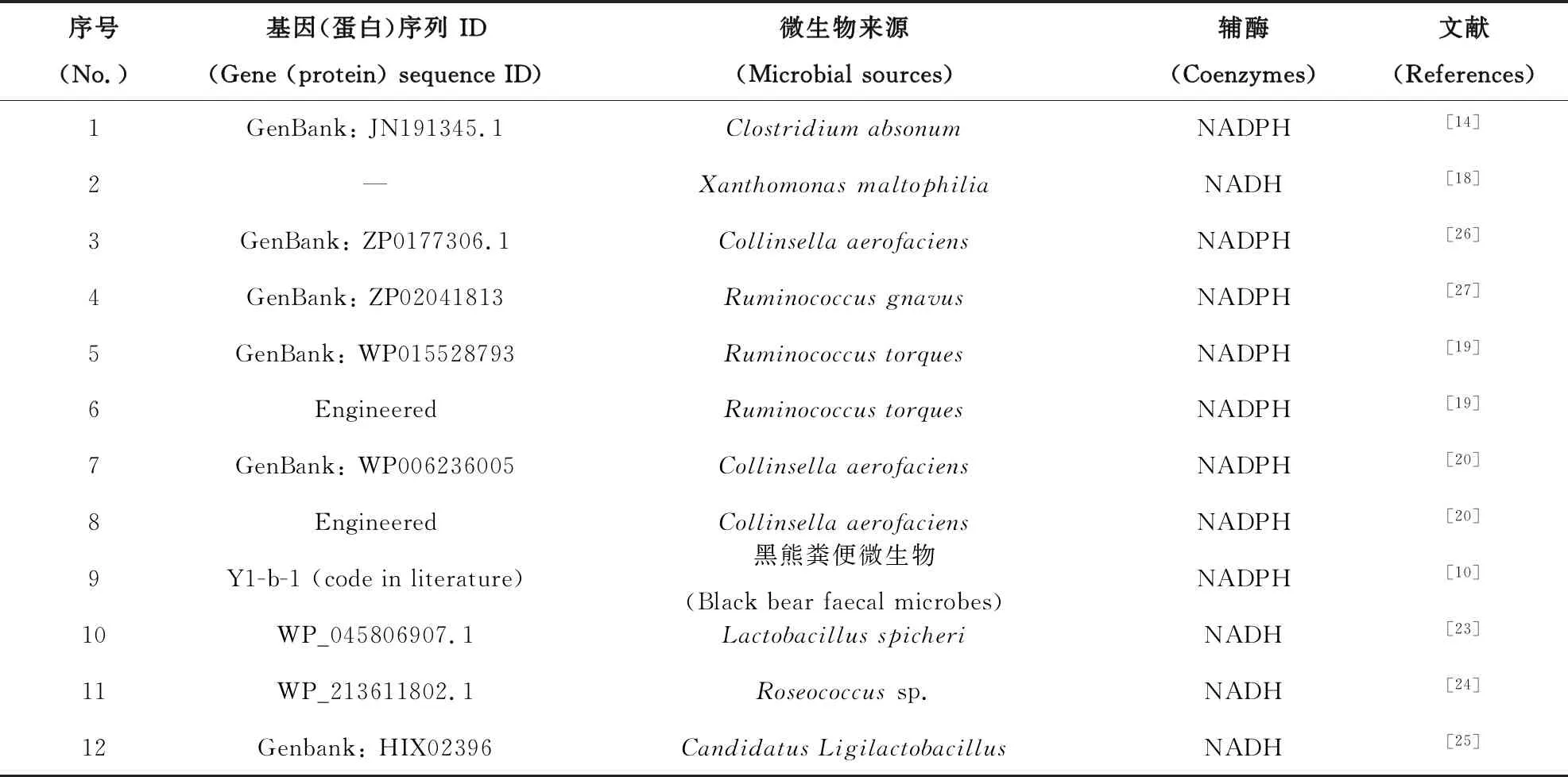
表2 已报道的7β-HSDH
1.2 CA底物合成UDCA
CA是目前最丰富和最便宜的胆汁酸,CA广泛存在于牛、羊、猪的胆汁中,其中牛胆汁中含量最为丰富,1 000 mL牛胆汁中胆酸含量达到44 g。从CA合成UDCA有四条路径[28],如图2所示,但每条路径均需要借助Wolff-Kishner反应还原中间产物的C-12羰基为亚甲基[29],所以,目前尚无法实现以胆酸为底物全过程生物合成UDCA。
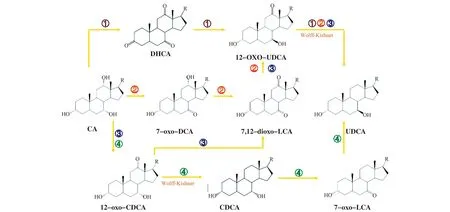
注:DHCA:脱氢胆酸;12-oxo-UDCA:12-酮-熊去氧胆酸;CA:胆酸;7-oxo-DCA:7-酮-石胆酸;7,12-dioxo-LCA: 7,12-酮石胆酸;UDCA:熊去氧胆酸;12-oxo-CDCA:12-酮-鹅去氧胆酸;CDCA:鹅去氧胆酸;R=4-戊酸 ①:合成路线1;②:合成路线2;③:合成路线3;④:合成路线4。
1.3 LCA底物合成UDCA
LCA也存在于牛、羊和猪等养殖动物的胆汁中,是肉类加工产业丰富、廉价的副产物。从结构式观察,以LCA为底物合成UDCA,仅需实现LCA C-7羟基化即可,如图3所示。

图3 P450单加氧酶催化LCA生成UDCA
P450单加氧酶能够催化这一反应,然而P450单加氧酶在实际应用中面临诸多挑战:其利用O2的催化过程高度依赖辅因子NAD(P)H和还原伴侣蛋白复合体,复杂的蛋白复合物构造降低了P450单加氧酶的稳定性和催化效率。目前,只有少数微生物可以将LCA转化成UDCA,而通过游离P450单加氧酶催化LCA合成UDCA,只有Grobe等报道的一个工程化细胞色素P450单加氧酶OleP[30]。
1.4 游离酶催化UDCA合成的方式
以CDCA为底物,采用游离酶催化合成UDCA是现今最具发展潜力的生物合成方法,其在成本、转化率和技术成熟度上相较于其它两种底物优势明显。以CDCA为底物合成UDCA一般采用“一锅两步法”和“一锅一步法”。
“一锅两步法”采用分步反应:第一步,7α-HSDH催化CDCA生成7-KLCA,反应完成后灭酶(或与第二步反应实现空间隔离),第二步,添加7β-HSDH,催化7-KLCA生成UDCA。“一锅两步法”转化率高;但承载底物浓度低,效率低,耗时长[31,32]。“一锅一步法”将7α-HSDH、7β-HSDH、底物和其它辅料一并加入反应釜进行反应。“一锅一步”法承载底物浓度高;因为中间步骤无需升温、降温,所以效率高,节省能源;但受限于酶的反应平衡,底物转化率低,后续纯化工艺复杂[31,32]。
为了提高羟基类固醇脱氢酶的使用效率,无论采用“一锅两步法”还是“一锅一步法”,都可以对酶进行固定化后再使用。Yang等利用酶固定化技术提高了7a-HSDH和7β-HSDH的活性和热稳定性,共固定化在EP-0.5-C时,7a-HSDH和7β-HSDH的催化效率和重复使用性得到提高[33];Zheng等将7α-HSDH/乳酸脱氢酶(LDH)以及7β-HSDH/葡萄糖脱氢酶(GDH)分别固定在环氧树脂ES-103上制得固定化酶LDH-7αHSDH@ES-103和7βHSDH-GDH@ES-103,用于催化CDCA合成UDCA,并通过在两个连续填充床反应器中使用固定化酶实现了CDCA连续生产UDCA[32]。
1.5 UDCA合成酶的蛋白质工程
天然羟基类固醇脱氢酶由于活性差、存在底物抑制,难以满足工业应用要求,为了提高酶法合成UDCA的效率和转化率,蛋白质工程技术应用于UDCA合成酶的改造以提高酶的稳定性、活力、增强酶的高浓度底物耐受性,甚至用于改变酶的辅酶特异性从而降低生产成本。
Huang等采用定向进化和高通量筛选相结合的方法,提高了Clostridiumabsonum中7α-HSDH的催化效率和底物耐受浓度[34];Zheng等采用易错PCR、DNA shuffling和定点突变等技术定向进化来自Ruminococcustorques的7β-HSDH,改善了7β-HSDH的活性、热稳定性和最适pH[19];现已报道的7β-HSDH几乎都严格依赖于NADPH,然而,与NADPH相比,NADH更为廉价,是羟基类固醇脱氢酶合成UDCA的优先选择辅因子。You 等基于7β-HSDH酶的结构分析和保守序列比对,对源自Ruminococcustorques的重组7β-HSDH进行了工程设计,改变了其辅助因子依赖特异性[35]。
1.6 UDCA合成的辅酶再生策略
催化CDCA或CA合成UDCA的酶都属于羟基类固醇脱氢酶,这类酶的典型特征是反应都需要NAD(H)或者NADP(H)辅酶[36]。理论上,消耗多少底物就需要消耗等摩尔量辅酶,而这些辅酶往往价格昂贵,从经济角度考虑,加大辅酶用量是不可行的,因此,羟基类固醇脱氢酶在使用时必须提供高效、低成本的辅酶再生系统。UDCA酶法合成中的氧化型辅酶Ⅰ(NAD+)和还原性辅酶Ⅱ(NADPH)都是通过酶法再生,实现循环利用。Zheng等在以CDCA为底物两步法合成UDCA过程中以乳酸脱氢酶(LDH)和葡萄糖脱氢酶(GDH)分别作为NAD+和NADPH的再生酶[31];Liu等在将7-KLCA转化为UDCA时,用醇脱氢酶ADH-TE氧化异丙醇实现NADPH再生[26];Pedrini等用甲酸脱氢酶(ADH)实现辅酶循环用于合成熊果胆酸(UCA)和UDCA[18]; Zheng等在7-KLCA生成UDCA的过程中,使用GDH用于NADPH再生循环利用[32];秦和平等以L-苹果酸/苹果酸脱氢酶系统循环NAD+,用于还原7K-LCA生成UDCA[37];Chen等利用黄素氧化还原酶(FR)和黄素单核苷酸(FMN)为原料,建立了NAD+再生体系,又以醇脱氢酶和异丙醇为原料,建立了NADPH再生体系,在一个锅内实现了CDCA到UDCA的完全转化[11];Bovara等使用α-酮戊二酸/GLDH和葡萄糖/GDH系统实现了以胆酸为底物合成12-酮-UDCA[21];Sun等在全细胞催化DHCA合成12-酮-UDCA时,将3α-HSDH、7β-HSDH和GDH在同一大肠杆菌中共表达,GDH用于NAD(P)H再生[38];Carrea等在以CA为原料,用12α-HSDH合成12-酮-CDCA的过程中,将12α-HSDH和谷氨酸脱氢酶共固定化,谷氨酸脱氢酶用于NADP+再生,高效循环制备12-酮-CDCA[39];在化学-酶法制备UDCA的过程中,同样也可以使用LDH实现NAD+循环再生[40]。可用于NAD(H)和NADP(H)再生的辅酶有很多种,并各具特点(表3)。

表3 生物合成UDCA常用辅酶再生体系
2 全细胞合成UDCA
全细胞合成是一种具有诸多优势的新型催化模式,尤其在涉及多步酶催化反应,在合成诸多药物中间体等方向体现了巨大的应用前景和工业价值。全细胞合成UDCA的研究始于研究者发现野生微生物可以将CDCA或LCA转化为UDCA[50-52]。但野生微生物只能承载浓度极低的底物(微摩尔或几毫摩尔CDCA),底物浓度一旦增加,微生物生长受抑制,且转化率极低。2013年,Kollerov等又筛选了不同种属的放线菌和丝状真菌,考察它们转化LCA生成UDCA的能力,首次鉴定出10种可以直接将LCA转化成UDCA的微生物菌株[53]。CDCA全细胞合成UDCA示意图如图4所示。
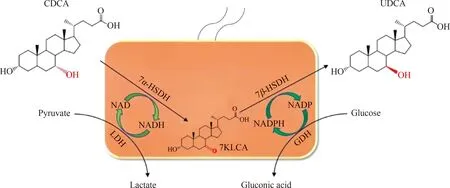
图4 CDCA全细胞合成UDCA示意图
某些微生物之所以可以将CDCA或LCA转化为UDCA,是因为微生物自身产生了相关的转化酶:将CDCA转化为UDCA的微生物自身产生7α-HSDH和7β-HSDH;将LCA转化为UDCA的微生物自身产生P450单加氧酶。这些微生物成为后期研究羟基类固醇脱氢酶或P450单加氧酶基因序列的重要来源。但野生微生物相关羟基类固醇脱氢酶表达量低,酶活性低,底物浓度增加后还会抑制菌体生长和转化。所以,相关细胞转化研究一度鲜有研究者问津。直到利用工程菌株,尤其是大肠杆菌异源表达相关羟基类固醇脱氢酶,并用这些工程菌转化CDCA合成UDCA取得了良好效果,相关全细胞催化研究才重新进入人们的视野。相较于游离酶催化,全细胞催化可以利用微生物细胞自身的辅酶再生体系,并省去了菌体破碎制酶步骤,从而显示出优势。对于LCA转化合成UDCA,因为受限于P450单加氧酶资源欠缺、反应条件苛刻,相关研究尚未取得突破性进展。
Shi等报道了整合7α-HSDH和7β-HSDH的大肠杆菌工程细胞将牛磺酸鹅去氧胆酸(TCDCA)转化为牛磺酸熊去氧胆酸(TUDCA),同样可以实现CDCA到UDCA的转化[54]。之后,他们又开发了深槽静态工艺,控制转化后的TUDCA与TCDCA比例与药材引流熊胆粉的比例相近,提供了一种利用微生物细胞工厂从鸡胆粉生产人工熊胆粉替代品的方法[55]。最近,该课题组又构建了表达两种酶的酿酒酵母宿主菌,从食品和药品安全的角度来看,酿酒酵母属于GRAS菌株,安全性相较于大肠杆菌更高[56]。
Sun等则实现了12-酮-UDCA的全细胞合成。12-酮-UDCA是UDCA化学-酶法合成的关键中间产物[38]。将3α-HSDH、7β-HSDH和来自Bacillussubtilis的葡萄糖脱氢酶(GDH)在同一株BL21(DE3)大肠杆菌细胞中共表达,构建了另一种单菌株全细胞催化系统,该体系在4.5 h内将DHCA转化为12-酮-UDCA的转化率大于99.5%。
3 结论与展望