自膨胀式瓣膜经导管主动脉瓣置换术后新发传导障碍的相关因素分析
王伟敏 孙玉喜 丁立成 王丽岚 许巧如 王斌
主动脉瓣狭窄(aortic stenosis,AS)是老年人群中常见的心脏瓣膜病,与年龄相关的退行性病变所致的钙化是AS最常见的病因之一,随着人口生存率的提高,其患病率亦不断增加[1]。我国主动脉瓣疾病患者与国外相比,有钙化负荷重、二叶式主动脉瓣(bicuspid aortic valve,BAV)比例高等特点[2]。主动脉瓣置换术(aortic valve replacement,AVR)是大多数AS患者治疗的金标准[3],既往主要治疗手段为外科主动脉瓣置换术(surgical aortic valve replacement,SAVR),对于基础疾病多,一般情况较差的老年患者,则无法行SAVR。2002年法国医师Cribier教授完成了第一例经导管主动脉瓣置换术(transcatheter aortic valve replacement,TAVR),为无法行SAVR的高危重度AS患者提供一种新的治疗策略[4]。目前,TAVR已成为退行性AS患者的一线治疗手段,PARTNER 3和Evolut Low Risk Trial两项随机试验[5-6]结果提示低风险重度AS患者TAVR后死亡、致残性脑卒中风险甚至低于SAVR组,基于上述两项研究的结果,TAVR的适用范围拓展至低风险重度AS患者。
厦门大学附属心血管病医院在临床实践中发现钙化瓣叶的分布在经导管心脏瓣膜(transcatheter heart valve,THV)释放后对传导系统存在不同的影响,遂回顾性分析主动脉瓣钙化定量和分布特点,以进一步了解其对新发传导障碍(new conduction disorder,NOCD)的影响。
1 对象与方法
1.1 研究对象
本研究连续纳入厦门大学附属心血管病医院2014年12月至2022年11月重度AS接受TAVR治疗的患者。纳入标准:(1)症状性AS患者,经胸超声心动图(transthoracic echocardiography,TTE)结果示主动脉瓣口流速≥4 m/s,跨瓣压差≥40 mmHg(1 mmHg=0.133 kPa),或主动脉瓣口面积≤1.0 cm2,多巴酚丁胺负荷试验联合TTE用于判断低流速、低压差AS患者;(2)完整的术前升主动脉根部CT血管造影(CT angiography,CTA)影像学资料,TTE报告,术前、术后心电图;(3)TAVR术中造影图像。排除标准:(1)基线12导联心电图提示高度或三度房室传导阻滞;(2)TAVR前植入永久性起搏器(permanent pacemaker implantation,PPM);(3)既往行主动脉瓣置换术病史(生物瓣或机械瓣,TAVR或SAVR)。所有患者均签署知情同意书。
1.2 研究内容
术前心电图:记录P R间期、Q R S间期、Q T间期、QTc等参数。根据国际瓣膜学术研究联盟(Valve Academic Research Consortium,VARC)3最新的定义[7],术后NOCD包括一度、二度、三度房室传导阻滞,左束支传导阻滞(left bundle branch block,LBBB),QRS间期>120 ms的心室内传导延迟;PPM植入的指征为高度房室传导阻滞、恶化或新发的LBBB、进行性的一度房室传导阻滞伴LBBB和症状性心动过缓[8]。2名心电图专家根据TAVR术后心电图判定是否存在NOCD。
术前T T E:记录主动脉瓣最大跨瓣压差、平均跨主动脉瓣压差、左心室射血分数(left ventricular ejection fraction,LVEF)。
术前心电门控计算机断层血管成像结果:将患者的CTA图像转入专门的工作站(3mensio Structural Heart TM,Pie Medical Imaging BV),由本中心影像科专家对升主动脉根部结构进行测算。收缩期主动脉根部尺寸较大,因此分析收缩期时的图像特征[9]。基于收缩期,影像科专家对升主动脉(主动脉瓣环平面上方40 mm)、窦管结合部、主动脉瓣环、左心室流出道(left ventricular outflow tract,LVOT;主动脉瓣环下方4 mm)、主动脉成角、膜部室间隔(membranous septum,MS)长度、冠状动脉开口高度、主动脉瓣钙化定量进行测算。装置着陆区被定义为主动脉瓣环、瓣叶和LVOT[10]。
主动脉瓣环被定义为在一个虚拟平面内与三个瓣叶底部最基本的附着点对齐的管腔轮廓[9]。主动脉成角定义为主动脉瓣环平面与水平面之间的角度[11]。基于“瓣叶重叠(cusp-overlap)”技术,在THV置入后的造影图像中测量邻近无冠窦的T H V置入深度。M S长度是指主动脉瓣环平面与肌部室间隔最高点的距离[12]。计算MS长度和THV置入深度的差值(ΔMSID)。主动脉瓣总钙化定量是主动脉瓣环到瓣叶尖端的区域。在三叶式主动脉瓣(tricuspid aortic valve,TAV)患者中,分别测量右冠瓣、左冠瓣、无冠瓣的钙化定量,同时计算无冠瓣和右冠瓣钙化定量之和,两者之和在全文中以“右-无冠瓣钙化定量”表示。在BAV患者中,因冠状窦、主动脉瓣分布的个体差异较大,尚无明确的钙化分区定量方法,工作站默认按照正常TAV冠状窦的位置自动将钙化区域三等分,分别为:右冠瓣区、无冠瓣区、左冠瓣区,同时计算各个区域的钙化定量。分别测量出上述四个平面的面积、周长、最大直径、最小直径,计算偏心率[EI,EI=(1-最小直径/最大直径)×100%],AL ratio是主动脉瓣环周长/LVOT周长的比值,周长oversize比例=(人工瓣膜流入道周长/主动脉瓣环周长-1)×100%,ΔMSID=(冠状位MS长度-THV置入深度)[12]。
根据主动脉瓣形态分为T A V 组和B A V 组,根据术后心电图特征将组别分为N O C D 组和无NOCD组,探究基线临床特征、升主动脉根部解剖特点及术后NOCD的相关因素。
1.3 统计学分析
本研究中所有数据均使用S P S S 2 6.0 和GraphPad Prism 8软件分析。使用Shapiro-Wilk检验连续性变量是否符合正态分布,符合正态分布的两样本比较使用独立样本t检验,结果用均数±标准差表示;不符合正态分布的连续性变量用Mann-WhitneyU检验,结果用中位数(四分位数间距)表示。分类变量结果用频数表示,根据样本量和理论频数使用对应的Pearson卡方、连续性校正卡方或者Fisher精确概率法检验。将自变量用进入法(enter)引入多因素回归模型中,通过二元Logistic回归分析自变量对NOCD的影响,在TAV组和BAV组患者中分别纳入右-无冠瓣钙化定量、左冠瓣钙化定量、主动脉成角、ΔMSID和术前PR间期、右冠瓣区钙化定量、ΔMSID构建多因素回归方程。所有统计检验都是双侧检验,以P<0.05为差异有统计学意义。
2 结果
本研究共纳入245例患者,排除53例临床资料缺失、5例术前植入PPM、20例接受球囊扩张式瓣膜置入的患者后,对剩余167例患者进行分析。其中,TAV组113例,BAV组54例,术后发生NOCD和无NOCD患者分别为59例和108例(图1)。

图1 纳入患者流程Figure 1 Incorporate into the patient process
在TAV组中,新发三度房室传导阻滞8例、新发一度房室传导阻滞11例、新发LBBB 30例、术后因NOCD接受PPM 10例,分别占TAV总人数的7.1%、9.7%、26.5%、8.8%,术后未见二度房室传导阻滞。有2例患者术后一度房室传导阻滞,同时合并新发LBBB,经评估后予PPM治疗(图2B)。在BAV中,一度房室传导阻滞3例、二度房室传导阻滞1例、新发三度房室传导阻滞4例、新发LBBB 11例、术后NOCD接受PPM治疗4例,分别占BAV总人数的5.6%、1.9%、7.4%、20.4%、7.4%(图2C)。

图2 分类人数占比 A.各种类型NOCD 在总人数中的占比;B.TAV 组各种类型NOCD 在TAV 总人数中的占比;C.BAV 组各种类型NOCD 在BAV 总人数中的占比Figure 2 Flow chart for patient inclusion
2.1 重度AS患者基线资料比较
在TAV组中,NOCD组高血压病的比例显著大于无NOCD组(P=0.046)。在BAV患者中,两组患者各个基线临床特征间的比较,差异均无统计学意义(均P>0.05,表1)。
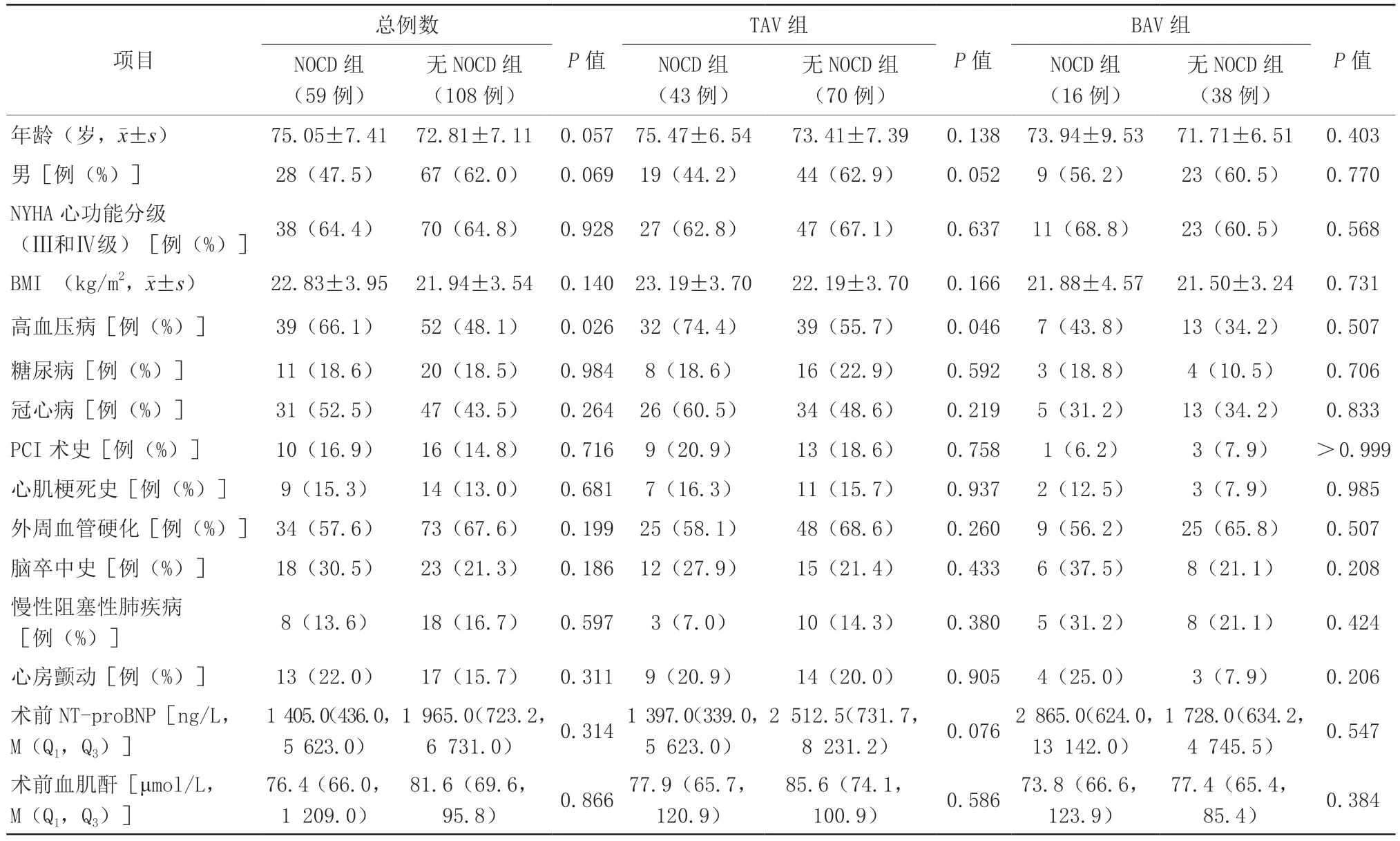
表1 患者的基线临床数据Table 1 Baseline clinical characteristics of patients
2.2 重度AS患者TAVR术前TTE以及心电图数据
在TAV组中,与无NOCD组相比,NOCD组有更大的主动脉瓣口面积(P=0.017),更长的QT间期(P=0.038)。在BAV组中,NOCD组术前PR间期长于无NOCD组(P=0.045);两组患者TTE各测量值比较,差异均无统计学意义(均P>0.05,表2)。

表2 患者TAVR 术前经胸超声心动图及心电图数据Table 2 Transthoracic echocardiographic and electrocardiogram data before TAVR in patients
2.3 升主动脉根部特征及手术相关因素
使用3mensio工作站测量心电门控升主动脉根部CTA图像中主动脉根部结构的4个平面、冠状动脉高度、主动脉瓣钙化定量、主动脉成角及MS长度等参数(表3~4)。

表3 所有患者升主动脉根部特征Table 3 Characteristics of the ascending aortic root

表4 瓣膜钙化定量及手术相关因素Table 4 Quantification of valve calcifciation and factors related to surgery
在T A V 组中,以8 5 0 H U 为阈值测钙化定量,与无N O C D 组相比,N O C D 组的无冠瓣(P=0.008)、右冠瓣(P=0.010)、左冠瓣(P=0.036)、右-无冠瓣(P=0.005)及主动脉瓣总钙化定量(P=0.008)较小,而主动脉成角(P=0.002)、ΔMSID负值(P=0.011)则大于无NOCD组。基于“瓣叶重叠(cusp-overlap)”技术,在THV置入后的造影图像中测量邻近无冠窦的THV置入深度,NOCD组置入深度显著大于无NOCD组(P=0.005)。在BAV组中,NOCD组主动脉瓣总钙化定量(P=0.018)、右冠瓣区钙化定量(P=0.009)显著小于无NOCD组,而NOCD组人工瓣膜置入深度则大于无NOCD组(P=0.032)。
2.4 重度AS患者TAVR术后NOCD的风险因素分析
多因素Logistic回归分析结果示:右-无冠瓣钙化定量和主动脉成角是TAV组患者TAVR术后N O C D的影响因素,右-无冠瓣钙化定量每增加10 mm3,TAVR术后NOCD的发生风险降低2.6%(OR0.974,P=0.039),主动脉成角每增加1°,术后NOCD的风险将近提升7.3%(OR1.073,P=0.003,表5)。术前心电图PR间期和右冠瓣区钙化定量是BAV组患者TAVR术后NOCD的影响因素,术前PR间期每增加1 ms,TAVR术后NOCD的风险将近提升3.3%(OR1.033,P=0.041),右冠瓣区的钙化定量每增加10 mm3,出现NOCD的风险降低6.6%(OR0.934,P=0.013,表6)。

表5 TAV 患者TAVR 术后NOCD 的相关因素分析Table 5 Analysis of related factors of NOCD after TAVR in TAV patients

表6 BAV 患者 TAVR 术后NOCD 的相关因素分析Table 6 Analysis of related factors of NOCD after TAVR in BAV patients
3 讨论
本研究基于接受自膨胀式瓣膜置入的TAVR患者,分析基线临床特征、升主动脉解剖结构等对TAVR术后NOCD的影响因素,在TAV患者中,右-无冠瓣钙化定量对心脏传导系统具有保护作用,主动脉成角是TAVR术后NOCD的危险因素。在BAV患者中,术前心电图PR间期是TAVR术后NOCD的危险因素,右冠瓣区钙化定量对心脏传导系统具有保护作用。
3.1 TAV患者TAVR术后NOCD的相关因素分析
本研究中T A V组T A V R术后P P M的发生率为8.8%,与Mendiz等[13]报告的6.4%类似。在基线临床特征方面,术前TTE提示NOCD组有较大的主动脉瓣口面积,考虑较小的钙化性主动脉瓣口可能会限制自膨胀式瓣膜置入后进一步扩张,减少人工瓣膜对周围组织的接触损伤,降低NOCD的发生风险。
主动脉瓣的钙化分布可能对心脏传导系统具有保护作用。本研究中多因素分析结果提示TAVR术后NOCD的风险随着右-无冠瓣钙化定量(OR0.974,P=0.039)的增加而降低,提示右-无冠瓣钙化可能对接受自膨胀式瓣膜置入的TAV患者的心脏传导系统具有保护作用。其原因可能与右-无冠瓣的钙化限制了自膨胀式瓣膜在该区域的扩张,从而降低了THV或者术中球囊预扩张等操作对走行于右-无冠窦之间的心脏传导系统损伤的风险。本研究T A V组患者中N O C D组的主动脉瓣总钙化定量显著小于无NOCD组(P=0.008),Rampat等[14]研究结果与本研究类似,该研究中多变量回归分析结果表明主动脉瓣钙化的缺失与较高的PPM植入率相关。
对于接受自膨胀式瓣膜置入的患者而言,更高位的THV置入可降低术后NOCD的发生率[15]。Jilaihawi等[16]在一项使用新一代可重新定位自膨胀式瓣膜TAVR的研究中提出,根据MS长度的解剖学方法来引导最小化装置置入的方法。该研究的多变量分析结果提示THV置入深度>MS长度是术后PPM植入的预测因子[16]。一项关于置入球囊扩张式瓣膜的研究发现THV置入左心室的深度是术后持续性LBBB的独立预测因子,本研究TAV组患者中NOCD组的人工瓣膜置入深度显著大于无NOCD组,结果和该研究类似[17]。然而,早前的一项单独纳入接受CoreValve瓣膜置入的研究却认为从无冠窦测量的人工瓣膜置入深度在术后是否NOCD的患者中差异无统计学意义[(9.01±3.64)mm比(8.01±3.15)mm,P=0.25][18]。各项研究中对人工瓣膜置入深度与术后NOCD相关性的结论有较大差异,这些差异可能与各研究的样本量、研究对象的不同(纳入研究样本中置入球囊扩张式瓣膜和自膨胀式瓣膜的区别)等因素相关。为了进一步明确上述因素与NOCD的相关性,仍需要进一步的大型随机对照研究加以验证。
主动脉成角对接受自膨胀式瓣膜置入的TAVR术后NOCD的影响尚不明确。本研究中的结果表明主动脉成角是T A V R术后N O C D的独立预测因子。Popma等[19]的研究结果表明,主动脉角度较大的患者的手术时间更长,但是主动脉角度与术后PPM植入率、术后30 d中度及以上主动脉瓣反流等并发症无明显线性相关。Bob-Manuel等[20]研究结果与Popma等类似,该研究评估了新一代球囊扩张式瓣膜和自膨胀式瓣膜与主动脉成角(分为<49°组和≥49°组)之间的相关性。两组患者术后再入院率、PPM植入率、死亡率比较,差异均无统计学意义(均P>0.05)。关于主动脉成角与NOCD的相关性,目前尚无大型随机对照研究的资料,但是在临床工作中主动脉成角较大的患者并不少见,甚至有极具挑战性的极水平主动脉(aortic root angle≥70°)患者准备接受TAVR治疗。对于主动脉根部角度或者主动脉弓角度较大的患者,可以联合圈套器协助THV定位,更好地实现THV与自然瓣膜的同轴释放,即对齐圆环的中心释放[21]。
3.2 BAV患者TAVR术后NOCD的相关因素分析
我国重度AS人群中BAV患者比例较国外高,在60~80岁的重度AS患者中,BAV约为50%[2]。Forrest等[22]根据Evolut研究的纳排标准进行的一项低风险BAV患者的前瞻性研究中发现,PPM的发生率高于本研究(15.1%比7.4%)。本研究中BAV患者根据“环上结构(supra-annulus)”评估置入瓣膜的型号,而该研究[22]中基于主动脉瓣环的测量结果选择的THV尺寸可能会偏大,因此增加了主动脉瓣环破裂和PPM发生的风险。BAV的解剖结构与TAV有较大差别,因此在一些TAVR的大型随机对照试验中BAV的患者常常被排除在外。目前常用的BAV分类有两种,经典的Sievers分型根据嵴的数量分为2个嵴的Sievers Ⅱ型、无嵴的Sievers 0型、1个嵴的Sievers Ⅰ型[23]。在SieversⅠ型中又根据嵴与冠状动脉开口的分布位置划分为右-左冠瓣、右-无冠瓣和左-无冠瓣,其中最常见的畸形是右-左冠瓣,约占75%[23]。本研究中Sievers 0型BAV占比最高,约61.1%,Sievers Ⅰ型中的右-左冠瓣、右-无冠瓣、左-无冠瓣的比例分别为27.8%、5.6%、5.6%。
本研究发现右冠瓣区钙化定量的增加可降低术后NOCD的风险(OR0.934,P=0.013),考虑原因可能为该位置的钙化对心脏传导系统起到类似“盾牌”的防护作用,限制自膨胀式瓣膜在右冠窦方向的扩张,降低其对传导系统的损伤风险。Liu等[24]在一项研究中提出在BAV患者中通过术中球囊的尺寸选择THV,使用downsizing策略,这类术中策略也可减少置入的T H V与L V O T周围组织的相互作用,从而降低传导系统受到机械损伤风险。本研究BAV组患者中NOCD组主动脉瓣总钙化定量显著小于无NOCD组(P=0.018),考虑主动脉瓣较重的钙化程度是否与T A V R后较低的N O C D发生风险相关。Ou等[25]在一项接受自膨胀式瓣膜置入的单中心研究得出的结论与本研究相似,其结果表明在Sievers Ⅰ型患者中,过度的瓣叶钙化与较低的高度房室传导阻滞相关(13.9%比39.5%,P=0.011),认为可能与BAV的环上结构和更大的小叶钙负荷限制了人工瓣膜的扩张有关。
本研究中TAVR术前PR间期是术后NOCD的危险因素(OR1.033,P=0.041)。在一项单中心研究中,单因素分析结果提示PR间期延长是PPM的预测因子(OR1.02,95%CI1.003~1.04,P=0.02)[26]。除此之外,心房颤动、一度房室传导阻滞、左前分支阻滞、术中房室传导阻滞、LBBB、右束支传导阻滞、PR间期>200 ms、QRS持续时间等因素也可增加TAVR术后PPM的风险[27]。
本研究的局限性:本研究为单中心回顾性研究,结果需进行多中心随机对照研究进一步验证。在右-无冠瓣钙化定量大于本研究中TAV组右-无冠瓣钙化定量最大值的患者中,右-无冠瓣钙化定量与NOCD的相关性有待进一步研究。本研究中BAV患者仅54例,样本量较小,结论中右冠瓣区钙化定量与NOCD的相关性需要进一步研究验证。
综上所述,本研究分析了接受自膨胀式瓣膜置入的T A V 及B A V 重度A S患者的术前心电图、TTE及术前升动脉根部CTA等临床资料。发现右-无冠瓣钙化定量和右冠瓣区钙化定量分别对TAV和BAV患者的心脏传导系统具有保护作用。
利益冲突 所有作者均声明不存在利益冲突

