经导管缘对缘修复二尖瓣的体外流体力学性能评价
王颢 朱达 卢志骞 贺照明 刘丽 潘湘斌,6
二尖瓣反流(mitral regurgitation,MR)是一种临床上常见的心脏瓣膜病[1],据估计国内需要干预治疗的MR患者达700余万例[2]。对于中、重度MR患者来说,手术治疗的方法有瓣膜置换或修复,后者最大限度地保留了天然瓣膜结构,术后并发症少,具有更好的远期效果[3-5]。近年来,随着介入手术方法的发展和普及[6-8],经导管缘对缘修复(transcatheter edge-to-edge repair,TEER)以创伤小、恢复快、良好的中远期治疗效果等诸多优点迅速成为研究热点领域[9-12]。其适应证已经覆盖高外科风险的重度退行性二尖瓣反流(degenerative mitral regurgitation,DMR)和在最优药物治疗下仍具有症状的中-重度及以上功能性二尖瓣反流(functional mitral regurgitation,FMR)患者[13]。
自首款T E E R 器械M i t r a C l i p(雅培公司,美国)成功通过美国食品药品监督管理局(Food and Drug Administration,FDA)、欧盟(Conformite Europeenne,CE)认证及我国国家药品监督管理局(National Medical Products Administration,NMPA)批准上市以来,已经取得了较好的临床效果[13-14]。随着TEER的广泛应用,近年来诸多国产二尖瓣TEER器械应运而生[15]。由于二尖瓣解剖结构的特殊性,TEER器械临床前评价除了动物载体研究以外,目前国内尚无诸如介入主动脉瓣膜产品临床前验证所必须的体外脉动流测试。如何离体建立二尖瓣病理模型以及验证器械,目前尚未有定论。体外脉动流测试可以精准再现瓣膜置换/修复前、后的运行状态,精确测量各种流体力学参数,被公认是表征瓣膜血流动力学性能的“金标准”[16-17],也是国际标准《ISO 5910-2018 Cardiovascular implants and extracorporeal systems - Cardiac valve repair devices》所规定的必测项目。TEER器械受其适应证的限制,目前临床仍需对患者进行甄选,特别是非A2-P2区域反流的FMR研究较少,且存在较大争议[9,13-14]。
本研究的目的是建立一套适用于离体二尖瓣体外测试的方法,定量评价T E E R 对F M R 病理(非A 2-P 2反流)的修复效果。利用完整的离体猪二尖瓣组织,通过瓣环扩张和乳头肌移位,建立非A 2-P 2反流的F M R病变模型,并通过国产T E E R 器械对其进行缘对缘修复。通过测试病理瓣膜修复前、后,在不同生理和病理条件下的流体力学性能,定量评价TEER器械的修复效果,为TEER器械的设计、优化及可靠性和有效性的验证、评价提供全面的数据和有效的测试方法。
1 材料与方法
1.1 离体二尖瓣脉动流测试系统(图1)
离体二尖瓣脉动流测试系统分为两个部分,用以模拟脉动血液周身循环的循环系统和控制脉动流、检测流体力学参数的测控系统(型号MPD,上海心瓣测试设备有限公司,中国上海)。
脉动流循环系统的结构,包括:驱使工作液周期脉动流的脉动流发生器;安装待测离体猪二尖瓣和主动脉辅助瓣膜(29M人工双叶瓣,St.Jude Medical,美国),并连接脉动流发生器的模拟心室腔;模拟心房低压环境,调节心室前负荷的心房腔和蓄水槽;模拟主动脉和周边血管弹性的弹性腔;模拟血管阻性,产生并维持主动脉血压的阻尼器(图1A)。循环系统中的工作液为0.9%生理盐水。
测控系统可以控制脉动流发生器产生预设频率和收缩期占比的脉动流,并同步采集心房、心室、主动脉压力和经瓣膜流量,采样率为1 kHz。3个压力传感器分别安装在心室腔、心房腔和主动脉处测压孔(图1B),精度<0.1 mmHg(1 mmHg=0.133 kPa)。超声流量计(TS410型,Transonic公司,美国)的传感器安装在心房入口处(图1B),精度<0.1 L/min。心房腔由刚性材料(透明有机玻璃)制成,且充满液体无气泡,心房入口处流量可被视作经二尖瓣流量。
1.2 瓣膜测试条件
测试参考国际标准《I S O 5 9 1 0-2 0 1 8 Cardiovascular implants and extracorporeal systems - Cardiac valve repair devices》和《ISO 5840-2021 Cardiovascular implants - Cardiac valve prostheses》体外脉动流测试要求,模拟了13种生理和病理的脉动流环境作为测试条件,其中条件1为标准人体生理环境。13种测试条件详细参数如表1所示,其中模拟心输出量(simulated cardiac output)被定义为瓣膜正向流体积与心率的乘积,专用于体外测试,与临床的心输出量(cardiac output)不同。
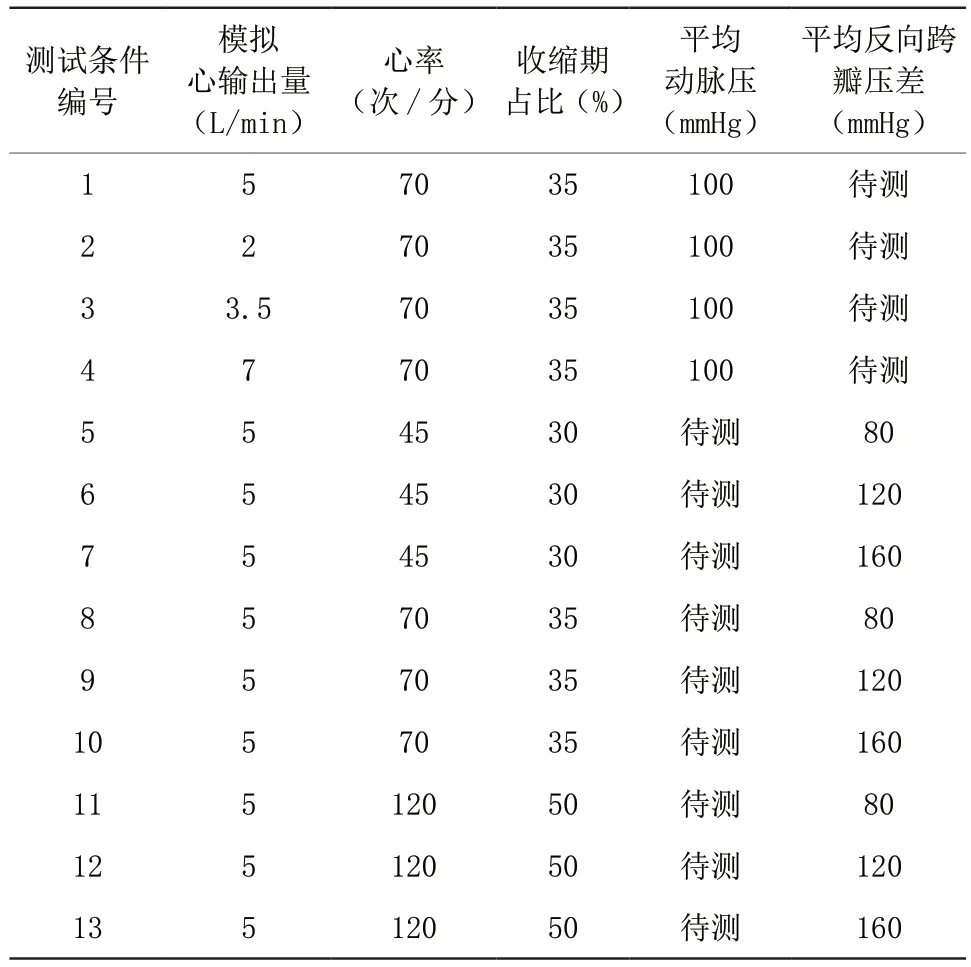
表1 瓣膜测试条件Table 1 The valve testing conditions
1.3 病理二尖瓣模型
从屠宰场获取新鲜猪心,24 h内用于测试。使用瓣环测量器(Edwards Lifescience LLC,美国)选取瓣环为34M的二尖瓣。将二尖瓣瓣叶、瓣环及瓣叶下组织,包括腱索、乳头肌,完整解剖下来。通过瓣环扩张和乳头肌移位建立FMR病理模型。瓣环被缝合在特制的扩张60%的固定环上,扩张形态参考临床病理瓣膜[18],与生理瓣环相比,瓣环面积扩张40%~60%(达到7 cm2),二尖瓣交界径增加30%~40%(达到45 mm),二尖瓣前后径增加50%~60%(达到40 mm;图2A)。前、后乳头肌固定在特制的夹持器上,调整夹持器位置,前乳头肌保持生理状态,后乳头肌分别在Medial、Posterior和Apical方向各移动5 mm[19-21](图2C)。病理瓣膜要求在测试条件1下,反流分数达到40%~70%(临床诊断中-重度及重度反流标准)。单侧后乳头肌移位在临床上更为常见,会导致瓣膜反流区在A1-P1以及P1-P2天然裂隙区域[22-23]。模拟临床置入手术,将某国产TEER器械(二尖瓣夹子:长12 mm,宽6 mm)安装于二尖瓣的A1-P1区,如瓣膜仍对合不良,则在A2-P2区域置入第二枚器械,用于改善P1-P2天然裂隙区反流。TEER器械按照最大夹合量(5 mm)对瓣叶进行夹合,修复后效果见图2B~C。

图2 病理二尖瓣修复前、后 A.修复前心房侧;B.修复后心房侧;C.修复后心室侧Figure 2 The pathological mitral valve pictures before and after repair
1.4 测试计划
共测试6个二尖瓣FMR病理模型。每个瓣膜修复前、后均在13种不同条件下完成测试。每项测试采集并保存连续10个心动周期的数据,包括心房、心室、主动脉压力和经瓣膜流量。计算获得瓣膜的有效孔口面积(effective orifice area,EOA)、正向跨瓣压差(positive differential pressure)、反流体积(regurgitant volume,RV)和反流分数(regurgitant fraction,RF)。EOA计算公式参考国际标准ISO 5840。正向跨瓣压差为1个心动周期内正向流阶段瓣膜两侧正向压差的平均值。RV和RF包含关闭体积和泄漏体积,与临床仅包含泄漏体积不同。
1.5 统计学分析
统计结果以均数±1倍标准差的形式表示。以P<0.05为差异有统计学意义。
2 结果
6个病理瓣膜均使用了2个TEER器械进行修复,分别安装于A1-P1和A2-P2区域。在测试条件1下,其中1个二尖瓣修复前、后1个心动周期的心房、心室压和经瓣膜流量曲线见图3(连续10个心动周期的平均值)。与修复前相比,修复后心室压力在收缩期幅值略有增大,收缩期时长由345 ms增加到368 ms,心房压没有明显变化(图3A)。瓣膜修复前、后对比,关闭流量峰值由-11.1 L/min减少到-10.3 L/min,关闭时长由127 ms缩短到118 ms,平均泄漏流量由-5.3 L/min减少到-1.9 L/min,泄漏时长由257 ms增加到274 ms(图3B)。

图3 在测试条件1 下,二尖瓣修复前、后1 个心动周期的压力和流量曲线 A.心房和心室压;B.经瓣膜流量Figure 3 The pressure and flow before and after repair under condition 1
13种测试条件下,6个二尖瓣修复前、后EOA、正向跨瓣压差、RV和RF见图4。表征瓣膜正向流性能的EOA[(3.8±1.6)cm2比(2.2±0.5)cm2,P<0.001]和正向跨瓣压差[(1.8±1.3)mmHg比(3.8±1.8)mmHg,P<0.001]修复前、后比较,差异均有统计学意义。修复带来一定程度上的瓣膜狭窄,EOA显著降低约40%(P<0.001),同时正向跨瓣压差显著升高约110%(P<0.001)。表征瓣膜关闭性能的RV[(44.7±19.5)ml比(22.6±6.0)ml,P<0.001]和RF[(60.2±17.5)%比(34.7±12.0)%,P<0.001]修复前较修复后显著降低,差异均有统计学意义。

图4 13 种测试条件下,6 个二尖瓣修复前、后的结果 A.EOA;B.正向跨瓣压差;C.RV;D.RFFigure 4 The results of 6 mitral valves before and after repair under 13 conditions
3 讨论
本研究建立了一套适用于离体二尖瓣体外测试的方法,定量评价了TEER对非A2-P2区域反流的FMR病理瓣膜的修复效果。通过对比修复前、后的测试结果,发现瓣膜由修复前的中-重度及重度反流改善为修复后的轻度及轻-中度反流(参考临床诊断标准:重度反流RF>50%、中度反流RF 30%~50%、轻度反流RF<30%),瓣膜正向流性能维持在正常生理范围内,修复未造成瓣膜的医源性狭窄(参考临床诊断标准:二尖瓣轻度狭窄水平,EOA<2.0 cm2、跨瓣压差>5 mmHg),以上结果表明该修复方法对于非A2-P2区域反流的FMR病理具有良好的修复效果。
此外,上述研究结果还发现,修复后二尖瓣的关闭流量和泄漏流量均有减少,后者更为明显。修复后,瓣膜关闭流量峰值和时长的减少是由于缘对缘修复限制了瓣叶运动的范围,而非瓣叶关闭速度增加。瓣叶关闭速度与关闭流量的变化率相关[21],本研究中修复前、后关闭流量的变化率较为接近(图3B)。瓣膜关闭后,TEER使得前、后瓣叶更有效地对合,大幅度减少了泄漏流量。
测试中发现TEER器械安装的位置对于修复效果有较大影响。置入TEER器械后,如RF没有显著下降,会重新选择器械安装位置,有时少许位置的改变会对反流带来较大影响。分析其原因在于瓣环扩张导致前、后瓣叶有效对合长度变小,修复器械的置入如有利于对合长度的增加则可以获得良好的修复效果,反之则无效果甚至更差。临床上选择器械合适的安装位置是较为困难的,但已有研究尝试在术前找到最佳的安装位置[24-25]。
本研究修复对象为非A2-P2区域反流的FMR病理模型,6 个瓣膜均使用了2 个T E E R 器械进行修复。研究发现仅安装1个器械,无法显著降低RF。由于二尖瓣后叶存在2个天然裂隙,位于P1-P2和P2-P3交界处,天然裂隙有益于瓣膜更充分地打开,但乳头肌的移位,尤其是非对称移位,会导致裂隙不能完全闭合[22-23]。修复的6个瓣膜中有2个瓣膜,多次改变修复器械的安装位置均无法使得裂隙完全闭合。笔者曾用同样的修复器械,修复DMR病理模型(A2-P2反流),仅需在A2-P2区安装1个修复器械,RF有显著降低。由此可见,TEER技术对于FMR病理更具有挑战性,需要更多、更深入的研究。
本研究采用离体猪二尖瓣构建病理模型,与临床人体病理瓣膜存在一定差异。离体二尖瓣的瓣环和乳头肌是固定不动的,而人体内心脏收缩期,瓣环面积会减小,乳头肌会靠近瓣环平面,这可以增加瓣叶的有效对合长度。因此,与离体实验相比,同等条件下临床上可能会获得更佳的修复效果。
随着国产瓣膜修复器械的兴起,对离体瓣膜体外测试的需求更为迫切。本研究为TEER技术在临床上拓展适应证提供了体外评价方法,同时也为瓣膜修复技术的改进提供了数据依据和验证手段。此外,我国关于自体瓣膜修复的测试标准,目前尚无等同于ISO 5910的国标或相关指导意见发布。本研究立足当下需求,为我国瓣膜修复技术、瓣膜产业发展和相关标准的出台提供了前期参考资料。
本研究建立了一套适用于离体二尖瓣体外测试的方法,测试了6 个F M R 病理瓣膜(非A2-P2反流)修复前、后,不同生理和病理条件下的流体力学特征,初步定量评价了国产TEER的修复效果。测试结果显示,病理瓣膜由修复前的中-重度及重度反流改善为修复后的轻度及轻-中度反流,且未造成医源性狭窄,这表明该修复方法对于非A 2-P 2区域反流的F M R 病理具有良好的修复效果。本研究为TEER技术拓展适应证以及该技术的优化和改进提供了体外验证手段和评价方法,同时也为瓣膜修复测试相关标准的制订提供了可参考的资料。
致谢 上海心瓣测试设备有限公司提供了测试设备和相关技术指导。
利益冲突 所有作者均声明不存在利益冲突

