山东省血站血液检测质量监测指标体系的应用
李雪梅 翟玮玮 杨忠思 赵淑红 吴玉清 刘群 宋哲 戎志全 孙庶丽 范晓娟张韦 韩金玉 朱琳0 安宪武 张惠 任俊霞 李雪晶 杨晨曦 周博 黄海燕 刘广彩陈平 叶辉 谯铭铭 申华 贡觉顿珠 庄云龙
(1.潍坊市中心血站,山东 潍坊 261043;2.青岛市中心血站;3.淄博市中心血站;4.山东省血液中心;5.烟台市中心血站;6.威海市中心血站;7.日照市中心血站;8.滨州市中心血站;9.菏泽市中心血站;10.东营市中心血站;11.聊城市中心血站;12.枣庄市中心血站;13.德州市中心血站;14.济南血液供保中心;15.泰安市中心血站;16.济宁市中心血站;17.临沂市中心血站)
《血站实验室质量管理规范》要求实验室“必须建立和持续改进实验室质量管理体系,并负责组织实施和严格监控”[1]。 为实现质量监测的标准化和同质化,打造山东省血站“一盘棋”的管理和发展模式,山东省血液质量控制中心组织专家成立项目组,历时2 年多的时间,建立覆盖采供血全过程的血液质量监测指标体系,分为血液采集、制备、检验、供血和质量控制5 个部分,共计72 个指标。 通过2021 年下半年全省血站的试行后,取得非常理想的效果。 通过对质量监测指标客观数据的量化监控和趋势分析,以了解本省各实验室运行情况,可以找出实验室质量管理体系运行中的薄弱环节,发现不合格因素,制定针对性纠正措施,为调整和优化血液筛查方法提供依据,为全省血液检测实验室共同提升检测性能提供数据支持,保证血液质量[2],同时评价质量监测指标的适用性、可行性和有效性。 2022 年该指标体系正式实施,我们收集了2022 年1—12 月全省17 家血站血液质量监测指标数据并对其中的血液检测指标(31 个)的建立和应用进行探讨,现报告如下。
1 对象与方法
1.1 对象
山东全省17 家血站,包括1 家血液中心、16 家中心血站。
1.2 方法
1.2.1 质量监测指标的建立
依据国内外采供血相关的最新标准和指南,结合血液采集、制备、检验、供血和质量控制过程的实际工作,经过2 轮德尔菲法专家函询等过程,建立了以关键控制点为基础,明确术语、意义和计算公式,以客观数据覆盖采供血全过程的质量监测指标体系,共计72 个指标(另文发表),其中包含本文要分析的31 个血液检测过程监测指标(表1)。
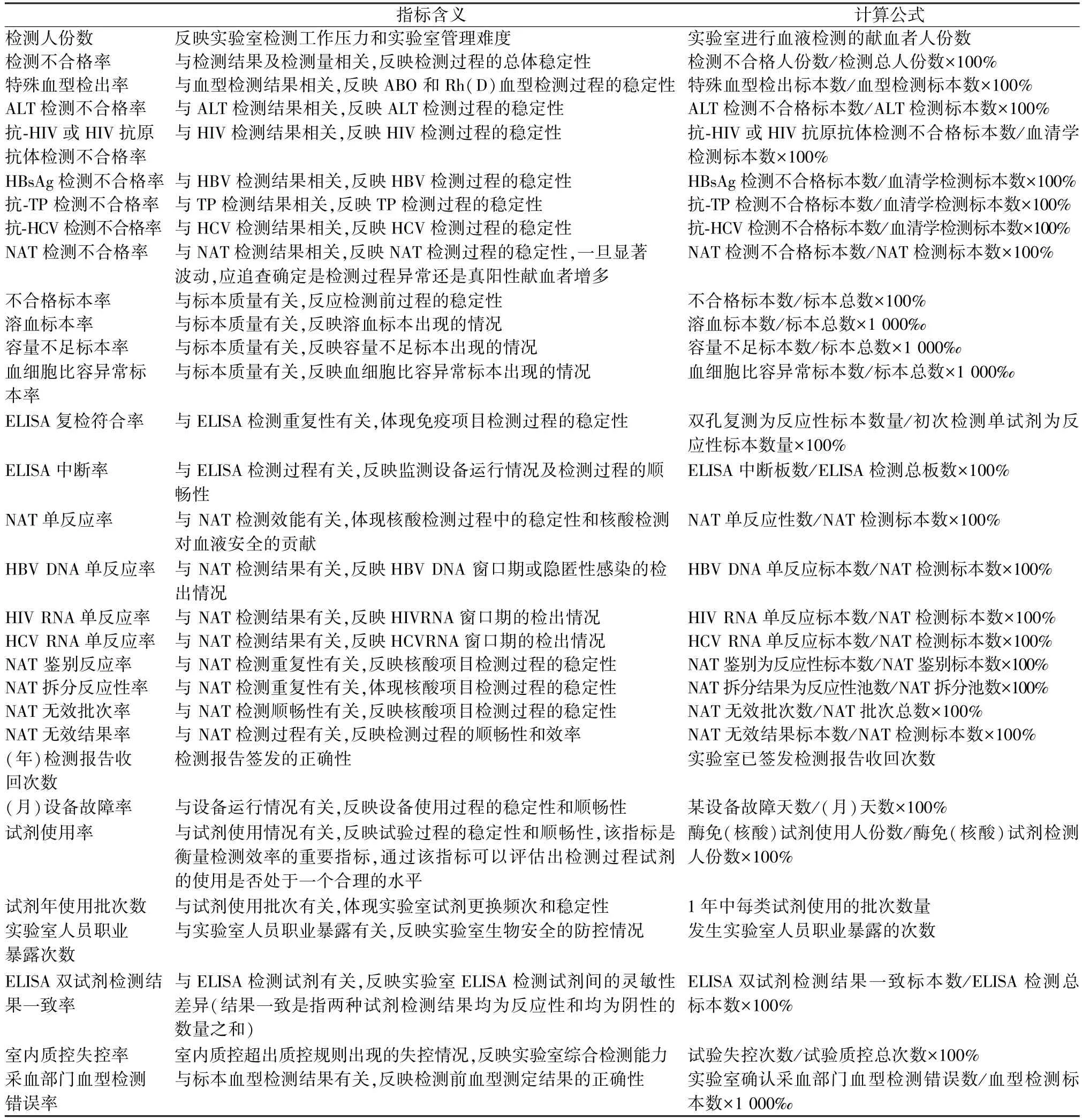
表1 血液检测过程质量监测指标Table 1 Quality monitoring indicators for blood testing process
1.2.2 数据收集
山东省血液质量控制中心向全省17 家血站发放《采供血过程质量监测指标统计表》,各血站根据指标定义和计算公式,填报2022 年1—12 月血液检测部分31 个质量监测指标的基础数据。
1.3 统计学分析
使用SPSS23.0 软件对所有数据进行统计分析,采用χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 血液检测过程质量监测指标
全省17 家血站实验室血液检测不合格率最低0.6%,最高2.81%,均值和中位数分别为(1.23±0.57)%与1.11%(表2)。 ALT 不合格率和血液检测不合格率呈正相关(r=0.974,P<0.05),见图1。酶免4 项(HBsAg、抗-HCV、抗-HIV、抗-TP)不合格率分布见图2。 各检测项目不合格标本占比ALT为55.84%、HBsAg 为13.63%、抗-HCV 为5.08%、抗-HIV 为5.62%、抗-TP 为18.18%,其他因素(主要标本不合格)占1.65%,见图3。
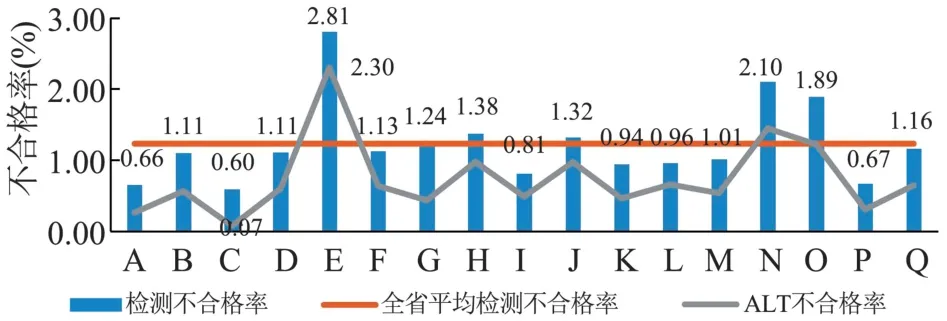
图1 17 家血站实验室血液检测不合格率和ALT 不合格率分布Figure 1 Distribution of unqualified rate of blood testing and ALT in 17 blood bank laboratories in Shandong province

图2 全省17 家血站实验室酶免4 项不合格率分布Figure 2 Distribution of unqualified rates of four ELISA items tests in 17 blood bank laboratories in Shandong province

图3 全省17 家血站实验室各检测项目不合格标本占比Figure 3 The proportion of unqualified samples for various testing items of 17 blood bank laboratories in Shandong province

表2 全省17 家血站实验室血液检测过程主要质量监测指标数据分布Table 2 Distribution of main quality monitoring indicators during blood testing in 17 blood bank laboratories in Shandong province
2.2 ELISA 4 项复检符合率分布
17 家血站实验室HBsAg、抗-HCV、抗-HIV、抗-TP 不同试剂ELISA 复检符合率比较见表3。 17 家血站实验室ELISA 双试剂检测结果一致率为(99.63±0.24)%,最高为99.94%(P 血站),最低为99.10%(B 血站)。 17 家血站实验室HBsAg 试剂中a 试剂10 家、b 试剂10 家、c 试剂3 家、d 试剂4家,两两试剂复检符合率比较有差异(χ2=330.30,P<0.05)。 抗-HCV 试剂中a 试剂12 家,e 试剂8家、f 试剂2 家、d 试剂3 家,两两试剂复检符合率比较有差异(χ2=97.80,P<0.01)。 抗-HIV 试剂中a 试剂10 家、e 试剂8 家、b 试剂6 家、d 试剂2 家,两两试剂复检符合率比较有差异(χ2=56.38,P<0.05)。 抗-TP 试剂中a 试剂10 家、b 试剂11 家、d试剂5 家,两两试剂复检符合率比较有差异(χ2=86.28,P<0.05)。

表3 17 家血站实验室HBsAg、抗-HCV、抗-HIV、抗-TP 不同试剂ELISA 复检符合率比较Table 3 Comparison of ELISA retest compliance rates of different reagents for HBsAg, anti-HCV, anti-HIV, and anti-TP in 17 blood bank laboratories
2.3 不合格标本相关指标分布
17 家血站实验室标本不合格率中位数为0.07‰,7 家为0,最高1.25‰(N 血站);标本溶血率12 家为0,最高0.92‰(N 血站);标本容量不足率13 家为0,最高0.11‰(P 血站);标本血细胞比容异常率12 家为0,最高0.13‰(N 血站)。 A、C、D、E、L、O、Q 7 家血站实验室全年未发生标本不合格。 H、G、K 三家实验室标本不合格率分别为0.58‰、0.44‰、0.41‰,分列前三位。
2.4 试剂使用率、中断率和室内质控失控率指标分布
17 家血站实验室ELISA 试剂使用率中位数为114.2%,最高值121.44%(K 血站),最低109.45%(O 血站)。 ELISA 中断率中位数为8.68‰,最高为24.10‰(E 血站),最低为0(L、O 血站)。 ELISA失控率中位数为0.42‰,前3 位分别为3.58‰(F血站)、2.87‰(N 血站)、2.84‰(H 血站),C、D、E、I、O、P、Q 血站失控率为0。 失控率与中断率、试剂使用率不具有相关性(r分别为0.231、0.052,均为P>0.05)。 中断率与试剂使用率存在相关性(r=0.592,P<0.05),见图4。

图4 17 家血站实验室ELISA 试剂使用率、中断率、失控率相关性比较Figure 4 Correlation comparison of ELISA reagent usage rate, outrange rate, and out of range rate among 17 blood bank laboratories
2.5 NAT 相关监测指标分布
2022 年全省17 家血站实验室NAT 标本共1 171 481份,检出HBV DNA 阳性443 份,不合格率为3.78/万;检出HCV RNA 阳性15 份,不合格率为0.13/万;检出HIV RNA 阳性5 份,不合格率为0.04/万。 NAT 检测不合格率中位数为0.66‰,其中不合格率最高为1.82‰(B 血站),不合格率最低为0.14‰(L 血站),见图5。 NAT 单反应率中位数为0.37‰,其中单反应率最高为0.73‰(C 血站),单反应率最低为0.14‰(L 血站)。 HBV DNA 单反应率中位数为0.36‰,最高为0.71‰(M 血站),最低为0.11‰(F 血站)。 NAT 单反应率与HBV DNA单反应率呈正相关(r=0.886,P<0.05)。 3 家血站(C、F、H )实验室使用单检核酸检测系统,鉴别阳性率分别为36.99%、20.00%、23.88%(χ2=7.27,P<0.05)。 17 家血站实验室使用核酸混样检测模式,拆分率中位数为36.36%,最高58.21%(B 血站),最低6.38%(O 血站);NAT 无效批次率中位数为0.67%,最高2.87%(K 血站),D、F、I、O 血站实验室未产生无效批次;NAT 无效结果率中位数为0.07‰,最高2.35‰(C 血站),D、O 血站实验室未产生无效结果的标本。

图5 17 家血站实验室NAT 不合格率、NAT 单反应率、HBV DNA 单反应率比较Figure 5 Comparison of NAT unqualified rate, NAT single reactive rate, and HBV DNA single reactive rate among 17 blood bank laboratories
2.6 其他质量监测指标分布
17 家血站实验室设备累计故障天数中位数为14 d,前3 位分别为67 d(N 血站)、58 d(P 血站)、45 d(A 血站)。 C 血站实验室设备未发生故障。采血部门血型检测错误率中位数为0.14‰,最高为0.26‰(J 血站),最低为0(D、E、P 血站)。 有3 家血站实验室收回报告总计6 次,分别是A 血站4次、M 血站1 次、O 血站1 次。 实验室人员职业暴露次数指标中仅C 血站1 家实验室出现1 例职业暴露。
3 讨论
2022 年山东省17 家血站实验室检测不合格项前3 位分别是ALT、抗-TP、HBsAg(图3)。 血液检测不合格率中位数1.11%,ALT 不合格率中位数0.60%,图1 显示ALT 不合格率与检测不合格率具有正相关性,ALT 是造成血液检测不合格的主要原因。 各血站应加强街头ALT 初筛检测仪器的校验维护和每日质控,加强对采血人员、实验室检测人员执行SOP 操作的日常监督,持续提高ALT 初筛检测水平的准确性。 同时对临近ALT 限制范围内的标本,进行干化学法与速率法的对比研究,探讨更优的ALT 初检策略,提高业务运行效率。
山东省血站HBV 检测不合格率平均为9.01/万。 文献显示2017—2020 年18 家血站的献血者HBV 不合格率为13.48/万~144.02/万,其中东部地区HBV 不合格率平均为26.14/万[3],广州地区报道的献血人群HBV 不合格率75/万[4],北京地区献血人群HBV 不合格率28/万[5]。 本研究山东省HBV 不合格率平均值低于上述地区的原因可能与HBsAg 初筛、定期献血者比例、献血人群、实验室检测能力等有关。 H 血站实验室HBsAg 不合格率最低(0.06%),显著低于省内其他使用相同试剂组合(a+b 2 种试剂)的不合格率0.12%,原因与献血前全面开展HBsAg 初筛并进行奖惩有关,且H血站的献血人群中学生占比较高[6]。 O 血站实验室最高(0.41%),主要原因是献血前没有进行HBsAg 的初筛,说明献血前实施健康征询、体格检查和血液检测,可以有效筛除部分HBV 感染者。 HBsAg 是不合格率占比(13.63%)第二的项目(图3),目前还是有必要对献血者进行献血前初筛,降低报废率。 本研究中HBsAg 使用的3 种国产试剂(a、b、d)ELISA 复检符合率41.88% ~75.12%(P<0.05),高于进口试剂(c)ELISA 复检符合率18.01%(P<0.05),各实验室应加强对检测试剂灵敏度、特异性等检测效能的综合评价,保证血液检测的准确性。
各血站实验室抗-HCV 检测不合格率为0.01%~0.19%(P<0.05),低于阜阳的0.23%(2013—2016年)、拉萨的0.32%(2011—2015 年)、南京的0.27%(2007—2016 年),吉林的0.53%(2011—2012 年),郑州的0.46%(2011 年)、京津冀15 家血站总体的18.27/万(2018 年)[7],偏低的原因可能与近年来实验室四代HCV 试剂的投入使用,提高了特异性有关。 研究表明双抗夹心法(四代)从方法学上有效解决了在间接法中存在的一些缺陷,从理论上具有更好的特异性[8]。 共有11 家血站实验室采用a+e 试剂组合做抗-HCV 初复检,不合格率为0.01%~0.09%(P<0.05),L、M、P 血站实验室最低(0.01%),存在较大差异。 有研究显示58 份抗-HCV 灰区标本进行RIBA 检测,无阳性结果,提示灰区可能造成更多的血液浪费[9]。 L、M、P 血站实验室应从影响实验可能的因素查找原因,避免假阴性的产生。 抗-HCV 不合格率最高(0.19%)的G 血站实验室使用的初复检试剂为a+进口试剂,可能与进口试剂抗-HCV 检测不合格率高于国产试剂有关[8],另有研究显示进口试剂与国产试剂包被的抗原片段不同,所以对抗体检出的灵敏度和特异性存在差异[10]。 3 家国产抗-HCV 试剂ELISA 复检符合率40.96%~71.43%,低于进口试剂的83.21%(表3),表明国产试剂的特异性略低于进口试剂。试剂仍然是造成抗-HCV 不合格率差异大的重要因素,各实验室应加强试剂使用前的科学评估。
各血站实验室抗-HIV 检测不合格率为0.02%~0.13%(P<0.05),中位数为0.06%,低于京津冀15 家血站实验室的6.77/万~35.71/万(2018 年),也低于其他地区的7.5/万~78.3/万[11],可见山东省无偿献血人群仍处于HIV 低流行趋势。 初复检使用a+b 试剂组合的7 家血站实验室抗-HIV 不合格率为0.03%~0.11%(P<0.05),4 种抗-HIV 国产试剂ELISA 复检符合率29.71% ~64.36%(P<0.05),表明实验室重复检测的准确性除试剂外还可能与人员、设备等因素有关,值得各实验室进一步探讨。 N 血站实验室2022 年1—8 月使用a+d试剂组合,抗-HIV 检测不合格率均值为0.16%(P>0.05),9—12 月份使用d+e 试剂组合,抗-HIV 检测不合格率均值为0.06%(P>0.05),a 试剂可能是导致N 血站实验室抗-HIV 不合格率偏高的主要原因。 e 试剂抗-HIV 复检符合率仅为29.71%(表3),低于其他3 种HIV 试剂(P<0.05),e 试剂可能是造成I 血站实验室最低的主要原因。
各血站实验室抗-TP 检测不合格率0.11%~0.28%(P<0.05),中位数为0.22%,低于2018 年京津冀15 家血站总体的35.27/万[12]。 同样采用a+b试剂组合检测,抗-TP 不合格率H 血站实验室最高(0.28%),显著高于其他的实验室(0.21%)。 根据H 血站实验室2020—2022 年抗-TP 不合格率分别为0.35%、0.28%、0.31%(P>0.05),推测抗-TP 不合格率高不是检测试剂导致,可能与H 血站实验室灰区设置范围为0.5 倍S/C0 有关。 有研究发现设有灰区的9 家血站实验室共检出136 份灰区标本,经确证均为阴性,即灰区标本确证阳性率均为0[13]。 据此,H 血站实验室应对抗-TP ELISA 的灰区设置做进一步研究论证。 有研究显示增加献血前抗-TP 初筛后,检测不合格率由10.43%下降为0.18%[14]。 C 血站在献血前开展抗-TP 筛查,抗-TP不合格率最低(0.11%),所以血站应增加献血前TP 初筛,进一步降低报废率。 抗-TP ELISA 试剂复检符合率d 试剂为49.20%、a 试剂为79.49%、b 试剂为81.53%(P<0.05),实验室可通过确证实验评价不同厂家试剂的检测效能。
不合格标本包括溶血、乳糜、容量不足、球浆比异常等。 H、G、K 3 家血站实验室使用溶血、乳糜血比色卡对标本做筛查,说明这几家单位更重视标本质量对实验结果的影响,对检测前过程的要求更加严格。 7 家血站实验室全年未发生标本不合格,可能与未建立不合格标本评判标准有关。 ELISA 中断率反映监测设备运行情况及检测过程的顺畅性,应加强对设备的日常维护、保养和人员标准化培训。
检测报告收回提示实验室存在重大风险,A、M、O 3 家血站实验室应深入分析报告错发的原因,排查风险点,提出纠正预防措施,确保报告签发100%正确。
各血站实验室NAT 不合格率为0.14 ~1.82‰(P<0.05),这可能与实验室使用的检测模式、试剂厂家、实验室环境状态、工作人员操作水平等都有关系[15]。 各实验室应比较历年相同时期相同设备的检测数据,同时与其它使用相同设备的血站进行横向比较,从而评估实验室的检测水平。 各实验室NAT 拆分反应性率为6.38%~58.21%(P<0.05),中位数为36.36%。 拆分反应性率差异提示核酸检测仍面临低载量病毒漏检的风险[16],拆分反应性率低的实验室应密切关注实验室污染问题,加强实验室环境监测,规范工作人员实验操作。
核酸鉴别阳性率与检测重复性有关,反映检测过程的稳定性和NAT 联检结果的准确程度[17]。本研究中3 家单检的血站实验室核酸鉴别阳性率为29.68%,低于京津冀4 家血站总体的36.45 ~76.12[18],可能的影响因素有:1)检测策略的不同;2)联检结果呈反应性随后标本保存处置环节处理不当;3)干扰物质存在导致标本管中的病毒核酸降解;4)操作不当使标本受到污染导致联检呈假阳性反应而鉴别呈非反应性。 低病毒载量标本中的病毒颗粒在血浆中分布不均,呈泊松分布状态[19],也是导致联检标本在最初的联检与鉴别试验中检测结果不一致的原因之一。 全省各血站NAT 无效批次率为0 ~3.87%,差异较大。 单检无效批次率为0.97%,低于渭南市的1.14%(2017—2019 年)[15],设备故障和操作失误是导致试验结果无效的主要原因,无效结果的增多会加大实验室的工作量,使检测过程稳定性降低、增加检测过程风险[20]。 实验室应加强设备检修,强化人员培训降低无效批次率和无效结果数。
本研究涉及的血液检测过程质量监测指标体系,涵盖了血站血液检测全要素、全过程,是系统化、科学化分析实验室内部运行状况,实施实验室室间能力比对的重要手段。 经过2022 年的运行,从整体来看,该质量监测指标体系具有良好的适用性、可行性,能够客观地评价17 家血站实验室质量管理水平。 利用评价结果实施自身比对、实验室室间比对和标杆比对,探究实验室自身运行状况和质量管理效能,有助于实验室较系统、较科学的进行综合评价并制定质量管理策略,为提升实验室运行质量和管理水平起到巨大的推动作用。 但该体系也存在一些不足,例如7 家血站实验室全年未发生标本不合格、7 家血站实验室全年失控率为0,说明有必要进一步在标本质量判断的标准化方面进一步达成共识,正确理解一定范围内室内失控是客观存在,并加强实验室室内质控判定规则的标准化。各实验室室内质控结果是反映检测过程稳定性的重要指标,本研究中有关ALT、抗-HIV、抗-TP、抗-HCV、NAT 检测不合格率等指标在各实验室室内质控结果受控状态下,在一定时期内每个血站实验室不合格率应有其相对稳定性,一旦发现该类指标出现显著波动,应立即追查原因,确定是否是真阳性献血者增多,下一步在指标优化中将明确5 项不合格率的意义,通过一定时间内的数据分析,各实验室达到对检测过程稳定性的监控,提高对血液检测的安全性保障。 对于另外一些高风险指标,如“标本与血袋不符”、“内部对照失效率”等将在下一步研究中明确定义和公式,完善检测前、检测中指标体系,确保血液检测安全。
利益冲突说明/Conflict of Interests
所有作者均声明不存在利益冲突。
伦理批准及知情同意/Ethics Approval and Respondent Consent
本研究纳入的所有血站均已签署知情同意书。
作者贡献/Authors' Contribution
李雪梅:数据收集、分析,论文撰写;庄云龙:研究设计及组织实施、论文审核;其他作者:数据收集、报送,协助研究。
致谢/Acknowledgement
感谢山东省血液中心、济南市血液供保中心、青岛市中心血站、淄博市中心血站、枣庄市中心血站、东营市中心血站、烟台市中心血站、潍坊市中心血站、济宁市中心血站、泰安市中心血站、威海市中心血站、日照市中心血站、滨州市中心血站、德州市中心血站、聊城市中心血站、临沂市中心血站、菏泽市中心血站等单位给予的大力支持(排名不分前后)。

