基于FⅧ探讨不同脱盐方式的效果及对其成分的影响
裴仁俊 杜晞 孙盼 黎小月 蒋鹏 李长清 林方昭 曹海军
(中国医学科学院北京协和医学院输血研究所,四川 成都 610025)
血液制品是由健康人血浆或经特异免疫的人血浆,经分离、提纯或由重组DNA 技术制备的血浆蛋白组分,以及血液细胞有形成分的统称[1]。 其中,血液制品中血浆蛋白的制备在我国主要从健康人血浆中提取,需要经历分离纯化、病毒去除/灭活、脱盐、浓缩、冻干等步骤,以确保产品的高纯度[2]。
《中国药典》2020 年版对血浆蛋白制品的离子浓度以及氨基酸含量均有明确的标准。 以FⅧ为例,规定要求Na+含量<160 mmol/L、枸橼酸离子含量≤25 mmol/L[1],为达到标准要求在蛋白纯化后进行脱盐处理。 我国通常釆用离子交换层析法从冷沉淀中分离纯化高浓度的FⅧ浓缩物[3-4]。 离子交换层析主要基于蛋白质和离子交换层析介质之间的电荷相互作用进行分离,通过调整缓冲液的离子浓度或pH 值,可以改变蛋白质与介质的结合强度从而实现蛋白质的纯化。 因此,血浆蛋白制品在分离纯化过程中会有高浓度的盐及小分子引入,脱盐是血浆蛋白制品生产过程中必经步骤,贯穿着纯化的整个过程。 除了蛋白纯化之外,有时为了置换缓冲液、检测分析也需脱盐处理。
目前脱盐方式主要有超滤、透析、凝胶层析,但至今对不同脱盐方式的脱盐效果并未进行分析。此外,许多蛋白具生物活性,脱盐过程中对蛋白活性及成分的影响也未进行探究。 FⅧ是由肝脏合成的糖蛋白,由A1-A2-B 组成的重链及A3-C1-C2 组成的轻链两条肽链构成,两条肽链通过Ca2+连接形成异源二聚体[5]。 由于FⅧ蛋白结构复杂,相对分子质量大,致使FⅧ很不稳定[6]。 在制备过程中,受物理剪切力及其他理化因素影响,很容易活化或失活[7],为较难分离纯化蛋白的典型代表。 本文以FⅧ为例,对不同脱盐方法的脱盐效果及对其成分的影响进行了探讨,旨在为蛋白处理过程中脱盐方式的选择,提供借鉴和参考。
1 材料与方法
1.1 试验材料
凝胶过滤填料Sephadex G-25 Medium(批号:10315911,美国Cytiva 公司)、Fractogel EMD Bio-SEC(批号:K95527717926,美国Millipore 公司)、超滤离心管30 kD(批号:R1NB80475,美国Millipore公司)、透析膜(规格7 kD,Biosharp 公司)、血浆标准品(批号:S20230304,德国西门子公司)、FⅧ∶C检测试剂盒(批号560842,德国西门子公司)、VWF抗原检测试剂盒(批号:B34906,沃芬医疗器械有限公司)、VWF 活性检测试剂盒(批号:00503,德国西门子公司)、Super-Bradford 蛋白定量试剂盒(批号:00323,中国康为世纪公司)、蛋白电泳快速染色液(批号:210101,上海起发实验试剂有限公司)、蛋白分子marker(批号:P0072,中国碧云天公司)、4%~12%凝胶(批号:23011010、美国Thermo 公司)、VWF 抗体(批号:20059269,美国Agilent 公司)、兔抗(批号:25,美国CST 公司)、GelBond©Film 支撑膜(批号:0000967604,瑞士Lonza 公司)、电泳缓冲液(批号:2474142,美国Thermo 公司)、蛋白纯化仪(AKTA avant 150,GE Healthcare 公司)、层析柱(XK16/20,GE Healthcare 公司)、超纯水系统(F8MN01220,美国Millipore 公司)、多功能酶标仪(Spectra Max M2e,美 国Molecular Devices 公司)、凝血仪(CA-1500,日本Sysmex 公司)、垂直电泳仪(Xcell Surelock,美国GE 公司)。
1.2 待脱盐样品
FⅧ分离纯化后获得FⅧ溶液,其中FⅧ∶C 为18.94 IU/mL,蛋白浓度为3.5 g/L、甘氨酸浓度为12.5 g/L、Na+浓度为15.4 g/L、柠檬酸根浓度为101.2 g/L。
1.3 方法
1.3.1 样品脱盐
将制备好的样品,分别用Sephadex G-25 Medium 凝胶脱盐、Fractogel EMD BioSEC 凝胶脱盐、超滤脱盐、室温透析脱盐和4℃透析脱盐等5 种脱盐方法进行脱盐。
1.3.1.1 凝胶层析脱盐
凝胶层析脱盐分别为Sephadex G-25 Medium凝胶脱盐和Fractogel EMD BioSEC 凝胶脱盐。Sephadex G-25 Medium 凝胶脱盐将凝胶填料Sephadex G-25 Medium 缓慢装进层析柱中,装柱过程避免气泡产生。 在凝胶填料使用条件范围内,用流速4 mL /min 的去离子水进行柱平衡。 待填料平衡完成后(柱高14 cm)进行柱效测定。 用注射器缓慢将1 mL F Ⅷ制品注射到上样阀中,上样流速为1 mL/min。 用1 mL /min 的流速洗脱蛋白,使用AKTA 蛋白纯化系统连续监测洗脱液280 nm 的光密度(optical density,OD)值。 根据OD280nm 值的变化,待起峰时开始收取样品,当OD280nm 值降低到10 mAu 以下且不再发生变化时,终止收取样品。Fractogel EMD BioSEC 凝胶填料与上述相同的方式进行操作。 2 种凝胶脱盐均进行3 次重复。
1.3.1.2 超滤脱盐
向截留分子量为30 kD 的超滤离心管中加入待脱盐的FⅧ样品4 mL,条件为4℃、4 000 g 离心30 min,超滤后的样品加入去离子水恢复至原体积后收集样品,再进行3 次实验重复。
1.3.1.3 透析脱盐
透析脱盐分为室温透析脱盐和4℃透析脱盐。室温脱盐时,向透析袋中加入待脱盐的FⅧ样品4 mL,浸泡在室温的去离子水中,每2 h 换1 次水,10 h 后收集处理好的FⅧ,进行下一步分析。 在4℃等环境下与上述相同的方式进行操作。 2 种透析各进行3 次实验重复。
1.3.2 样品分析
将上述5 种方法脱盐处理后的FⅧ溶液进行如下分析。
1.3.2.1 FⅧ效价检测
采用一期法进行测定[8]。 将FⅧ样品按一定比例稀释,确保稀释后样品检测值在标准曲线内。严格按照FⅧ∶C 检测试剂盒及全自动凝血仪的操作,进行FⅧ∶C 检测。
1.3.2.2 蛋白质含量检测
采用Bradford 法进行测定[9],用BSA 作为标准品作标准曲线。 在96 孔板中分别加入5 μL 脱盐后样品,最后每孔中加入250 μL 工作液,室温反应10 min,用酶标仪测定595 nm 处的吸光度,计算样品中的蛋白浓度。
蛋白回收率(%)=(FⅧ脱盐前蛋白浓度-FⅧ脱盐后蛋白浓度)/FⅧ脱盐前蛋白浓度×100%
1.3.2.3 VWF 抗原和活性检测
VWF ∶Ag 和VWF ∶Ac 检测均采用免疫比浊法进行分析[10],在CA-1500 凝血仪上进行免疫比浊法测定,按仪器和试剂盒说明书进行操作。
1.3.2.4 VWF 多聚体检测
按照文献[11]方法,VWF 多聚体分析采用琼脂糖凝胶垂直电泳方法,并加以改进。 具体步骤为:配制0.8%琼脂糖浓缩凝胶,凝胶缓冲体系为70 mM Tris,4 mM Na2EDTA,0.4% SDS,pH 6.8。 配制1.2%琼脂糖分离凝胶,凝胶缓冲体系为0.1 M Tris, 0.1 M 甘氨酸,0.4% SDS,pH 8.8。 电泳缓冲液为50 mM Tris,0.384 M 甘氨酸,0.1%SDS。 待测样品稀释缓冲液为10 mM Tris,1 mM Na2EDTA,2%SDS, 20%甘氨酸和2 mg/mL 溴酚蓝,按一定比例稀释。 60℃孵育20 min 后上样(20 μL/孔)。 8℃条件4 mA 恒流电泳14 ~15 h。 电泳结束后,去离子水洗涤2 次(每次10 min),将凝胶置于Gel-Bond©Film 支撑膜上风干过夜。 5%脱脂奶粉-PBST 室温封闭2 h。 用0.1% PBST 洗膜3 次(每次5 min),加入1 ∶2 500 的VWF 多克隆抗体4℃过夜孵育,0.1% PBST 洗涤3 次(每次20 min),加入1 ∶2 500 的二抗室温孵育2 h。 将显色液1 ∶1混匀后再进行显影。
1.3.2.5 SDS-PAGE 分析
参照文献[12]并加以改进。 使用4%~12%梯度凝胶分别在还原条件和非还原条件下进行分析。样品的制备方法如下:将脱盐前样品和5 种方法脱盐后的原液样品,在还原条件中加入5%β-巯基乙醇,非还原条件中不加β-巯基乙醇,上样缓冲液与样品比例为1 ∶4,将混合物在100℃下加热6 min。上样量为15 μL,以恒定电压200 V 垂直电泳仪电泳运行40 min,电泳结束后凝胶用考马斯亮蓝染色。 用超纯水均稀释至1 g/L 的样品与上述相同的方式进行操作。
1.3.2.6 样品中盐的残留量
钠离子和柠檬酸根残留量:采用离子色谱法,3.5 mmol/L 碳酸钠和1.0 mmol/L 碳酸氢钠配置缓冲液,以1.0 mL/min 流速经过色谱柱进行检测。甘氨酸残留量:利用氨基酸分析仪检测,用配置的缓冲液以20 mL/h 流速经过分离柱Na 型阳离子树脂层析柱进行检测。去除率(%)=(FⅧ脱盐前含量-FⅧ脱盐后含量)/ FⅧ脱盐前含量×100%
1.4 统计学分析
2 结果
2.1 凝胶过滤脱盐
F Ⅷ样品分别通过Sephadex G-25 Medium、Fractogel EMD BioSEC 凝胶脱盐后均有2 个洗脱峰,FⅧ与盐离子因分子量差异在层析柱中滞留时间不同而得到分离,即分子量大的蛋白质先洗脱出峰(见图1 蛋白峰),分子量相对小的盐离子后洗脱出峰(见图1 电导峰)。
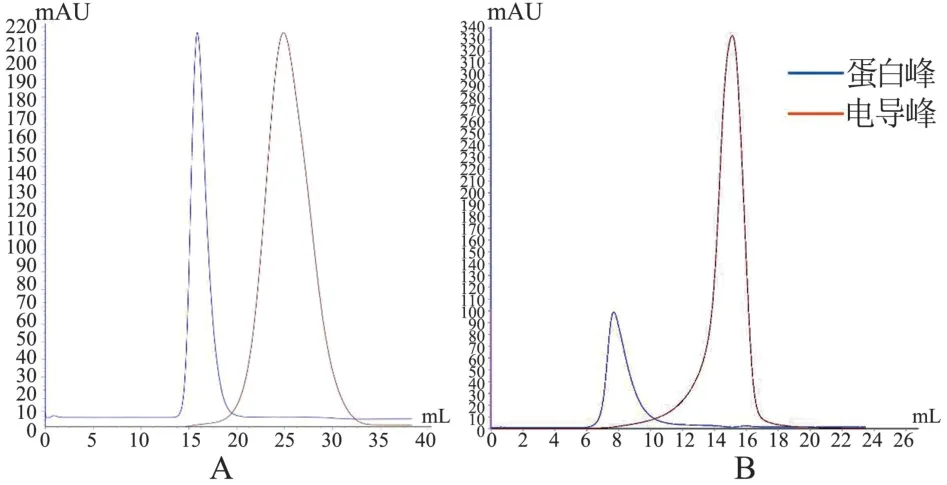
图1 凝胶过滤蛋白峰和电导峰Figure 1 Gel filtration protein peak and conductance peak
2.2 不同脱盐方法蛋白回收率
蛋白回收率可以反映脱盐过程中蛋白的损失量,由于受不同脱盐方法的影响,蛋白损失程度不同。 从图2 中可以看出,不同脱盐方法之间蛋白回收率存在统计学意义。 超滤脱盐蛋白回收率最高为(96.41±1.37)%显著高于Sephadex G-25 Medium凝胶脱盐(70.84±1.49)%、Fractogel EMD BioSEC凝胶脱盐(67.56±1.53)%、室温透析脱盐(73.03±3.29)%、4℃透析脱盐(79.26±6.92)%的蛋白回收率。 Fractogel EMD BioSEC 凝胶脱盐蛋白回收率最低为(67.56±1.53)%与Sephadex G-25 Medium 凝胶脱盐蛋白回收率无统计学意义(P=0.60)。 室温透析脱盐与4℃透析脱盐蛋白回收率无统计学意义(P=0.79)。 由此可知,超滤脱盐蛋白回收率最高。
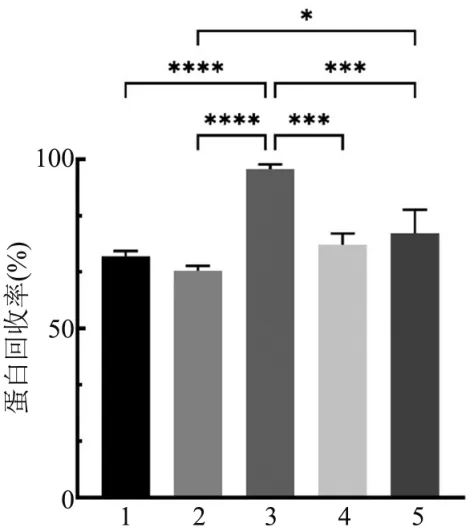
图2 不同方法脱盐蛋白回收率Figure 2 Recovery rate of desalted protein by different methods
2.3 不同脱盐方法脱盐效果
去除率可以反映脱盐过程中不同脱盐方法的脱盐效果对蛋白质的影响,去除率越高脱盐效果越好。
由图3 可知,在Na+去除率方面,超滤脱盐去除率最低为(97.90±0.06)%,Fractogel EMD BioSEC 凝胶脱盐去除率最高为(99.82±0.07)%。 Sephadex G-25 Medium 凝胶脱盐与Fractogel EMD BioSEC 凝胶脱盐相比无统计学意义(P=0.90),其他4 种方法之间去除率存在统计学意义。 在甘氨酸去除率方面,超滤脱盐去除率最低为(95.78±0.42)%,Fractogel EMD BioSEC 凝胶脱盐去除率最高为(99.81±0.08)%。 超滤脱盐与其他4 种脱盐方法之间去除率存在统计学意义,但其他4 种脱盐方法之间去除率无统计学意义。 柠檬酸根离子在5 种脱盐方法之间去除率无统计学意义(P=0.85)。 由此可知,超滤脱盐去除率最低、Fractogel EMD BioSEC 凝胶去除率最高。

图3 Na+(A)、甘氨酸(B)、柠檬酸根(C)在5 种脱盐方法的去除率Figure 3 The removal rate of Na+(A), glycine (B) and citrate (C) in five desalination methods
2.4 不同脱盐方法对FⅧ和VWF 的影响
FⅧ∶C 和VWF 的各项指标,可以反映脱盐过程中对蛋白质的影响。 不同方法脱盐前后的FⅧ∶C、VWF 活性及含量见表1。 在FⅧ∶C、VWF ∶Ac 和VWF ∶Ag 方面,超滤脱盐与脱盐前无统计学意义,其他4 种方法与脱盐前存在统计学意义,较脱盐前有明显的下降。 对于VWF ∶Ac/VWF ∶Ag 5种方法脱盐前后无统计学意义。

表1 不同脱盐方式FⅧ中FⅧ∶C 与VWF 指标Table 1 Activity of FⅧ∶C and VWF in the FⅧsample prepared by different desalination methods
2.5 SDS-PAGE 分析
对脱盐前后FⅧ样品进行SDS-PAGE 进行分析,结果见图4。 可以看出,无论是还原条件还是非还原条件下,5 种方法脱盐后在原液状态时,蛋白条带深浅、粗细不一致,说明不同脱盐方式蛋白损失程度有差异(图5A、B)。 当把5 种方法脱盐前后的样品蛋白浓度均为1 g/L 后,发现脱盐前后蛋白条带均有很好的一致。 由此可说明不同脱盐方法对蛋白组成的种类不会产生明显影响(图5C、D)。

图4 不同浓度下的非还原条件(A)和还原条件(B)、同浓度下的非还原条件(C)和还原条件(D)Figure 4 Non-reducing conditions (A) and reducing conditions (B) at different concentrations,non-reducing conditions(C) and reducing conditions (D) at the same concentration
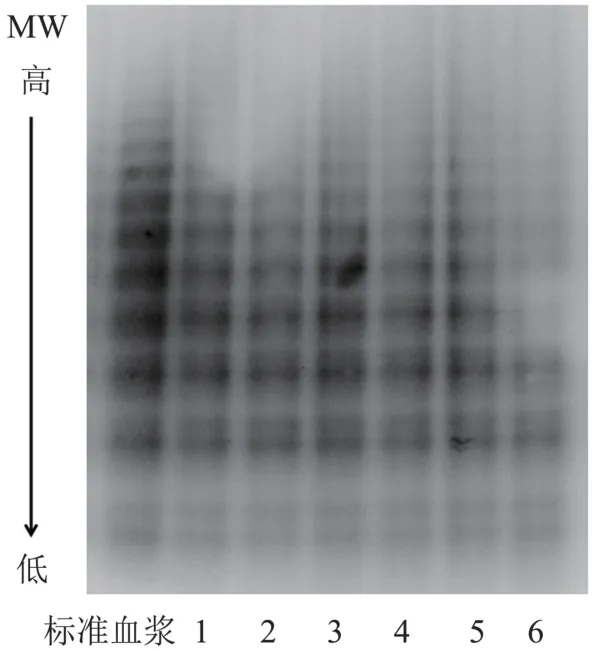
图5 VWF 多聚体分布Figure 5 VWF polymer distribution
2.6 VWF 多聚体分析
对不同方法脱盐前后FⅧ样品进行VWF 多聚体分布分析,结果见图5。 同样可看出,尽管脱盐方法不同,但脱盐前后FⅧ样品中VWF 多聚体条带分布一致,同时与标准血浆中的一致,说明5 种方法脱盐,对FⅧ样品中多聚体种类无明显影响。
3 讨论
随着现在生物技术的不断发展以及蛋白质工程的不断应用,下游的蛋白纯化显得尤为重要。 在蛋白纯化及蛋白药品制备过程中,降低盐离子浓度或更换溶液中盐离子种类,通常采用脱盐处理的方式。 目前常用的蛋白脱盐技术有凝胶层析、超滤和透析等[13]。 凝胶层析是利用多孔网状结构的颗粒的分子筛作用[14],根据分离物质分子量不同导致在颗粒中流动的速度不同,导致停留在颗粒中的时间长短不同而实现分离,适用于各种肽类、激素、蛋白质、多糖、核酸的分离纯化、脱盐、浓缩以及分析测定等,具有分离效果好、重复性高等特点。 分子量相近的物质难以达到很好的分离。 此外,与超滤和透析相比,其滤过效率较低,不适合大量样品的脱盐,同时对设备及操作技术要求较高[15]。 透析脱盐利用半透膜分离大小不同的分子,透析的动力是由横跨膜两边的浓度梯度形成的,其操作简单、成本低廉、条件温和,广泛应用于生产。 但透析所需时间长,需要大体积的缓冲液也是其局限因素[16]。 超滤脱盐也是利用膜分离技术,依靠膜两侧的压力差为动力,使小分子物质通过,大分子物质被保留从而达到分离的目的[17]。 超滤具有纯化和浓缩的双重作用,是其他2 种方式不具备的。 超滤在制备的过程中随着小分子的不断排出,大分子被截留堆积在膜表面,浓度越来越高会使超滤速度减慢,也有膜堵塞的风险[18]。 由上可知每种脱盐方式都有优缺点,但截至目前,不同脱盐方式的脱盐效果及对目的蛋白的影响未见研究报道。 本研究基于FⅧ探讨5 种脱盐方法的脱盐效果及对蛋白的回收率、FⅧ成分的影响,以期填补该方面研究空白。
人血源FⅧ制品来源于人血浆,生产过程中FⅧ与VWF 不易分开,通常血源FⅧ制品中含有VWF。 FⅧ分子量约为300 000 kD,本实验选择的透析膜和超滤膜,依据其孔径大小,FⅧ无法通过。另外,对于凝胶过滤而言,FⅧ分子量远高于盐离子,离子通过凝胶的速度远快于FⅧ。 尽管不同厂家FⅧ制品中的VWF 含量存在差异,VWF 以多聚体形式存在,其分子量在500 ~20 000 kD 之间,所形成的FⅧ与VWF 复合物分子量更大。 因此,理论上即使不同FⅧ制品中VWF 的含量不同,其对脱盐效果应无影响。 但实际情况下不同含量VWF的FⅧ对脱盐效果是否有影响本实验尚未论证,后续可进一步实验。
研究中选用Sephadex G-25 Medium 凝胶和Fractogel EMD BioSEC 两种凝胶分别对FⅧ进行脱盐,2 种凝胶可区分的分子量范围分别为1 000 ~5 000 kD 和5 000~1 000 000 kD,FⅧ是分子量高达100~200 万的糖蛋白[19],因此均适用于FⅧ与小分子盐离子的分离。 通过图3,可以发现Sephadex G-25 Medium 凝胶和Fractogel EMD BioSEC 凝胶,在Na+(P=0.90)、柠檬酸根离子(P=0.87)和甘氨酸(P=0.63)去除率上无统计学意义,两者脱盐效果相当。 但与其他脱盐方法相比,凝胶层析脱盐蛋白回收率较低,原因可能是凝胶对带电荷蛋白质的非特异性吸附导致了流穿下来的蛋白损失[20]。
本研究发现,在其他相同条件下,室温透析脱盐FⅧ∶C 回收率约为30%(表1), 4℃透析脱盐FⅧ∶C 回收率约为45%(表1), FⅧ∶C 回收率下降为15%。 王晓峰等[21]研究表明,FⅧ因子在制备过程中,6 ~10 h 内随着温度的升高活性下降速度明显,在2 ~6℃环境中制备的凝血因子活性,优于15℃和室温水平下的活性,其结果与本研究结果一致。 另外,FⅧ属于不稳定凝血因子,在体内半衰期较短,个体间变异性高,FⅧ半衰期在6 ~25 h(中位为12 h)之间变化[22]。 易丧失活性,离体后接触异物会有不同程度的激活而失去活性[7]。 因此,脱盐时间长短也是导致FⅧ∶C 下降的原因,透析脱盐FⅧ∶C 远低于其他脱盐方式,其原因与透析脱盐较长的处理时间有关。
由图2 可知,部分脱盐方式蛋白质回收率较低,蛋白损失较大。 因此对不同方式脱盐前后样品进行SDS-PAGE 和VWF 多聚体分布进行分析。 通过SDS-PAGE 电泳,可以看出脱盐前后样品的蛋白质种类无明显变化。 此外,通过VWF 多聚体分析(图5),也发现不同方式脱盐后其多聚体种类变化不明显。 VWF ∶Rcof/VWF ∶Ag 可在一定程度上反映VWF 的多聚体组成以及VWF 的完整性[23]。Geisen 等[24]实验表明,使用VWF ∶Ac 测定的结果与VWF ∶RCo 测定的结果相当,检测VWF ∶Ac/VWF ∶Ag 的敏感性更高,因此本研究采用VWF ∶Ac代替VWF ∶Rcof 进行活性测定。由表1 可知,不同方式脱盐前后样品中VWF ∶Ac/VWF ∶Ag 无统计学意义,从另一个角度也说明了本研究所涉及的脱盐方式对VWF 多聚体种类影响不明显。
超滤脱盐的蛋白回收率、FⅧ的活性以及VWF的相关指标均高于其他2 种方式,其原因可能与超滤时间短、操作便捷有关。 但在脱盐效果上,超滤去除小分子的效果低于其他2 种方式,这可能与超滤的次数相关(本研究采用了2 次超滤)。 随着超滤洗涤次数的增加,液体平均通量基本保持不变,但脱盐效果却有显著提高,增加超滤次数对脱盐有较好的效果[25]。
通过本研究可以看出,相对于凝胶层析脱盐与透析脱盐,超滤脱盐在FⅧ∶C、VWF 活性及蛋白回收率方面效果最佳。 尽管超滤的脱盐效果相对较低,但可进一步优化。 FⅧ在血浆蛋白的纯化过程中回收率仅为10%[26],在工业生产过程中各生产步骤均会影响蛋白回收。 因此,应对各个环节进行深入探究,尤其在FⅧ纯化过程中,尽量提高蛋白回收,避免活性损失,提高血浆资源的综合利用率。
利益冲突说明/Conflict of Interests
所有作者均声明不存在利益冲突。
伦理批准及知情同意/Ethics Approval and Patient Consent
本文不涉及伦理批准及知情同意。
作者贡献/Authors' Contribution
裴仁俊:实验实施、实验数据分析、论文撰写;杜晞、孙盼:实验数据分析;黎小月:文献查阅;蒋鹏、李长清:实验指导;林方昭、曹海军:实验设计、论文审核、资金提供。

