石墨烯介导巨噬细胞膜涂层的制备及对钛种植体防污和免疫调控性能的影响
雷嘉辉,罗 斌,孙小庆,张宇佳,胡筱琴,蓝 芳,吴 尧
(1. 四川大学国家生物医学材料工程技术研究中心,2. 分析测试中心, 成都 610064)
随着现代医学的进步,钛种植体由于能恢复牙齿美观与咀嚼功能,已成为牙齿缺失患者的首选治疗方法之一,因此对于钛种植体置换的需求也日益增加. 当钛种植体植入牙床后,宿主蛋白能够非特异性吸附在钛种植体表面并引发异物反应. 同时,异物植入引起的过度炎症反应会导致骨融合不良和钛种植体失效[1~4]. Li等[5]将纳米二氧化铈涂覆在钛种植体表面,通过调控纳米二氧化铈的微观形貌来消除钛种植体引发的炎症反应. Chen等[6]将硅烷化抗菌肽GL13K固定在钛片表面,发现其对M1型巨噬细胞有抑制作用,能有效降低炎症反应. Yang 等[7]将超支化聚L-赖氨酸共价接枝在钛基种植体表面,发现种植体在早期具有良好的抗炎能力,并能有效促进骨融合. 因此,在钛种植体表面进行生物功能化改性对促进骨融合和防止钛种植体失效至关重要. 由于磷脂双分子层中丰富的两性离子以及糖蛋白的空间位阻,细胞膜可提供优良的防生物污染性能[8]. 此外,特定的细胞膜表面标记物可提供特有的生物学功能,如红细胞膜表面丰富的CD47受体与巨噬细胞表面的信号调节蛋白α受体的相互作用能够有效减轻炎症反应[9]. 巨噬细胞是参与免疫调控过程最重要的免疫细胞之一,其中M2型巨噬细胞在抗炎、 组织重塑和前愈合过程中扮演着重要角色[10~13]. 因此,开发M2型巨噬细胞膜涂层的钛种植体有望解决生物污染和消除炎症反应等问题.
最近,有报道通过反复浸入干燥的方法将细胞膜简单地包覆于植入电极表面,植入电极可展现出良好的生物相容性[14]. Tao等[15]直接将猪源透明软骨浸入细胞膜溶液中,制得细胞膜包被的软骨,实验结果显示其可显著消除炎症反应. 然而,上述细胞膜涂层制备技术存在效率低和稳定性差等问题. 钛种植体的骨融合是一个长期的过程,需要钛种植体涂层具有良好的稳定性和生物相容性以满足愈合的需要[16]. 因此,急需开发稳定、 均匀且简便的细胞膜涂层的制备方法,这将有利于细胞膜包覆的钛种植体的长期有效性[17].
受贻贝启发,多巴胺在弱碱性环境下发生自聚,生成含有大量邻苯二酚结构的聚多巴胺,使其可以吸附在几乎任何固体物质的表面,形成聚多巴胺层. 其可作为反应“桥梁”,通过迈克尔加成或希夫碱反应在材料表面引入其它功能性基团. 石墨烯因其在材料科学和生物医学领域的重要应用前景,被认为是一种革命性的材料[18~21]. 研究发现,石墨烯纳米片与磷脂分子间存在极强的相互作用力,石墨烯纳米片可以直接从活细胞中剥离出细胞膜. 在本课题组的前期工作中,采用层层自组装技术将石墨烯纳米片固定在磁性纳米粒子表面,然后通过纳米粒子与白细胞共孵育,将白细胞膜修饰于纳米粒子表面[22]. 因此,结合聚多巴胺和石墨烯的优势,有望在钛种植体表面制备出理想的细胞膜涂层[23,24].
基于此,本文提出了一种在钛种植体表面简便制备稳定且均匀的细胞膜涂层的策略(Scheme 1).首先,通过聚多巴胺将石墨烯纳米片均匀地修饰在钛种植体表面,然后借助氧化石墨烯层剥离M2型巨噬细胞膜,制得M2型巨噬细胞膜包覆的钛种植体. 实验结果表明,聚多巴胺和石墨烯的有机结合可在宏观水平上显著提高M2型巨噬细胞膜涂层的稳定性和均匀性. 与传统的细胞膜涂层制备方法相比,该策略具有简便、 高效和稳定等优势. 所制备的M2型巨噬细胞膜涂层具有细胞膜的生物功能,包括良好的生物相容性和抗蛋白非特异性吸附能力. 同时,在微观层面上,可以调控巨噬细胞极化为M2型,在免疫调控方面具有消除炎症和促进组织修复的潜力. 本文提出的石墨烯介导的巨噬细胞膜涂层的制备策略有望成为一个在宏观水平上扩展细胞膜功能的材料制备平台,并在植入材料领域展现出广阔的应用前景.
1 实验部分
1.1 试剂与仪器
盐酸多巴胺(纯度≥98%),上海麦克林生化科技有限公司; 丙酮(纯度≥99.8%)、 三羟甲基氨基甲烷(Tris,化学纯)、 多聚甲醛(化学纯)、 乙二醇辛基苯基醚(TritonX-100)和脂多糖(LPS),成都默克有限公司; 无水乙醇(分析纯),成都市科隆化学有限公司; 单层氧化石墨烯(分析纯),苏州碳丰石墨烯科技有限公司; 白介素4(IL-4),苏州派普泰克生物科技有限公司; 高糖培养基(DMEM)、 胎牛血清(FBS)、 青霉素与链霉素(Penicillin-Streptomycin)和磷酸盐缓冲液(PBS),上海赛默飞世尔科技有限公司; 绿色细胞膜荧光染料(Dio),上海碧云天生物科技有限公司; 一抗(Anti-Mannose Receptor),盐城市菲亚生物科技有限公司; 羊抗小鼠二抗(Goat Anti-Mouse IgG H&L)、 羊抗兔二抗(Goat Anti-Rabbit IgG H&L),成都正能生物科技有限公司; 牛血清白蛋白(FITC-BSA)和人血清白蛋白(FITC-HAS),西安瑞禧生物科技有限公司; SYBR Green Pro Taq HS 预混型qPCR 试剂盒,扬州艾瑞克生物科技有限公司;FDA/PI双染细胞毒性检测试剂盒,贝博生物科技有限公司.
Zeiss ZS880型激光共聚焦显微镜(LSCM),德国Zeiss公司; Leica DMi8型倒置荧光显微镜,上海徕卡显微系统贸易有限公司; HORIBA S-4800 型扫描电子显微镜(SEM),苏州塞恩斯仪器有限公司;TY-SDJ80 型水接触角测量仪,潍坊天研仪器有限公司; VERTEX 70v 型傅里叶变换红外光谱仪,上海尔迪仪器科技有限公司; Nexsa G2 型X 射线光电子能谱仪(XPS),上海硅仪生化科技有限公司;CIENTZ型超声波细胞粉碎机,宁波新芝生物科技股份有限公司; MILLI-Q超纯水制备仪,成都默克有限公司; Centrifuge 5424R型低温离心机,上海土森视觉科技有限公司.
1.2 实验过程
1.2.1 M2型巨噬细胞膜涂层的制备 搅拌条件下将21 mL去离子水(RO水)与9 mL无水乙醇混合,制得体积分数为30%的乙醇溶液. 将90 mg氧化石墨烯分散在30 mL 30%乙醇溶液中,制得分散均匀的石墨烯分散液. 将裸钛片(直径14.5 mm,厚度2 mm)依次用240#,400#,800#,1000#和1200#砂纸抛光,然后在超纯水(UP 水)、 丙酮、 无水乙醇和UP 水中依次超声10 min. 将钛片浸泡在多巴胺溶液(5 mg/mL)中,然后置于摇床上,以200 r/min的频率振荡反应24 h. 用RO水洗涤2次,室温下晾干. 将石墨烯分散液(3 mg/mL)滴加在钛片表面,于60 ℃烘箱中烘干. 再重复一次上述过程,得到均匀的氧化石墨烯层. 采用IL-4(20 ng/mL)刺激RAW264.7细胞24 h后,用PBS缓冲溶液离心(1200 r/min)洗涤3次; 随后将M2型巨噬细胞悬液与Ti-PDA-GO材料共振荡孵育2 h,静置0.5 h后用PBS缓冲溶液洗涤,最后在Ti-PDA-GO材料表面得到一层致密、 均匀且稳定的M2型巨噬细胞膜涂层.
1.2.2 材料理化性能表征 采用扫描电子显微镜在20 kV 电压下分别观察Ti,Ti-PDA-GO 和Ti-PDAGO-M 材料的微观形貌(观察前需进行喷金处理). 使用水接触角测量仪分别测量Ti,Ti-PDA-GO 和Ti-PDA-GO-M材料的水接触角,分析各修饰涂层的亲疏水性. 采用傅里叶红外光谱和X射线光电子能谱分析各修饰涂层的化学成分和结构.
1.2.3 蛋白非特异性吸附实验 将Ti,Ti-PDA-GO 和Ti-PDA-GO-M材料分别与0.5 mg/mL 的异硫氰酸荧光素标记的牛血清白蛋白(FITC-BSA)和人血清白蛋白(FITC-HAS)在25 ℃下避光振荡孵育24 h. 随后用PBS缓冲溶液洗涤,在倒置荧光显微镜下观察各材料表面的荧光信号.
1.2.4 细胞培养 采用高糖培养基、 青霉素-链霉素(双抗)和胎牛血清培养RAW264.7 细胞,所用RAW264.7 细胞代数均在2~10 代以内,置于培养箱中培育. 培养箱条件参数为37 ℃,含5% CO2的空气,培养条件皆满足无菌要求.
1.2.5 细胞增殖 将Ti,Ti-PDA-GO 和Ti-PDA-GO-M 材料分别与RAW264.7 在24 孔板中培养1,3,5和7 d(初始接种量为104个RAW264.7细胞). 在1,3,5和7 d时,分别取出各材料,用PBS缓冲溶液洗涤后,在37 ℃下用二乙酸荧光素(FDA)染色15 min,再用PBS缓冲溶液洗涤,在共聚焦显微镜下观察各材料表面的荧光信号.
1.2.6 M2型巨噬细胞膜涂层稳定性实验 采用Dio 对M2型巨噬细胞进行预染色. 用预染后的M2型巨噬细胞膜制备Ti-PDA-GO-M材料,然后在PBS缓冲溶液中浸泡14 d. 分别在1,5和14 d时取出,用PBS缓冲溶液洗涤后,在倒置荧光显微镜下观察Ti-PDA-GO-M材料表面的荧光信号.
1.2.7 实时荧光定量聚合酶链式反应 将RAW264.7 细胞接种到24 孔板中(初始接种量为5×105个RAW264.7细胞),分别与Ti,Ti-PDA-GO和Ti-PDA-GO-M材料共孵育24 h(处于100 ng/mL的LPS环境中). 利用TRIZOL法提取每个样品表面细胞总RNA,随后逆转录为cDNA. 根据设计的引物,按照试剂盒说明书操作,采用实时荧光定量聚合酶链式反应检测细胞表面促炎因子和抗炎因子的表达.
1.2.8 免疫荧光蛋白实验 将RAW264.7 细胞接种到24 孔板中(初始接种量为5×105个RAW264.7 细胞),分别与Ti,Ti-PDA-GO 和Ti-PDA-GO-M 材料共孵育24 h. 其中一组处于含100 ng/mL 脂多糖的环境中,另一组则处于2 mg/mL 脂多糖的环境中. 随后,在4 ℃下使用质量分数为4%的多聚甲醛固定20 min,然后用PBS 缓冲溶液洗涤2 次,再在4 ℃下用体积分数为0.1% 的triton X-100(免疫染色通透液)透膜,用PBS缓冲溶液洗涤2次,置于质量分数为4%的牛血清白蛋白溶液中,室温下孵育10 min,在4 ℃下采用一抗孵育12 h,用PBS 缓冲溶液洗涤. 在37 ℃下采用二抗孵育1 h 后用 PBS 缓冲溶液洗涤,随后在室温下用细胞核染料(DAPI)染色5 min,用PBS缓冲溶液洗涤,在共聚焦显微镜下观察各个材料表面的荧光信号.
2 结果与讨论
2.1 M2型巨噬细胞膜涂层的制备与表征
首先,经抛光处理得到表面光滑、 洁净的Ti片; 然后,通过多巴胺在Ti片表面自聚,形成一层聚多巴胺层,得到Ti-PDA材料; 随后,将石墨烯分散液滴加在Ti-PDA材料表面,烘干后得到Ti-PDA-GO材料. 同时,利用IL-4 刺激RAW264.7 细胞,使其极化成M2型. 再利用石墨烯层对磷脂的强相互作用力,将M2型巨噬细胞膜修饰到Ti-PDA-GO 材料表面,得到Ti-PDA-GO-M 材料. 如图1所示,首先根据侧向角散射(SSC)与前向角散射(FSC)排除细胞碎片部分确定RAW264.7细胞范围P1,随后排除黏连体得到范围P2,以正常培养RAW264.7 细胞作为空白对照组. 流式细胞术实验结果显示,IL-4 刺激24 h 后的RAW264.7 细胞表面蛋白CD206 有接近92.16%的阳性率,表明超过92%的RAW264.7 细胞已极化成M2型[25,26].

Fig.1 Flow cytometry results of RAW264.7 cells(A) and RAW264.7 cells stimulated by IL-4 for 24 h(B)
采用Dio对M2型巨噬细胞进行预染色,将染色后的M2型巨噬细胞分别与Ti,Ti-PDA和Ti-PDA-GO材料振荡孵育后,通过倒置荧光显微镜观察各材料表面的荧光信号. 由图2(A)~(C)可见,与Ti-M和Ti-PDA-M材料相比,Ti-PDA-GO-M材料的绿色荧光信号最强,说明石墨烯可以有效剥离M2型巨噬细胞膜并包覆在材料表面. 同时,整个视野均存在绿色荧光且荧光相对均匀,表明制备的M2型巨噬细胞膜涂层具有良好的均匀性. Image J的荧光半定量结果[图2(D)]给出同样的结论. 而细胞膜涂层的稳定性是另一个关键因素,将Dio 预染的Ti-PDA-GO-M 材料放置在PBS 缓冲溶液中,并分别在1,5 和14 d考察其表面M2型巨噬细胞膜涂层的稳定性. 由图3(A)~(C)可见,即使在14 d时Ti-PDA-GO-M材料表面依然有均匀的绿色荧光. Image J的荧光半定量结果[图3(D)]给出同样的结论. 这说明材料表面的M2型巨噬细胞膜涂层具有良好的稳定性,在钛种植体表面生物改性方面展现出一定的应用前景.

Fig.2 Fluorescence images(A—C) and semi-quantitative analysis of the fluorescence images(D)of Ti-M(A, a), Ti-PDA-M(B, b) and Ti-PDA-GO-M(C, c)(D) Error bars represent standard deviation(n=3); *P<0.05,**P<0.01,***P<0.001,****P<0.0001) vs. Ti-M group.
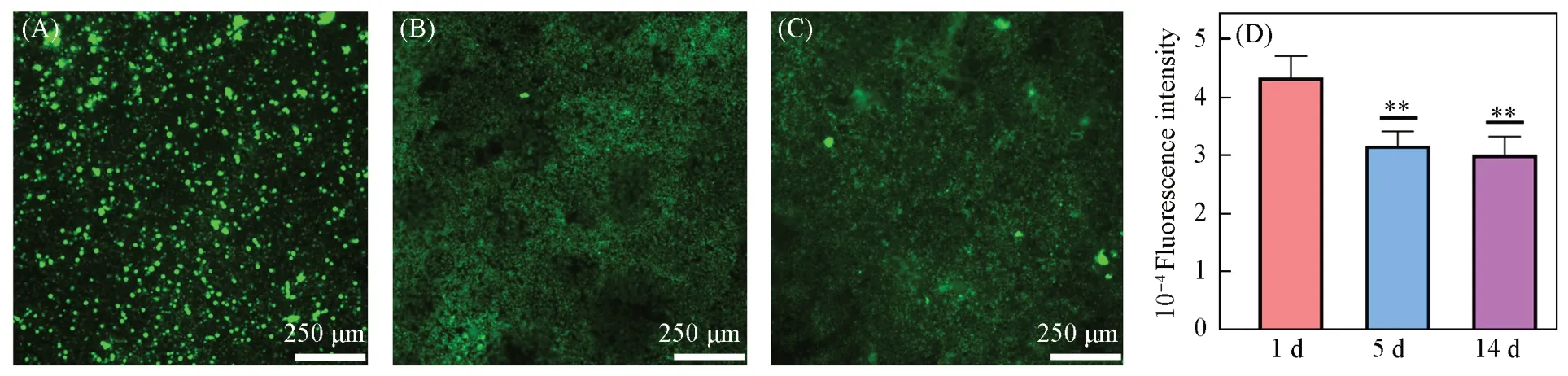
Fig.3 Fluorescence images(A—C), semi-quantitative analysis(D) of the stability of M2 macrophages coating at 1(A), 5(B), and 14 day(C)(D) Error bars represent standard deviation(n=3); *P<0.05,**P<0.01,***P<0.001,****P<0.0001) vs. 1 d group.
由图4(A)可见,Ti片表面可观察到清晰的抛光划痕. 修饰聚多巴胺和石墨烯后,Ti-PDA-GO材料表面可见明显相对褶皱的石墨烯层. 而包覆M2型巨噬细胞膜后,Ti-PDA-GO-M材料表面的石墨烯层明显变厚,并且由粗糙变为光滑,说明氧化石墨烯层与细胞膜之间的相互作用能够促进界面结合,从而成功修饰M2型巨噬细胞膜涂层. 进一步对材料表面的化学成分和结构进行了分析. 由图4(B)可见,Ti-PDA-GO材料的红外光谱图在3300~2500 cm-1处出现羧基O—H键的伸缩振动峰,在1750~1700 cm-1处出现羧基C=O键的伸缩振动峰,这些特征峰均归属于氧化石墨烯,证明以聚多巴胺作为桥梁修饰了氧化石墨烯层. 而在Ti-PDA-GO-M 材料的红外光谱图中出现PO2-的特征峰(1068 cm-1),侧面证明Ti-PDA-GO-M材料表面存在磷脂双分子层结构. 采用X射线光电子能谱考察了材料表面元素组成,进一步确定材料表面细胞膜涂层的存在. 由图4(C)可见,Ti片的X射线光电子能谱中主要有O1s(529.35 eV),C1s(285.20 eV)和Ti2p(458.27 eV)的信号峰; 而在Ti-PDA-GO材料的能谱中C1s的信号峰强度发生了显著增强,同时Ti2p的信号峰消失,证明聚多巴胺和石墨烯层完全将Ti片表面覆盖. 修饰M2型巨噬细胞膜涂层后,在Ti-PDA-GO-M材料的能谱中可观察到O1s信号峰强度显著下降,而N1s信号峰强度显著增加,同时能谱中出现P2p(133.25 eV)的信号峰,证明M2型巨噬细胞膜已修饰在Ti-PDA-GO 材料表面.
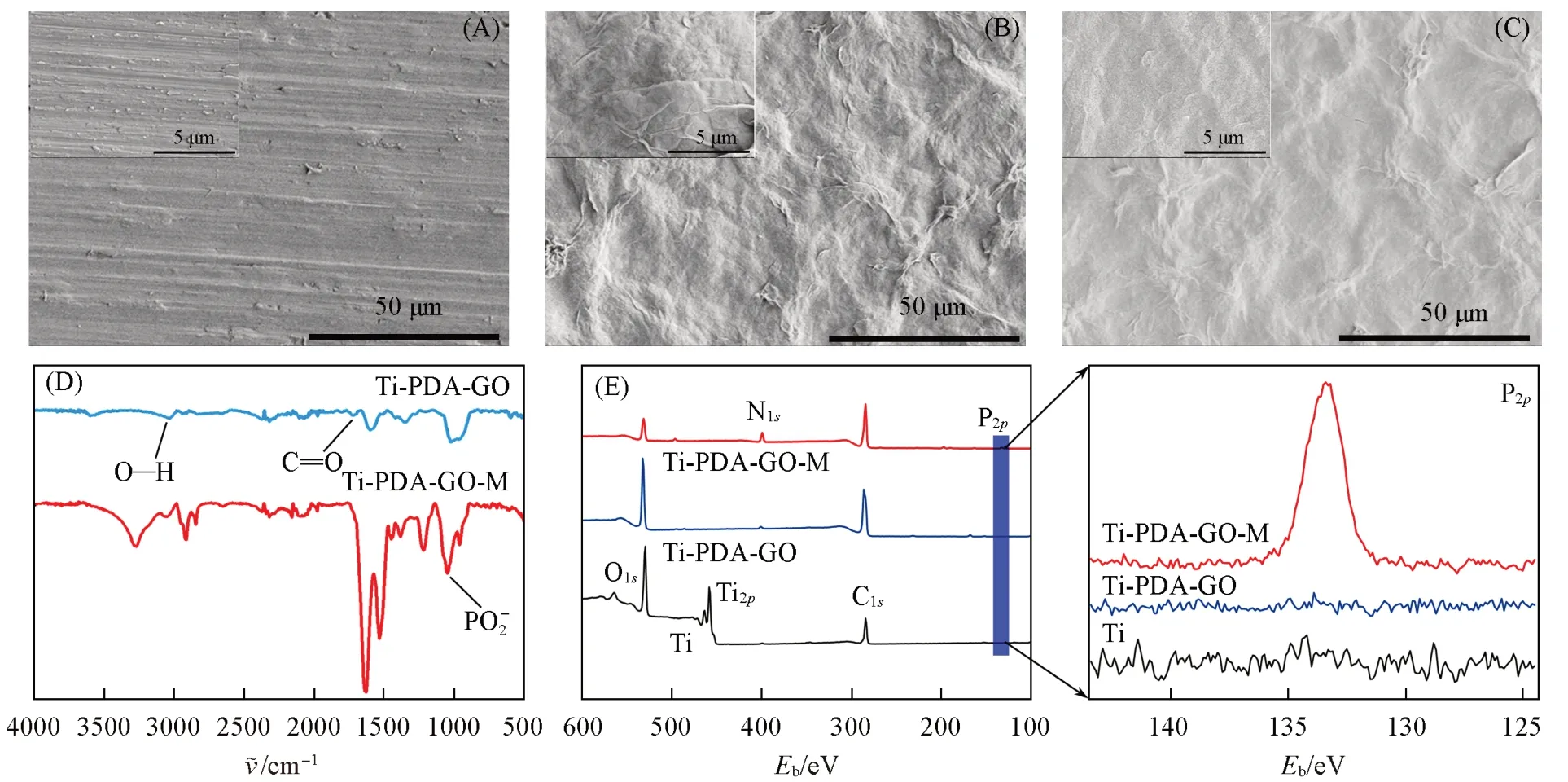
Fig.4 SEM images(A—C), IR spectra(D) and X-ray photoelectron energy spectra(E) of Ti(A),Ti-PDA-GO(B) and Ti-PDA-GO-M(C)Insets of (A—C): magnification SEM images of Ti,Ti-PDA-GO and Ti-PDA-GO-M.
2.2 M2型巨噬细胞膜涂层的防污性能研究
材料的防污能力与其表面的亲疏水性质密切相关. 由水接触角表征结果(图5)可见,Ti 片的水接触角约为95°,呈现显著的疏水性质. 修饰聚多巴胺和石墨烯后,Ti-PDA-GO材料的水接触角下降到约50°,疏水性有所改善. 而包覆了亲水性的细胞膜涂层后,Ti-PDA-GO-M材料的水接触角继续下降至约28°,呈现良好的亲水性.亲水性的表面能在钛种植体周围形成一个水合层,从而使其具备一定的防污性能[27,28].
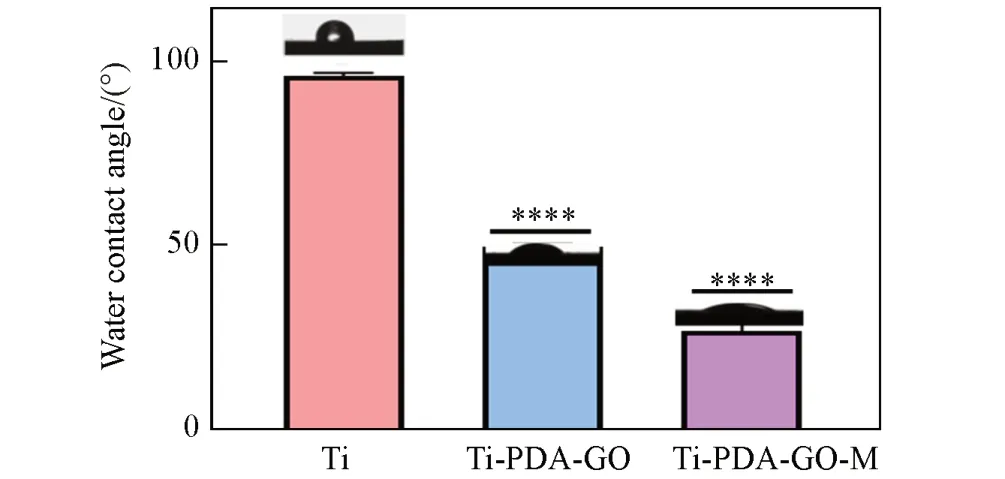
Fig.5 Water contact angle of Ti, Ti-PDA-GO and Ti-PDA-GO-MError bars represent standard deviation(n=3); *P<0.05,**P<0.01,***P<0.001,****P<0.0001) vs. Ti group.
对于植入材料而言,宿主蛋白的非特异性吸附会促进血小板的黏附,进而引发炎症反应,甚至导致植入材料失效[29]. 因此,评价钛种植体抗蛋白非特异性吸附性能至关重要. 实验采用FITC-BSA和FITC-HSA作为典型的模型蛋白,评估了材料的抗蛋白非特异性吸附性能. 将荧光标记的模型蛋白分别与Ti,Ti-PDA-GO和Ti-PDA-GO-M材料避光振荡孵育24 h,通过倒置荧光显微镜观察了各材料表面的荧光信号. 由图6(A)~(F)可见,Ti片表面可观察到极强的荧光信号,说明Ti片对牛血清白蛋白和人血清白蛋白均有较强的吸附性. Image J的荧光半定量分析结果如图6(G)和(H)所示,Ti-PDA-GO和Ti-PDA-GO-M材料表面的荧光强度很低,说明其几乎不吸附牛血清白蛋白和人血清白蛋白. 由图6(I)可见,Ti-PDA-GO材料表面的氧化石墨烯层使材料带负电,牛血清白蛋白和人血清白蛋白在PBS缓冲溶液中也带负电. 根据电磁理论,同极相互排斥. 因此,Ti-PDA-GO材料可以抵抗带负电蛋白的非特异性吸附. Ti-PDA-GO-M材料由于表面修饰了均匀的M2型巨噬细胞膜涂层,使其同样带负电,再加上其磷脂双分子层中丰富的两性离子,呈现出几乎不吸附牛血清白蛋白和人血清白蛋白的性质,表现出更优异的抗蛋白非特异性吸附性能.
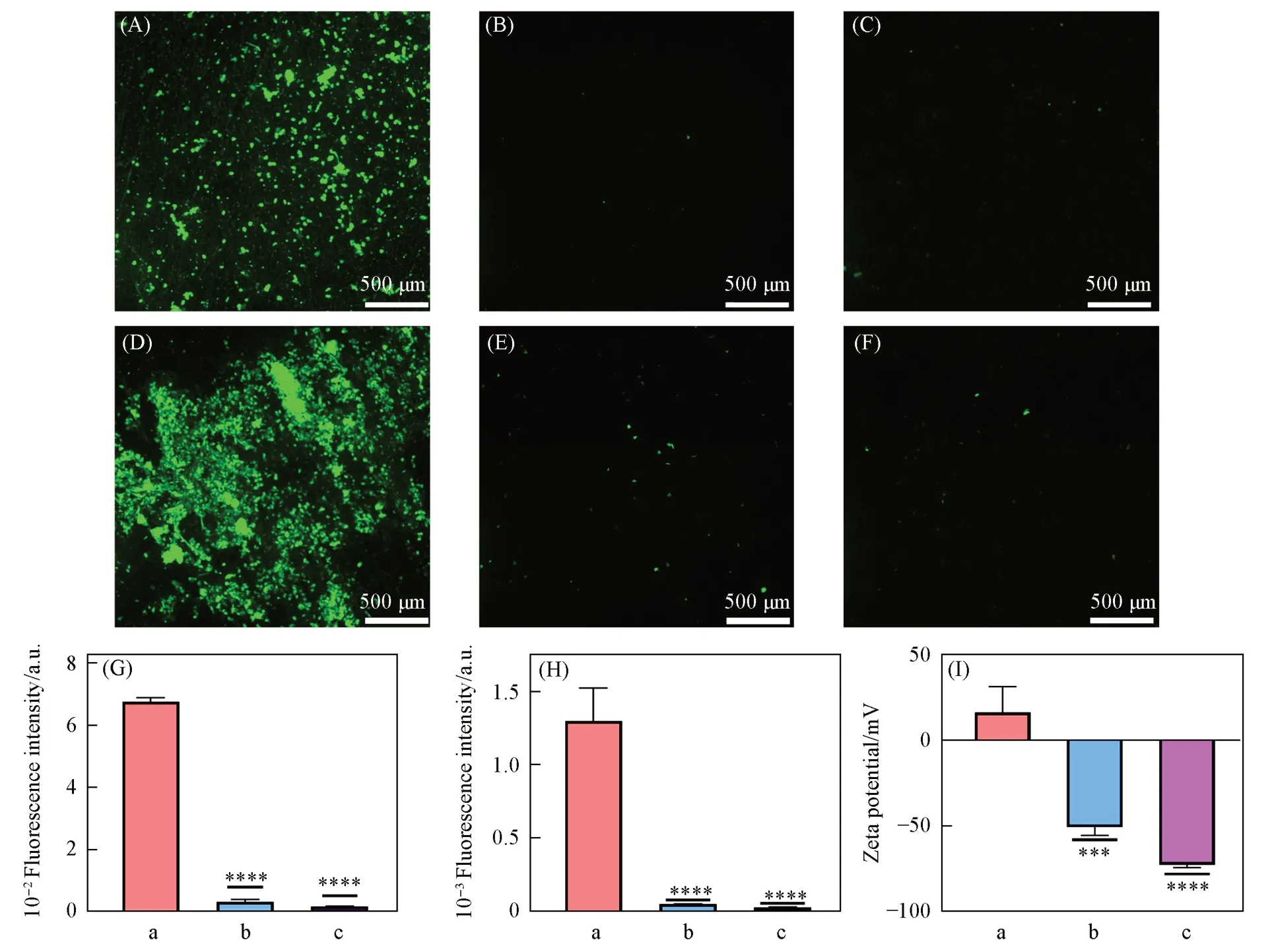
Fig.6 Fluorescence images(A—F) and semi-quantitative analysis of the fluorescence images(G, H)of BSA(A—C, G) and HAS(D—F, H) and zeta potential(I) on Ti(A, D, a), Ti-PDA-GO(B, E,b) and Ti-PDA-GO-M(C, F, c)(G—I) Error bars represent standard deviation(n=3); *P<0.05,**P<0.01,***P<0.001,****P<0.0001) vs. Ti group.
2.3 M2型巨噬细胞膜涂层的生物相容性
在实际临床应用中评估钛种植体对周围细胞活力的影响至关重要. 本文选择RAW 264.7细胞作为研究对象. 将其分别与Ti,Ti-PDA-GO 和Ti-PDA-GO-M 材料共孵育7 d. 分别在1,3,5 和7 d 采用FDA 对RAW 264.7 细胞骨架染色,利用共聚焦显微镜观察了材料表面的荧光信号并分析细胞增殖状态. 由图7可见,从1 d到7 d,Ti,Ti-PDA-GO和Ti-PDA-GO-M材料表面的荧光信号均呈现由低到高的趋势,但Ti-PDA-GO材料的荧光信号增幅较小,Ti-PDA-GO-M材料的荧光信号增幅最大. 由图8可见,Image J 的半定量分析给出相同的结论,说明Ti-PDA-GO-M 材料的M2型巨噬细胞膜涂层有利于RAW264.7细胞的增殖,为钛种植体提供了优异的生物相容性.
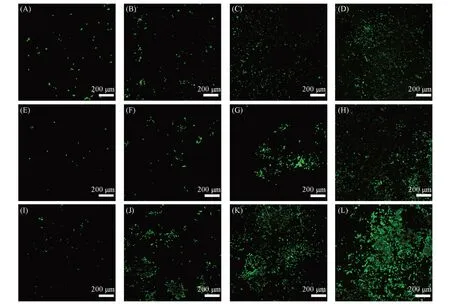
Fig.7 Fluorescence images of RAW264.7 cell proliferation on Ti(A—D), Ti-PDA-GO(E—H) and Ti-PDA-GO-M(I—L) at 1(A, E, I), 3(B, F, J), 5(C, G, K), and 7 d(D, H, L)
2.4 M2型巨噬细胞膜涂层的免疫调控性能
巨噬细胞的极化对调节钛种植体周围的炎症至关重要. 选择RAW264.7细胞为研究对象,在炎症环境下分别分析了Ti,Ti-PDA-GO和Ti-PDA-GO-M材料对RAW264.7细胞极化的影响,探究了M2型巨噬细胞膜涂层是否具有优异的免疫调控性能. 首先,利用LPS刺激RAW264.7细胞构建炎症环境,再分别将Ti,Ti-PDA-GO 和Ti-PDA-GO-M 材料与细胞共孵育24 h,探究RAW264.7 细胞表型的变化. 利用RT-qPCR分析了典型的M2型巨噬细胞相关标记物白细胞介素10(IL-10)和白细胞介素受体-1受体拮抗剂(IL-1ra)以及M1型巨噬细胞相关标记物肿瘤坏死因子α(TNF-α)和诱导型一氧化氮合酶(iNOS)的表达情况[30].
由图9 可见,与Ti 和Ti-PDA-GO 材料相比,Ti-PDA-GO-M 材料中M2型巨噬细胞标记物IL-10 和IL-1ra的表达量均显著上升,而M1型巨噬细胞标记物TNF-α和iNOS的表达量则显著下降,表明在炎症环境下Ti-PDA-GO-M材料可有效促进RAW264.7细胞向M2型极化. 同时,与Ti片相比,Ti-PDA-GO材料中TNF-α和iNOS 的表达量明显升高,表明在炎症环境下氧化石墨烯层会在一定程度上促进RAW 264.7 细胞向M1型极化. 通过免疫荧光蛋白实验,进一步分析了Ti,Ti-PDA-GO 和Ti-PDA-GO-M 材料分别与RAW 264.7 细胞共孵育24 h 后抗炎因子与促炎因子的变化. 由图10 可见,与Ti 和Ti-PDA-GO材料相比,Ti-PDA-GO-M材料中M2型巨噬细胞标记物CD206的红色荧光最强,而代表M1型巨噬细胞标记物iNOS的绿色荧光最弱,表明M2型巨噬细胞膜涂层赋予了钛种植体优异的免疫调控能力.
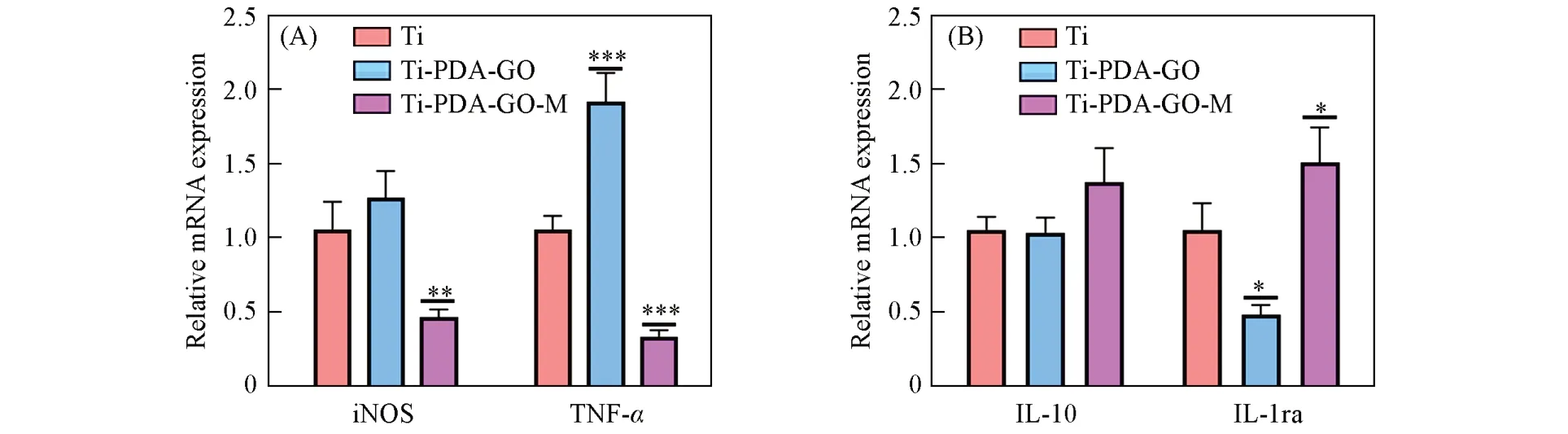
Fig.9 The relative mRNA expression levels of iNOS and TNF-α(A), IL-10 and IL-1ra(B)in Ti, Ti-PDA-GO and Ti-PDA-GO-M after 24 hError bars represent standard deviation(n=3); *P<0.05,**P<0.01,***P<0.001,****P<0.0001) vs. Ti group.
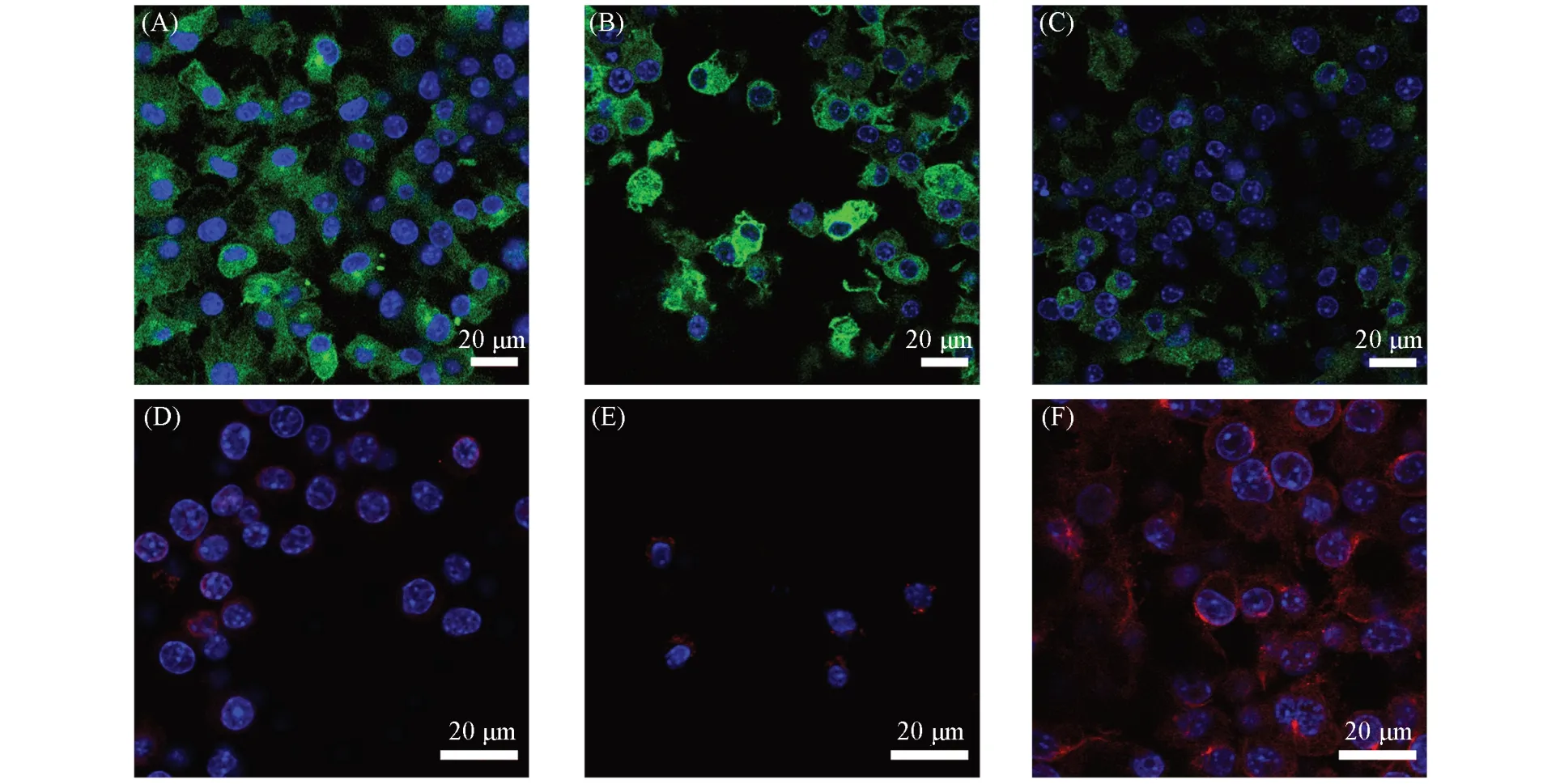
Fig.10 Fluorescence images of iNOS(A—C) and CD206(D—F) in Ti(A, D), Ti-PDA-GO(B, E) and Ti-PDA-GO-M(C, F) after 24 h
3 结 论
建立了一种以聚多巴胺和石墨烯层作为“桥梁”,在钛种植体表面构建天然细胞膜涂层的策略. 在聚多巴胺和石墨烯的共同作用下,保证了M2型巨噬细胞膜涂层的均匀性和稳定性. 由于M2型巨噬细胞膜独特的性质,采用M2型巨噬细胞膜涂层包覆钛种植体表面进行生物功能化改性. 此涂层赋予钛种植体优异的生物相容性、 抗生物污染以及免疫调控性能. 实验结果表明,M2型巨噬细胞膜涂层修饰的钛种植体可有效阻止蛋白非特异性的吸附. 同时,在炎症环境下能有效促进RAW264.7细胞极化至M2型并分泌抗炎因子,降低植入物感染炎症的风险. 这种简单且通用的细胞膜涂层制备策略可应用于不同的生物材料以在宏观水平上实现细胞膜的物化,在钛种植体表面改性工程中具有较大的应用前景.

