“Grafting from”法制备高载量大孔弱阳离子交换层析介质
郭 旺,姜泽平,马 磊,乔 娟,莫文清,靳海波,何广湘,黄永东,张荣月
(1. 北京石油化工学院新材料与化工学院,燃料清洁化及高效催化减排技术北京市重点实验室, 北京 102617;2. 中国科学院过程工程研究所生化工程国家重点实验室, 北京 100190)
随着生物制药规模的不断增大,对下游分离纯化技术的要求越来越高[1]. 层析分离作为一种主流的分离纯化技术,由于具有操作温和、 易放大等特点而被广泛应用于蛋白分离纯化中[2]. 其中,层析介质性能是影响分离纯化效率的关键,传统多糖基质的层析介质的孔径小(30~50 nm)、 质地软(耐压<0.3 MPa),在高通量分离纯化应用中受到一定的限制,而有机聚合物基质的层析介质的机械强度高(可耐压10 MPa以上)、 孔径大(>100 nm),因此能更好地满足高通量分离的需求[3]. 聚合物层析介质孔径大,有利于蛋白等大分子的快速传质,但随着孔径增加其比表面积降低,致使蛋白吸附容量降低[4],因此提高大孔聚合物层析介质的蛋白吸附容量具有重要意义.
接枝聚合物长链是提高层析介质容量的常用方法之一. 小分子配基偶联的层析介质在二维平面吸附蛋白,其吸附容量有限; 而聚合物长链在介质表面的构象丰富且易伸展,形成的接枝层能够在三维空间吸附蛋白质,极大地提高了蛋白结合容量[5]. 聚合物接枝方法主要有两种: 聚合物直接接枝(“grafting to”)和小分子单体接枝聚合(“grafting from”)[6]. “Grafting to”法是在基质上偶联具有一定分子量的聚合物[7]. 其中,在交联琼脂糖基质上分别接枝葡聚糖[8]或聚乙烯亚胺(PEI)[9],经过表面修饰得到阳离子层析介质和阴离子层析介质,其蛋白吸附容量相比于非接枝型介质可提升1倍以上.“Grafting from” 方法是单体在基质表面引发接枝聚合形成聚合物长链[10,11],其位阻较小易形成较为均匀的接枝层[12]. 其中,原子转移自由基聚合(ATRP)是grafting from 经典的接枝方法,该方法由于接枝的聚合物易控[13]而便于研究接枝链长度和接枝密度对蛋白结合容量的影响. 如,在纤维素基质[14]和琼脂糖基质[15]表面分别引发带负电荷的功能单体接枝聚合,制得的强阳离子交换层析介质的蛋白结合容量大幅度提升. 采用ATRP引发接枝,通常需要先用2-溴异丁酰溴在基质表面引入具有引发活性的基团[16],该反应需要严格的无水环境[17],而对于多孔微球尤其亲水性较好的基质,其除水过程复杂,且需要大量的无水有机溶剂,因此在大规模进行层析介质生产中受到一定限制. 氧化还原引发接枝聚合的操作条件相对较为温和[18],基质表面的羟基常用作还原剂与氧化剂组成引发体系. 如Wang等[19]用硝酸铈铵作为氧化剂,在纤维素基质(—OH 作为还原剂)上制备了弱阴离子交换介质,对牛血清白蛋白(BSA)的静态结合容量比未接枝介质提升2倍. Machado 等[20]在聚(丙烯酰胺)基质上通过氧化还原法制备了阳离子交换介质,对乳白蛋白的吸附容量达到210 mg/mL.
综上所述,当前研究多集中于以多糖微球为基质的离子交换介质,但多糖基质的孔径较小,其孔道表面接枝聚合物长链后孔道尺寸会进一步降低,从而影响其对生物大分子的孔内传质. 而以大孔聚合物微球为基质的孔道尺寸较大,表面接枝聚合物长链对孔道尺寸影响较小,能更好地提升该类介质的蛋白吸附容量. 基于此,本文以大孔聚丙烯酸酯类微球为基质,采用氧化还原引发体系在微球表面接枝甲基丙烯酸,研究了接枝聚合各因素对吸附容量的影响,建立了弱阳离子交换层析介质的制备方法,为该类层析介质的设计和应用提供了理论参考.
1 实验部分
1.1 试剂与仪器
大孔聚合物微球FastSep-epoxy(表面富含环氧基),北京博尔赛谱生物科技有限公司; 甲基丙烯酸(MAA),分析纯,上海迈瑞尔化学技术有限公司; 考马斯蓝G-250、 过硫酸钾(KPS)和三-(羟甲基) 氨基甲烷,分析纯,北京伊诺凯科技有限公司; 溶菌酶(Lys),分析纯,上海麦克林生化科技有限公司;CM Sepharose FF(琼脂糖基质弱阳离子交换层析介质)购自于Cytiva公司; 十二烷基硫酸钠,分析纯,北京迈瑞达科技有限公司;N,N,N',N'-四甲基乙二胺,分析纯,北京百灵威科技有限公司.
SHA-BA型水浴恒温振荡器(IS),金坛市荣华仪器制造有限公司; E1677型垂直混合仪(VM),宁波新芝生物科技股份有限公司; L5 型紫外-可见分光光度计(UV-Vis),上海仪电分析仪器有限公司;UPC10 AKTA 型自动纯化系统(AKTA),美国GE 公司; 扫描电子显微镜(SEM),韩国COXEM 公司;TG16型台式高速离心机(TMHSC),上海卢湘仪离心机仪器有限公司; Spectrum 100型傅里叶红外光谱仪(FTIR),美国Perkin Elmer公司; Autopore IV 9500型压汞仪(MIP),美国Micromeritics公司.
1.2 实验过程
1.2.1 弱阳离子交换层析介质的制备 大孔弱阳离子交换层析介质的制备过程如图1所示. (1) Fast-Sep-epoxy 微球水解: 将 20 g 干燥恒重的大孔FastSep-epoxy 微球与200 mL 0.5 mol/L H2SO4加入500 mL锥形瓶中,反应10 h后,用去离子水洗涤至中性,标记为 FastSep-OH. (2) 接枝聚合甲基丙烯酸(MAA)单体: 取10 mL水解后的微球与一定量的甲基丙烯酸(MAA)混合并通入氮气,加入一定量的过硫酸钾(KPS),于35 ℃进行接枝聚合反应. 反应完毕将制得的微球用去离子水洗涤至中性,标记为 FastSep-PMAA.

Fig.1 Preparation of weak cation exchange chromatography medium
1.2.2 静态结合容量测定 以Lys为模型蛋白,采用间歇式结合方法测定静态结合容量(Static binding capacity,QSBC)[21]. 量取一定体积的FastSep-PMAA 微球,加入已知浓度蛋白溶液于离心管中(以170 r/min转速吸附12 h),然后测定上层清液的吸光值(检测波长280 nm),最后根据吸光值以及相应的标准曲线计算QSBC. 每组实验重复3次取平均值.
式中:c0(mg/mL)为Lys溶液初始浓度;c1(mg/mL)为Lys溶液剩余浓度;V1(mL)为Lys溶液体积;V2(mL)为层析介质的体积.
1.2.3 离子交换容量测定 参照文献[22]方法测定离子交换容量(Ion exchange capacity,QIC). 取已知体积的介质用1.0 mol/L HCl 溶液进行转型(30 min),然后将介质洗涤至中性,用标准NaOH 溶液中和介质,最后用标准HCl溶液滴定收集液,记录体积. 采用下计算QIC. 每组实验重复3次取平均值.
式中:cNaOH(mol/L)为NaOH 标准溶液浓度;cHCl(mol/L)为HCl 标准溶液浓度;VNaOH(mL)为NaOH 标准溶液体积;VHCl(mL)为HCl标准溶液体积;V球(mL)为微球体积.
1.2.4 动态结合容量测定 测定了不同介质的Lys动态结合容量(Dynamic binding capacity,QDBC)[3],先用20 mmol/L PB缓冲溶液(pH=7.0)平衡层析柱(5.0 mm×30.0 mm)至基线平稳,设定流速为150 cm/h;然后开始进样(3.0 mg/mL Lys溶液)并记录横坐标V1,待流穿10%时记录横坐标V2; 最后,用0.5 mol/L NaCl的PB缓冲溶液进行洗脱. 每组实验重复3次取平均值.
式中:c(mg/mL)为蛋白液浓度;V1(mL)为蛋白进样体积;V2(mL)为10%流穿体积;V球(mL)为微球体积.
1.2.5 不同盐浓度、 pH 值下的QSBC测定 配制含有不同浓度NaCl(0.1~0.5 mol/L)以及不同pH 值(6.0~10.0)的PB缓冲溶液. 量取1.0 mL微球与已知浓度的Lys溶液混合. 按 1.2.2节方法测定不同盐浓度、 pH值下的QSBC. 每组实验重复3次取平均值.
1.2.6 溶菌酶回收率测定 测定了不同介质的Lys 回收率. 安装层析柱(5.0 mm×30.0 mm)并通过1.0 mL定量环上样3.0 mg/mL 的Lys 溶液(流速为150 cm/h),吸附5 min后,用0.5 mol/L NaCl 的PB洗脱液进行梯度洗脱. 积分计算洗脱峰面积A1与不经过层析柱空载峰面积A0. 每组实验重复3次取平均值. 计算回收率R的公式如下:
式中:A0(mAU·min)为空载峰面积;A1(mAU·min)为洗脱峰面积.
1.2.7 纯化鸡卵清中的溶菌酶 取新鲜鸡蛋内膜置于PB 缓冲溶液(pH=8.0)中浸泡24 h,取滤液备用[23]. 用缓冲溶液平衡层析柱(5.0 mm×30.0 mm)至基线平稳,设定流速为150 cm/h. 用A 泵进样20 mL鸡蛋清溶液,收集流穿液. 切换至B泵(缓冲溶液)待基线平稳后换为0.5 mol/L NaCl 的PB 溶液进行洗脱,收集洗脱液.
2 结果与讨论
2.1 弱阳离子交换层析介质制备条件的优化
接枝聚合物的密度及链长是影响层析介质载量的重要因素,通常通过控制单体(MAA)的浓度、 引发剂(KPS)的浓度和反应温度来实现对该参数的调控[24,14]. 本研究以QSBC为衡量参数,采用单一变量法对影响QSBC的各因素进行了系统考察.
2.1.1 单体浓度对QSBC的影响QSBC随单体浓度的增加呈现先增加后下降的趋势,其具体变化规律如图2所示. 当单体浓度为 0.5 mol/L时,QSBC达到最大值(174.77 mg/mL). 这是因为随单体浓度增加,其反应速率加快,接枝量增加,所以QSBC值增加; 随着单体浓度继续增加,其单体自身均聚反应速率增加,严重阻碍了接枝反应的进行[25],致使介质表面接枝量减小. 类似规律在巯基-过硫酸钾氧化还原引发体系中也被观察到,Liu等[26]将甲基丙烯酸缩水甘油酯(GMA)接枝到羽毛表面,其接枝量随单体浓度呈先上升后下降趋势. 为获得较高的蛋白结合容量,选择单体浓度为0.5 mol/L.
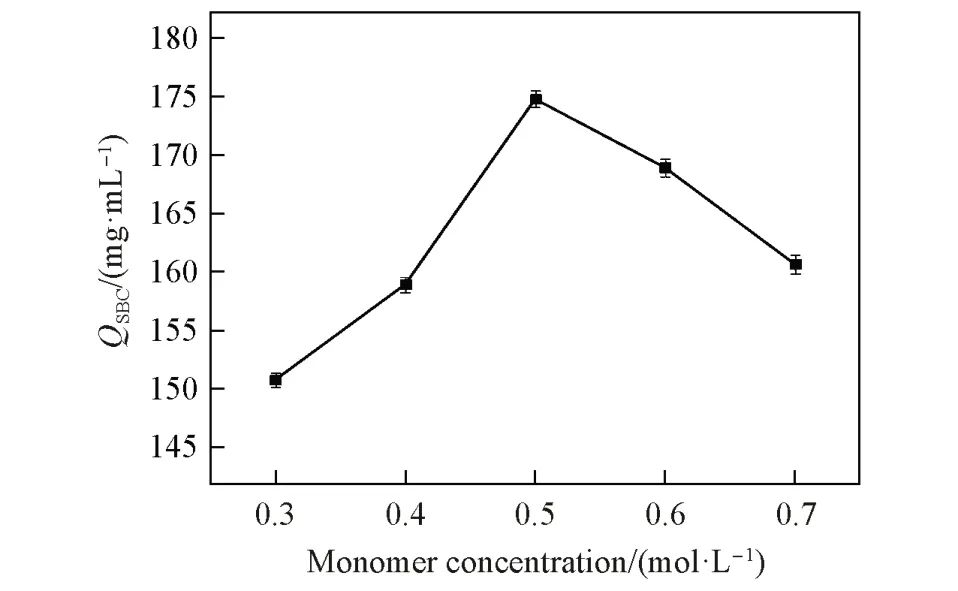
Fig.2 Effect of monomer concentration on QSBC(cKPS=36.8 mmol/L , T=35 ℃)
2.1.2 KPS 浓度对QSBC的影响 引发剂浓度影响自由基聚合反应速率[27],实验中考察了氧化剂KPS浓度对介质QSBC的影响. 如图3 所示,QSBC随KPS 浓度的增加出现先上升后下降的趋势,KPS 浓度为18.5 mmol/L时介质的QSBC最高为252.21 mg/mL. 究其原因是随着KPS的浓度升高,溶液中的自由基浓度也增加,反应速率加快,导致接枝量升高,QSBC值增加; 继续升高KPS浓度,反应体系中自由基浓度继续增加,会使单体本身均聚反应比例增加,导致其接枝效率下降,因而介质的QSBC值下降,这一现象符合普通自由基接枝聚合的一般规律[28,29].
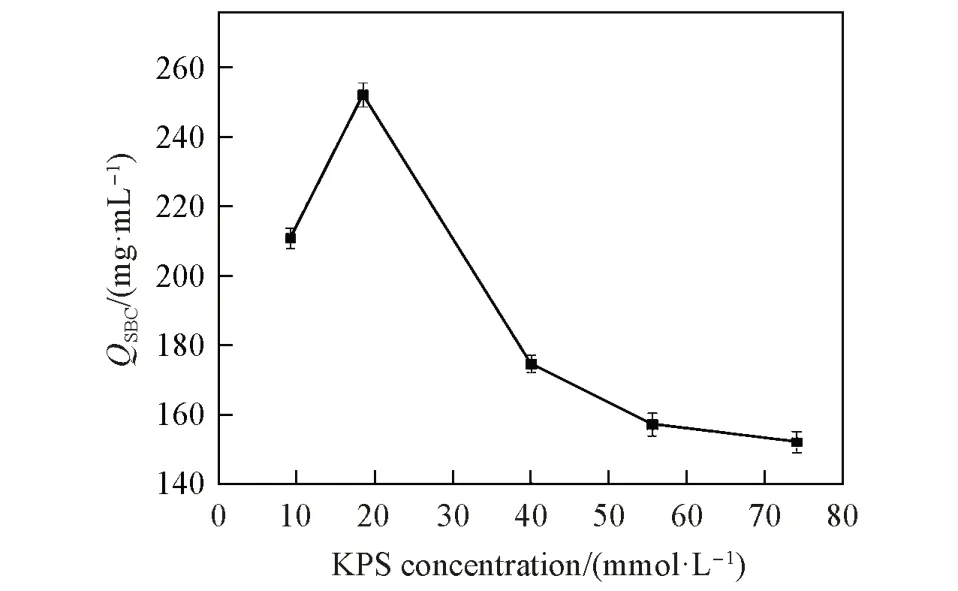
Fig.3 Effect of KPS concentration on QSBC(cMAA=0.5 mol/L, T=35 ℃)
2.1.3 反应温度对QSBC的影响 图4为QSBC随反应温度增加的变化趋势图,可见QSBC随温度增加出现先增大后减少的趋势. Mondal等[30]在研究棉纤维接枝聚合甲基丙烯酸(MAA)时也报道了这种趋势. 在较低温度(T<35 ℃)时,随着反应温度的升高,其自由基浓度增加导致其接枝量增加,所以QSBC升高[31];而当温度继续升高到一定程度(>35 ℃)时,单体自身均聚的速率则会高于接枝聚合速率,导致接枝到基质上的聚合物数量减少,配基密度下降,进而致使SBC下降. 为获得较高的蛋白吸附容量,选择反应温度为35 ℃.

Fig.4 Effect of reaction temperature on QSBCcMAA=0.5 mol/L, cKPS=18.5 mmol/L.
2.2 接枝前后微球的红外光谱
通过红外光谱表征了FastSep-epoxy 微球接枝前后的化学组成,结果如图5 所示. FastSep-epoxy 微球在2966.3 cm-1处的吸收峰为C—H伸缩振动峰,1733.3和1201.7 cm-1处的吸收峰分别为C=O以及C—O特征吸收峰; FastSep-epoxy的环氧基经过水解后生成邻羟基,从而制得FastSep-OH. 红外谱图中FastSep-OH 与FastSep-epoxy 相比,除了继续保留FastSep-epoxy 的1733.3 cm-1(C=O)和1201.7 cm-1(C—O)特征吸收峰外,在3544.5 cm-1处出现新的羟基特征峰,证明已发生了开环反应; FastSep-PMAA与FastSep-OH 比较发现,在3544.5,1733.3 和1201.7 cm-1处的特征吸收峰均有所增强,主要来源于FastSep-PMAA 微球接枝PMAA 的大量—COOH,证明接枝聚合反应发生. 另外,由于羧基基团的缔合作用[32],使得羟基峰向低波数方向位移,导致3544.5~3200 cm-1处出现宽而散的特征峰,均为—COOH的典型特征吸收峰.
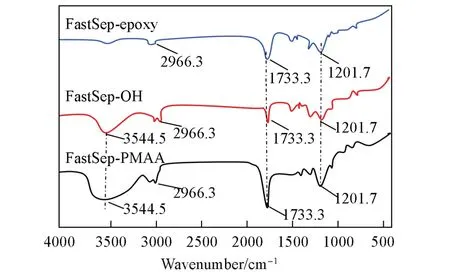
Fig.5 FTIR spectra of microspheres before and after methacrylic acid grafting
2.3 接枝前后介质的表面形貌及孔径表征
通过SEM 观察了大孔聚合物微球接枝前后表面形貌的变化,结果如图6 所示. 图6(A)~(C)为FastSep-OH微球的表面形貌照片,可见微球表面孔间连通性较好,孔径尺寸为700~1000 nm. 图6(D)~(F)示出了接枝后FastSep-PMAA微球的表面形貌,接枝后微球中的聚合物骨架尺寸增加,骨架间空隙增大,一方面表明已接枝聚甲基丙烯酸(PMAA),另一方面显示出接枝的PMAA 对原微球的骨架有融合或增强作用. 接枝后的介质仍具有大孔结构,采用压汞法对其平均孔径尺寸变化情况进行了表征,结果如图7 所示. 接枝后的FastSep-PMAA 与接枝前FastSep-OH 相比,其<700 nm 的孔容部分明显下降,孔隙率由88.5%下降至83.0%,同时其平均孔径尺寸从(731.2±10) nm 增加到(978.14±10) nm,表明接枝PMAA 对孔径尺寸较小的部分孔道影响较明显,而对于>700 nm 的孔道影响较小,该数据与SEM 表征结果一致. 介质中保留的大孔有利于大分子快速传质,进而提高纯化效率[33].

Fig.6 Microsphere morphologies before(A—C) and after(D—F) grafting methacrylic acid

Fig.7 Distribution of pore size of medium before(a)and after(b) grafting
2.4 弱阳离子交换层析介质的色谱性能评价
离子交换容量(QIC)、 蛋白结合容量及分离效能等均为离子交换层析介质的重要表征参数,实验中进行了详细评价,考察了不同QIC的层析介质的色谱行为. 为便于分析,统一将评价介质命名为Fast-Sep-PMAA-n,其中n代表QIC.
2.4.1QIC对QSBC的影响QIC是离子交换层析介质的重要参数,其取决于介质表面的离子交换基团数量,本文中即介质上的羧基数量,通常该类介质的蛋白结合容量与其数量有直接关系. 对具有不同QIC的介质进行了评价,结果如图8所示. 在0.429~0.461 mmol/mL的QIC范围内,介质QSBC随着QIC的增加而升高,主要原因是介质表面与蛋白质的结合位点随着羧基的数量增加而增多,从而可以结合更多的蛋白. Sun 等[34]在琼脂糖基质的微球上接枝PMAA 时,在QIC为0.130~0.680 mmol/mL 范围内,蛋白吸附能力同样随QIC值增加而增大. FastSep-PMAA-0.461 的平均孔径为(978.14±10) nm,QSBC为252.21 mg/mL,而聚合物基质的商品Fractogel®EMD COO-(M)[35]的平均孔径为(80±10) nm,QSBC为100 mg/mL,自制介质平均孔径远大于Fractogel®EMD COO-(M),但其QSBC仍大于同类商品介质2.5 倍之多.
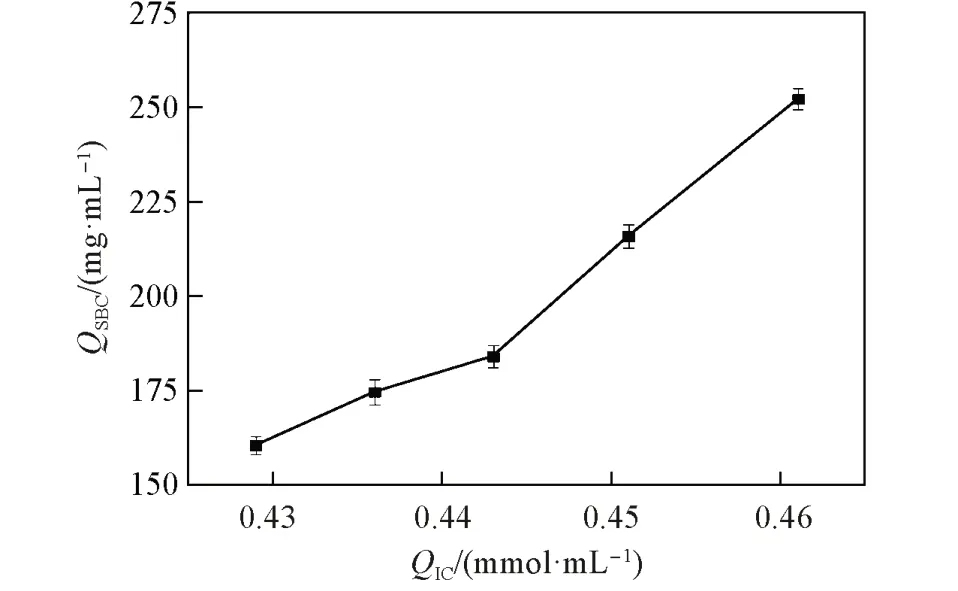
Fig.8 Effects of QIC on QSBC
2.4.2QIC对QDBC的影响QDBC是衡量离子交换层析介质蛋白吸附能力的重要参数[4,9],该参数与QIC之间的关系如图9 所示. 在0.429~0.461 mmol/mL 的IC 范围内,QDBC随着QIC的增加而增大. 通常QIC越高,介质上可供结合的吸附位点越多,则DBC 也随之增加[20]. 这一规律与Zhao 等[36]制备的弱阳层析介质表现相似(相同IC 范围),且在QIC近似的条件下,FastSep-PMAA-0.461 对溶菌酶的QDBC(157.25 mg/mL)略高于该文献报道值(140 mg/mL). 还发现存在临界离子交换容量(cIC)现象(当QIC超过0.443 mmol/mL,其QDBC有很大程度的提升),其原因是当QIC值小于QcIC时,聚合物长链之间的距离较远“链传递”现象难以发生,链的灵活性受到限制,所以QDBC较低; 当QIC超过QcIC值时,链间的距离缩短,有效促进“链传递”行为的发生,使得溶菌酶在层析介质的传质速率极大提升,所以QDBC高[37,38].
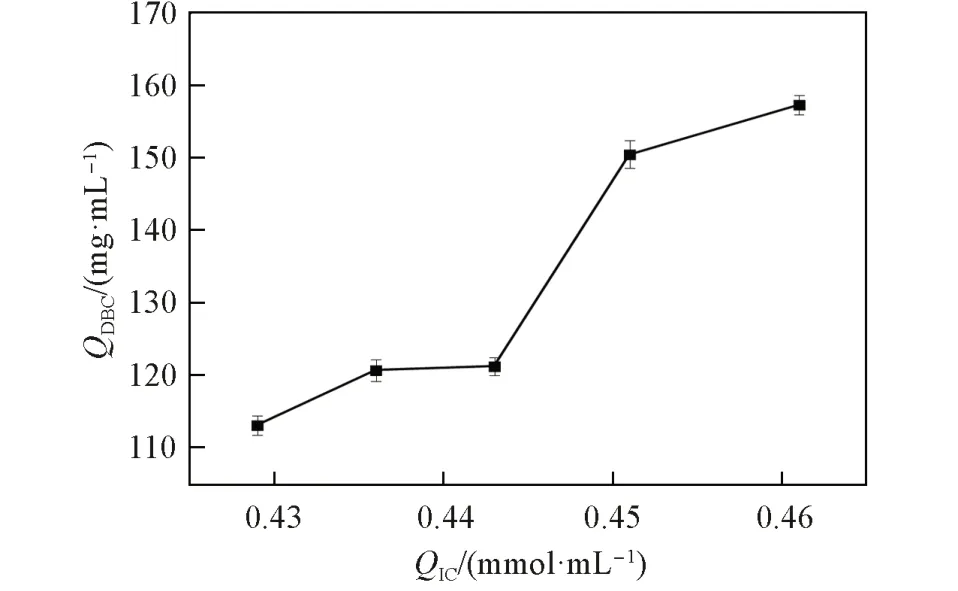
Fig.9 Effects of QIC on QDBC
另外,在相同流速下(150 cm/h)测试了FastSep-PMAA-0.461和商品 CM Sepharose FF[39](该介质在交联琼脂糖基质上偶联羧酸基团制备获得)的QDBC,结果如图10 所示,FastSep-PMAA-0.461 的QDBC值为157.25 mg/mL,与商品CM Sepharose FF(94.74 mg/mL)相比,QDBC高出65.9%.
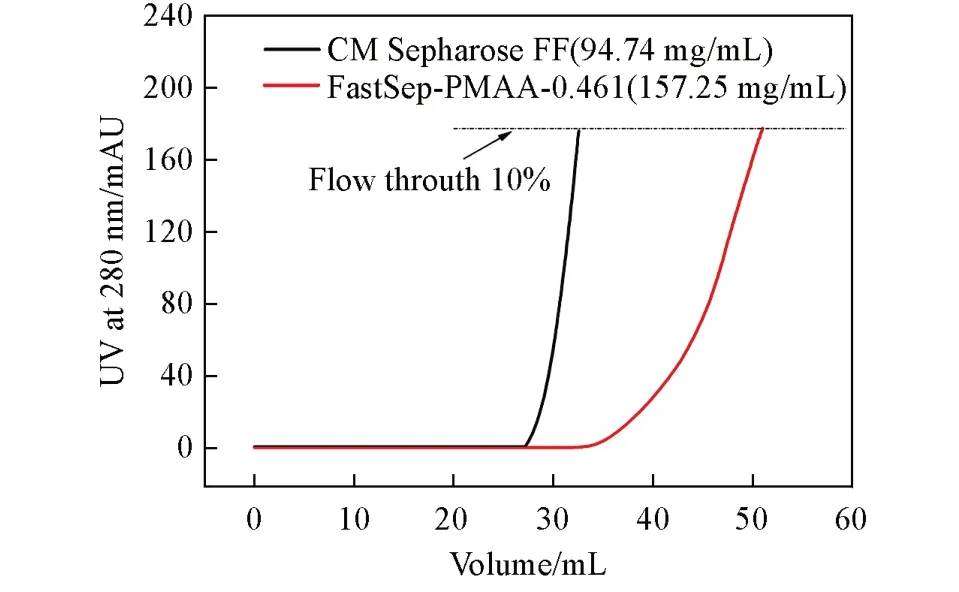
Fig.10 Comparison of QDBC between CM Sepharose FF and FastSep-PMAA-0.461
2.4.3 盐浓度对QSBC的影响 耐盐型离子交换层析在高盐浓度下保持较高的蛋白结合容量,可以免去对蛋白原料液稀释的操作,不仅可以节约蛋白纯化成本,还可最大化地保持蛋白的活性[40].
改变平衡液的盐浓度,测定了具有不同QIC的介质的QSBC,结果如图11所示. 随着盐浓度的增加,介质FastSep-PMAA-0.429和FastSep-PMAA-0.443的QSBC呈现先增加后降低的趋势,在PMAA接枝型介质对Lys的吸附中也有类似的现象[34]. 其增加的可能原因是随着离子强度的增加,Lys进入层析介质的可利用孔体积也增加,蛋白质的空间位阻随之明显减弱[4],所以在中低离子强度下SBC 有所提升; 在高盐浓度下,其QSBC下降,可归因于高离子强度的电荷屏蔽作用,从而降低了蛋白质与固定相上反应位点的静电相互作用[41],导致静态结合量降低. 介质FastSep-PMAA-0.436,FastSep-PMAA-0.451 和FastSep-PMAA-0.461的QSBC随着盐浓度的升高而下降,其原因是离子强度增加其电荷屏蔽作用为主要影响因素,故未显示出先增加后降低的规律. 总体来说,在QIC为0.429~0.461 mmol/mL 时,介质在0.2 mol/L的NaCl缓冲溶液中能保持100 mg/mL的蛋白结合容量,具有一定的耐盐性能.

Fig.11 Effects of salt concentrations on QSBC
2.4.4 蛋白回收率的测定 回收率是评价层析介质的一个重要参数,尤其对于聚合物基质的层析介质而言,其骨架本身有一定的疏水性,如聚苯乙烯微球通常需要亲水修饰后才可用于层析介质[42]. 而本文以聚丙烯酸酯类微球为基质,其基质本身具有较好的亲水性,经过表面接枝水溶性的PMAA后,其对蛋白的非特异性吸附量达到了多糖基质水平. 不同QIC介质对蛋白回收率的测定结果如表1所示. 该类介质对Lys 回收率均在96%以上,稍高于商品琼脂糖基质层析介质(CM Sepharose FF)的回收率(95.1±3.2)%[43].

Table 1 Recoveries of Lys by different media
2.4.5 缓冲溶液pH值对QSBC的影响 pH值的变化不仅影响蛋白分子表面电荷数量,而且影响弱阳层析介质中功能基团(—COOH)的解离程度. 以FastSep-PMAA-0.436介质为研究对象,测定了其在不同pH缓冲溶液中的QSBC. 结果表明,QSBC随pH升高先增加后保持不变(图12). 究其原因是: 在水溶液中,随pH值增加—COOH的解离程度提高[21],当pH值=8时,—COOH的解离程度达到99%,解离程度越高则蛋白吸附能力增加,所以其QSBC随pH值升高而增加,随着pH值继续升高,此时羧酸分子全部解离,蛋白吸附位点数量并未继续增加,同时缓冲溶液pH值越接近溶菌酶的等电点(pI=10.7),其表面净电荷量相应减少,二者均影响SBC,故QSBC随pH增加不再继续增加.
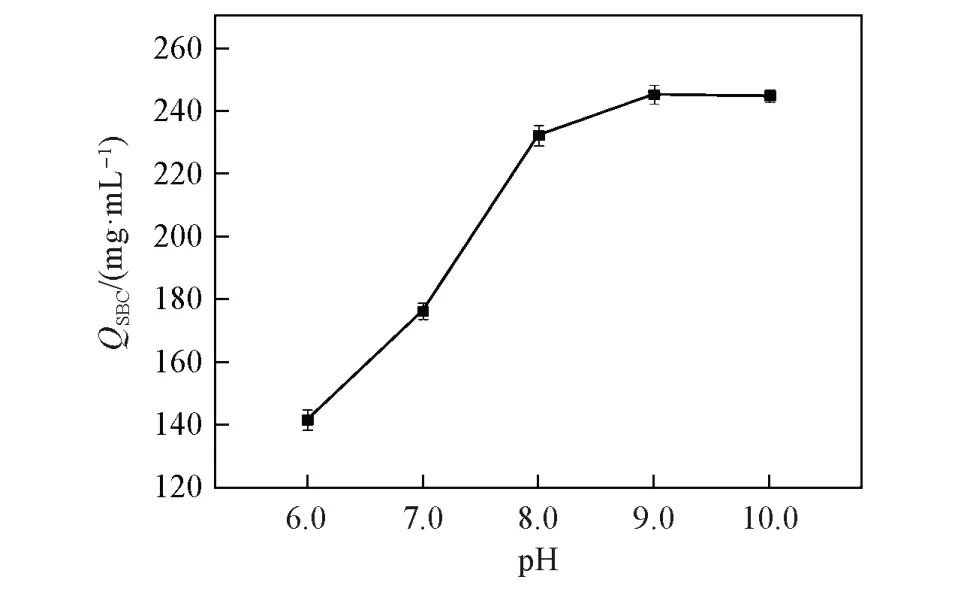
Fig.12 Effect of pH on QSBC
2.4.6 分离性能评价 溶菌酶作为一种抗菌蛋白在食品贮藏等方面发挥着重要作用,它在鸡卵清中含量丰富(占蛋清总量的3.5%)[44]. 在鸡卵清中除溶菌酶(pI=10.7)为碱性蛋白外,其它蛋白多为酸性蛋白,如卵蛋白(pI=4.0)、 鸡蛋白蛋白(pI=4.6)和卵转铁蛋白(pI=6.6),可通过阳离子交换层析介质容易将其与溶菌酶分离[45].实验中以FastSep-PMAA-0.461 作为研究对象,分离纯化了鸡蛋清溶液中的溶菌酶,其分离谱图如图13 所示. 对图13 中的流穿峰和洗脱峰分别进行收集,采用12%的SDSPAGE 凝胶电泳[46]对其成分进行分析,结果如图14所示,可见流穿峰中不含有溶菌酶,洗脱峰中除溶菌酶外不含有其它杂蛋白,表明利用制备的弱阳离子层析介质完成了对鸡蛋清溶液中溶菌酶的分离,具有较好的分离纯化能力.
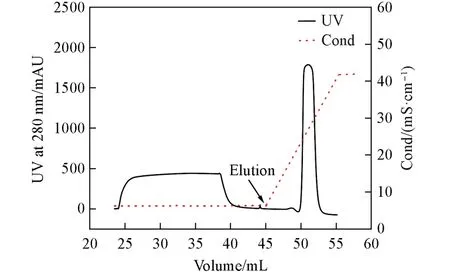
Fig.13 Chromatographic diagram of egg white by FastSep-PMAA-0.461

Fig.14 SDS-PAGE analysis of lysozyme isolated from egg white using FastSep-PMAA-0.461Lane 1. molecular weight marker; lane 2. bovine serum albumin(BSA);lane 3. lysozyme(Lys); lane 4. egg white solution; lane 5. flow- through;lane 6. elution; lane 7. molecular weight marker.
3 结 论
以大孔聚丙烯酸酯类微球为基质,通过氧化还原引发表面接枝聚合,制备了大孔弱阳离子交换层析介质. 系统研究了接枝聚合的各影响因素,包括单体浓度、 引发剂浓度及反应温度等因素,发现该类介质的蛋白结合容量与IC密切相关.QSBC和QDBC均随QIC的增加而增加.QIC达到0.461 mmol/mL 时,QSBC为252.21 mg/mL,QDBC为157.25 mg/mL.QIC对介质的耐盐性有一定影响,在QIC为0.429~0.461 mmol/mL 时,介质在0.2 mol/L 的NaCl 缓冲溶液中能保持100 mg/mL 的蛋白结合容量. 另外,QSBC值随蛋白缓冲液的pH值增加先增加后保持不变以及不同QIC的弱阳层析介质蛋白回收率均大于96%. 将制备的介质用于鸡蛋清中溶菌酶的分离纯化,一步纯化即可获得较高纯度,该类介质在蛋白等生物大分子分离纯化领域具有较好的应用前景.

