新型2,4-二羟基蝶啶类衍生物的合成及其抗肿瘤活性
何 欢,唐 潇,王 勉,王坚毅,3*
(1.广西大学 化学化工学院,广西 南宁 530004; 2.广西大学 生命与科学技术学院,广西 南宁 530004; 3.广西大学 医学院,广西 南宁 530004)
蝶啶是十分具备治疗潜力的杂环化合物,尤其是在癌症治疗上[1-5]。1950年首次发现了甲氨蝶呤(MTX),这也是最常用的蝶啶衍生物[6]。甲氨蝶呤是一种抑制二氢叶酸还原酶(DHFR)的抗叶酸[7],DHFR催化NADPH依赖性二氢叶酸还原为四氢叶酸,这是合成嘌呤和胸苷的基本反应。因此,MTX阻止DNA的合成,进而引起细胞死亡。在过去的半个世纪中,MTX一直被用作抗癌剂,无论是单独使用还是与其他化疗药物联合都可以用来治疗乳腺癌、皮肤T细胞淋巴瘤、淋巴细胞白血病、肺癌和非霍奇金淋巴瘤的晚期等疾病。蝶啶化学对药物化学的转化似乎低于其他杂环支架。此外,自由基取代、侧链变异、亲核取代和有机金属连接应用于蝶啶环,可用于寻找面向多样性的合成。目标化合物的设计如图1,本文用2,4-二羟基蝶啶替换Ibrutinib的母核,合成出未报道过的化合物,并对其进行了1H NMR、13C NMR和MS(ESI)的表征。初步对A549癌细胞进行抗增殖活性研究。目标化合物及其合成路线如图2所示。

图1 目标化合物的设计
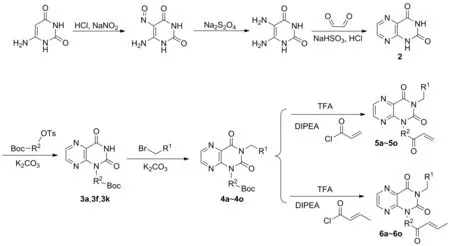
图2 目标化合物的合成路线
1 实验部分
1.1 仪器与试剂
Bruker型核磁共振仪(DMSO-d6和CDCl3为溶剂,TMS为内标);ESI-TOF型高分辨质谱仪。
4-(甲苯磺酰氧基)哌啶-1-羧酸叔丁酯[8-9],4-(氯甲基)苯甲酸苯酯和4-(氯甲基)苯甲酸对甲苯酯[10-11]为自制化合物,其余试剂均为分析纯。
1.2 目标化合物的合成
(1) 化合物2的合成[12-15]
称取4-氨基-2,6-二羟基嘧啶10 g(78.680 mmol,1 eq.)和亚硝酸钠8.14 g(118.010 mmol,1.5 eq.)于250 mL的茄形瓶中,加入60 mL水溶解,在0 ℃下加入1.50 mL浓盐酸。反应6 h,反应体系生成大量紫红色固体,过滤,水洗,将得到的紫红色固体放入到250 mL茄形瓶中,加入60 mL水搅拌悬浮液,再加入连二亚硫酸钠32.23 g(157.35 mmol,2 eq.),升温至80 ℃,反应3 h,体系中紫红色变为黄色固体,过滤,水洗。收集固体加入到250 mL的茄形瓶中进行下一步反应,加入亚硫酸氢钠12.28 g(118.010 mmol,1.5 eq.)、40%乙二醛10 mL和60 mL水,搅拌5 min后,升温至90 ℃反应3 h。反应完毕,过滤除去未反应的固体,收集滤液并用氨水调节pH至9~10,析出大量黄色固体,用冰水冷却,过滤,乙醇清洗,烘干得到化合物2为淡黄色固体8.16 g,收率63.19%,1H NMR(DMSO-d6)δ:8.47(d,J=2.2 Hz,1H,CH),8.20(d,J=2.2 Hz,1H,CH)。
(2) 化合物3a、3f和3k的合成(以3a为例)
分别称取4-(甲苯磺酰氧基)哌啶-1-羧酸叔丁酯(1 g,2.810 mmol,1.0eq.)、化合物2(692.61 mg,4.220mmol,1.5 eq.)和碳酸钾(583.23 mg,4.220mmol,1.5 eq.)于100 mL茄形瓶中,加入25 mL二甲基亚砜溶解,于120 ℃下反应过夜,薄层色谱法监测表明原料已不再减少。反应结束后,加水淬灭反应并用乙酸乙酯(3×20 mL)萃取,合并有机相,加入无水硫酸钠,振荡除去水分,减压浓缩,加入适量硅胶粉拌匀制样,将粗产品用柱层析分离提纯(PE∶EA=1∶3,V∶V),得到化合物3a为白色粉末213.00 mg,收率21.80%,1H NMR(600 MHz,DMSO-d6)δ:11.90(s,1H),8.73(d,J=2.3 Hz,1H),8.58(t,J=1.6 Hz,1H),5.27(s,1H),4.06(d,J=16.7 Hz,2H),2.82(d,J=48.0 Hz,2H),1.71~1.58(m,4H),1.43(s,9H)。
(3) 化合物4a~4o的合成(以4b为例)
分别称取化合物3b(150.00 mg,0.431 mmol,1.0 eq.)和碳酸钾(90.00 mg,0.647 mmol,1.5 eq.)于100 mL茄形瓶中,加入10 mL二甲基亚砜溶解,在室温下搅拌30 min,与此同时称取1-(溴甲基)-4-(三氟甲基)苯(123 mg,0.518 mmol,1.2 eq.)加入到反应体系中,过夜,通过TCL监控反应原料已不再减少,加入水淬灭反应并用乙酸乙酯(3×20 mL)萃取,合并有机相,加入无水硫酸钠,振荡除去水分,减压浓缩,加入适量硅胶粉拌匀制样,将粗产品用柱层析分离提纯(PE∶EA=1∶2,V∶V),得到化合物4b黄色油状液体180.02 mg,收率81.80%,1H NMR(600 MHz,Chloroform-d)δ:8.65~8.58(m,2H),8.06~7.94(m,2H),7.59(d,J=7.9 Hz,2H),5.37(d,J=8.2 Hz,1H),5.33(s,2H),4.36(q,J=7.1 Hz,3H),2.92~2.71(m,4H),1.90~1.57(m,4H),1.48(s,9H),1.37(t,J=7.1 Hz,3H)。
(4) 化合物5a~5o和6a~6o的合成
将化合物4b(180 mg,0.380 mmol,1.0 eq.)溶于二氯甲烷(5 mL),加入三氟乙酸(2.5 mL)。在室温下搅拌1 h,反应完全后,浓缩得到浅黄色油状化合物4-((2,4-二氧代-1-(哌啶-4-基)-1,4-二氢蝶呤-3(2H)-基)甲基)苯甲酸乙酯。随后将其溶于无水二氯甲烷(5 mL),加入二异丙基乙胺(137 mg,1.060 mmol)。5 min后,在冰浴下加入巴豆酰氯(37.6 mg,0.36 mmol),移至室温继续反应1 h,反应完全后,加水淬灭,乙酸乙酯洗涤(3×50 mL)。有机相合并后用饱和盐水洗涤,无水硫酸钠干燥,过滤,浓缩得粗品。粗品使用柱层色谱法纯化(EA)后得到化合物6b为白色固体163.01 mg,收率91.30%,1H NMR(600 MHz,Chloroform-d)δ:8.64~8.46(m,2H),7.59(dd,J=12.4 Hz,7.9 Hz,2H),7.50(d,J=8.2 Hz,2H),6.49(ddd,J=63.2 Hz,16.8 Hz,10.6 Hz,1H),6.28~6.17(m,1H),5.70~5.54(m,1H),5.26(s,2H),4.72~4.56(m,1H),4.18~3.65(m,2H),3.13~2.51(m,2H),1.91~1.53(m,4H);13C NMR(126 MHz,Chloroform-d)δ:165.56,159.69,150.15,147.76,147.16,140.80,139.91,132.05~121.20(m),52.99,47.57,45.09,43.57,26.82,25.02; HR-MS(ESI-TOF)m/z:Calcd for C23H22F3N5O3{[M+H]+}474.4211,found 474.1749。
4-((1-(1-丙烯酰基哌啶-3-基)-2,4-二氧-1,4-二氢蝶呤-3(2H)-基)甲基)苯甲酸苯酯(5h):淡黄色固体164.00 mg,收率83.70%,1H NMR(600 MHz,Chloroform-d)δ:8.67~8.47(m,2H),8.07(d,J=8.0 Hz,2H),7.64~7.49(m,2H),7.33(t,J=7.8 Hz,2H),7.18(t,J=7.4 Hz,1H),7.11(d,J=7.9 Hz,2H),6.48(ddd,J=59.6 Hz,16.8 Hz,10.6 Hz,1H),6.21(dd,J=21.4 Hz,16.5 Hz,1H),5.60(dd,J=43.6 Hz,10.6 Hz,1H),5.28(d,J=10.3 Hz,2H),4.75~4.50(m,1H),4.16~3.62(m,2H),3.18~2.51(m,2H),1.90~1.50(m,4H);13C NMR(126 MHz,Chloroform-d)δ:165.69,164.82,159.73,150.89,147.80,147.18,140.81,130.48,129.48,128.17,127.95,127.49,125.89,121.68,53.01,47.57,45.32,43.57,26.82; HR-MS(ESI-TOF)m/z:Calcd for C28H25N5O5{[M+H]+}512.4996,found 512.1936。
4-((1-(1-丙烯酰基哌啶-3-基)-2,4-二氧-1,4-二氢蝶呤-3(2H)-基)甲基)苯甲酸对甲苯酯(5i):白色固体159.00 mg,收率84.90%,1H NMR(600 MHz,Chloroform-d)δ:8.66~8.54(m,2H),8.13(dd,J=31.5 Hz,8.1 Hz,2H),7.65(dd,J=45.8 Hz,8.1 Hz,2H),7.20(d,J=8.0 Hz,2H),7.12~7.02(m,2H),6.18~6.03(m,1H),5.97(dd,J=16.7 Hz,2.0 Hz,1H),5.48~5.41(m,1H),5.40~5.25(m,2H),4.92(dq,J=9.0 Hz,5.0 Hz,4.4 Hz,1H),4.62~4.23(m,2H),3.70~3.42(m,2H),2.36(s,3H),2.29~2.06(m,2H),1.97~1.81(m,2H);13C NMR(126 MHz,Chloroform-d)δ:166.39,164.70,160.28,150.82,148.71,147.81,145.78,140.33,140.22,130.20,129.70,128.50,128.13,127.81,123.08,122.28,53.08,46.54,45.44,44.20,27.83,23.80,21.46; HR-MS(ESI-TOF)m/z:Calcd for C29H27N5O5{[M+H]+}526.5243,found 526.2019。
1-(1-丙烯酰基哌啶-3-基)-3-(4-苯氧基苄基)蝶呤-2,4(1H,3H)-二酮(5j):淡黄色固体145.00 mg,84.20%,1H NMR(600 MHz,Chloroform-d)δ:8.64~8.56(m,2H),7.53(dd,J=13.5 Hz,8.3 Hz,2H),7.30(td,J=7.8,3.8 Hz,2H),7.11~7.07(m,1H),6.97(d,J=8.1 Hz,2H),6.92(t,J=8.7 Hz,2H),6.18(t,J=13.7 Hz,1H),6.14~6.08(m,1H),6.05(t,J=13.5 Hz,1H),5.46(d,J=9.2 Hz,1H),5.24(d,J=7.3 Hz,2H),4.13~3.98(m,2H),3.94~3.52(m,2H),2.24(ddtd,J=85.0 Hz,11.6 Hz,8.2 Hz,3.5 Hz,1H),1.91~1.82(m,3H);13C NMR(126 MHz,Chloroform-d)δ:165.05,160.26,156.72,156.68,149.87,147.85,146.98,140.69,130.42,129.75,128.37,127.85,123.61,118.59,52.63,46.90,45.56,44.43,28.03,21.05; HR-MS(ESI-TOF)m/z:Calcd for C27H25N5O4{[M+H]+}484.4899,found 484.1980。
1-(1-丙烯酰吡咯烷-3-基)-3-(4-(三氟甲基)苄基)蝶啶-2,4(1H,3H)-二酮(5l):白色固体155.00 mg,82.50%,1H NMR(600 MHz,Chloroform-d)δ:8.57(ddt,J=11.3 Hz,8.7 Hz,3.5 Hz,2H),7.59(t,J=9.1 Hz,2H),7.49(dd,J=8.1 Hz,5.4 Hz,2H),6.44(dd,J=16.8 Hz,10.1 Hz,1H),6.33~6.25(m,1H),6.05(dp,J=17.2 Hz,8.7 Hz,1H),5.63(ddd,J=31.3 Hz,9.9 Hz,2.3 Hz,1H),5.25(d,J=3.2 Hz,2H),4.03~3.45(m,4H),2.73(ddq,J=40.4 Hz,13.2 Hz,10.2 Hz,9.4 Hz,1H),2.19(ddtd,J=82.2 Hz,11.4 Hz,8.2 Hz,3.4 Hz,1H);13C NMR(126 MHz,Chloroform-d)δ:164.57,159.80,149.91,140.89,132.87~121.18(m),52.66,51.25,45.92,44.47,29.67; HR-MS(ESI-TOF)m/z:Calcd for C21H18F3N5O3{[M+H]+}446.3717,found 446.1439。
1-(1-丙烯酰吡咯烷-3-基)-3-(4-苯氧苄基)蝶啶-2,4(1H,3H)-二酮(5o):白色固体161.00 mg,90.70%,1H NMR(600 MHz,Chloroform-d)δ:8.71~8.57(m,2H),7.55~7.45(m,2H),7.29(td,J=8.6 Hz,8.0 Hz,3.1 Hz,2H),7.07(td,J=7.3 Hz,4.2 Hz,1H),6.95(d,J=8.0 Hz,2H),6.91(ddd,J=8.7 Hz,6.1 Hz,3.4 Hz,2H),6.49(td,J=17.2 Hz,10.3 Hz,1H),6.41~6.28(m,1H),6.13(dp,J=17.2 Hz,8.7 Hz,1H),5.69(dtd,J=32.6 Hz,9.1 Hz,8.2 Hz,3.4 Hz,1H),5.23(d,J=4.2 Hz,2H),4.19~3.67(m,4H),2.91~2.70(m,1H),2.26(ddtd,J=85.1 Hz,11.7 Hz,8.1 Hz,3.5 Hz,1H);13C NMR(126 MHz,Chloroform-d)δ:164.59,160.34,156.79,156.65,147.81,147.10,140.73,131.27,130.09,129.74,128.13,127.73,123.57,118.55,53.78,51.11,45.99,42.08,29.65; HR-MS(ESI-TOF)m/z:Calcd for C26H23N5O4{[M+H]+}470.4652,found 470.1821。
(E)-1-(1-(丁-2-烯基)哌啶-4-基)-3-(4-苯氧基苄基)蝶呤-2,4(1H,3H)-二酮(6e):白色固体162.00 mg,89.00%,1H NMR(600 MHz,Chloroform-d)δ:8.59(s,2H),7.54(d,J=8.6 Hz,2H),7.32(ddd,J=8.5 Hz,7.2 Hz,2.9 Hz,2H),7.11~7.06(m,1H),7.00~6.96(m,2H),6.93(dd,J=8.6 Hz,2.6 Hz,2H),6.91~6.85(m,1H),6.32(ddd,J=14.9 Hz,10.4 Hz,1.9 Hz,1H),5.48(s,1H),5.25(s,2H),4.88(d,J=13.3 Hz,1H),4.17(t,J=16.6 Hz,1H),3.18(d,J=12.7 Hz,1H),2.85~2.69(m,3H),1.91(dd,J=6.9 Hz,1.7 Hz,3H),1.75(d,J=12.8 Hz,2H);13C NMR(126 MHz,Chloroform-d)δ:165.69,159.91,156.75,150.01,147.93,146.25,141.92,140.47,130.08,129.75,123.56,121.48,118.61,53.43,45.71,42.12,27.95,18.30,18.06; HR-MS(ESI-TOF)m/z:Calcd for C28H27N5O4{[M+H]+}498.5146,found 498.1767。
(对甲苯基(E)-4-((1-(1-(丁-2-烯基)哌啶-4-基)-2,4-二氧代-1,4-二氢蝶呤-3(2H)-基)甲基)苯甲酸酯(6i):白色固体161.00 mg,84.20%,1H NMR(600 MHz,Chloroform-d)δ:8.69~8.52(m,2H),8.04~7.90(m,2H),7.61~7.49(m,2H),6.52(tq,J=22.2 Hz,7.0 Hz,1H),5.91~5.73(m,1H),5.42~5.20(m,2H),4.90(ddd,J=11.8 Hz,9.1 Hz,5.1 Hz,1H),4.55(td,J=15.4 Hz,14.3 Hz,8.8 Hz,1H),4.35(qd,J=7.3 Hz,5.3 Hz,3H),4.26(dd,J=13.5 Hz,4.5 Hz,1H),3.75~3.39(m,2H),2.30~1.89(m,4H),1.71(ddd,J=29.0 Hz,6.9 Hz,1.7 Hz,3H),1.37(td,J=7.1 Hz,4.1 Hz,3H);13C NMR(126 MHz,Chloroform-d)δ:166.05,160.25,150.48,148.74,148.06,147.77,147.05,141.07,140.40,139.74,131.51~123.56(m),53.77,45.57,44.26,27.84,21.46,17.85; HR-MS(ESI-TOF)m/z:Calcd for C30H29N5O5{[M+H]+}540.5490,found 540.2241。
(E)-1-(1-(丁-2-烯基)哌啶-3-基)-3-(4-苯氧基苄基)蝶呤-2,4(1H,3H)-二酮(6j):白色固体166.00 mg,85.30%,1H NMR(600 MHz,Chloroform-d)δ:8.73~8.51(m,2H),7.61~7.42(m,2H),7.30(td,J=7.7 Hz,4.9 Hz,2H),7.09(p,J=7.3 Hz,6.8 Hz,1H),6.97(dd,J=8.1 Hz,3.4 Hz,2H),6.92(t,J=9.1 Hz,2H),6.89(q,J=11.3 Hz,8.2 Hz,1H),6.26(dd,J=62.1 Hz,14.9 Hz,1H),5.39~5.32(m,2H),4.76~4.57(m,1H),4.01(dd,J=45.9 Hz,11.5 Hz,1H),3.75(s,1H),2.89~2.50(m,2H),2.04(s,3H),1.88~1.61(m,4H);13C NMR(126 MHz,Chloroform-d)δ:164.65,159.62,156.71,156.68,149.88,147.83,146.95,140.87,140.74,130.39,129.77,123.63,123.44,118.59,52.58,47.07,45.66,44.54,28.07,25.88,14.21; HR-MS(ESI-TOF)m/z:Calcd for C28H27N5O4{[M+H]+}498.5146,found 498.1767。
(E)-1-(1-(丁-2-烯酰基)吡咯烷-3-基)-3-(4-苯氧苄基)蝶啶-2,4(1H,3H)-二酮(6o):淡黄色固体159.00 mg,87.10%,1H NMR(600 MHz,Chloroform-d)δ:8.73~8.51(m,2H),7.61~7.42(m,2H),7.30(td,J=7.7 Hz,4.9 Hz,2H),7.09(p,J=7.3 Hz,6.8 Hz,1H),6.97(dd,J=8.1 Hz,3.4 Hz,2H),6.92(t,J=9.1 Hz,2H),6.25~6.11(m,1H),6.06(ddd,J=29.5 Hz,14.4 Hz,3.6 Hz,1H),5.24(d,J=8.2 Hz,2H),4.15~3.58(m,5H),2.93~2.67(m,1H),2.24(ddtd,J=86.3 Hz,11.6 Hz,8.1 Hz,4.1 Hz,1H),1.96~1.77(m,3H);13C NMR(126 MHz,Chloroform-d)δ:165.05,159.68,156.73,147.86,146.98,142.09,140.69,130.11,129.77,129.75,123.62,121.96,118.60,52.64,51.23,45.88,44.42,29.70,18.12; HR-MS(ESI-TOF)m/z:Calcd for C27H25N5O4{[M+H]+}484.4899,found 484.1980。
1.3 体外抗肿瘤活性测试
使用MTT法测试所合成化合物对体外A549细胞的抑制作用,A549细胞培养时均加入10%澳洲胎牛血清及5%双抗(青霉素加链霉素)。细胞生长在37 ℃,5%的CO2培养箱中。将处于对数生长期的肿瘤细胞接种于96孔板,其中A549细胞每孔接种2500个细胞。本次MTT实验每组复孔2个。待测化合物用DMSO配成浓度为10 mM的母液,取适量母液用培养基稀释到10 μM/L和1 μM/L,加完药物后共培养48 h。加MTT以及DMSO:每孔加入10 μL的5 μg/mL的MTT溶液,37 ℃孵育4 h后,弃去MTT溶液,加入DMSO 150 μL/孔。用酶标仪检测OD值,检测波长为490 nm。抑制率计算:细胞抑制率(%)=[1-(实验组OD值-空白孔OD值)/(对照组OD值-空白孔OD值)]×100%。
2 结果与讨论
2.1 化合物对体外A549细胞的抑制作用分析
本实验选用人非小细胞肺癌A549经行细胞抑制效果测试,并以Ibrutinib作为阳性药。表1是化合物对A549细胞的体外48 h抑制率,其中化合物5h,5j和6o在1 μmol/L浓度时小于10%,几乎没有抑制效果,当浓度增加到10 μmol/L时对A549的抑制率都大于20%,表现出了一定的抑制效果。

表1 化合物对A549细胞的体外抑制率(48 h)
表1中化合物在10 μmol/L浓度下对A549的抑制率都在20%以上,但在1 μmol/L浓度下有部分差异,当末端基团为丙烯酰胺时,5i抑制率比5h大约高3倍,在5i的R基团基础上多一个对位的甲基有利于提高对A549的抑制率,同时将R1基团替换成5j联苯醚时,其抑制活性就降低了。其次,将R2基团替换成3-吡咯时,5o活性又会提高,说明3-吡咯的结构活性较好。当末端基团为巴豆酰胺时,对应的5i比6i活性好些,6j与5j活性相差不大,5o比6o活性好一点。终上所述,引入末端基团的丙烯酰氯和巴豆酰氯都对A549细胞的抑制是有利的,R1基团上引联苯和苯甲酸苯酯之类的结构有利于提高其抑制率,可能是这类结构作用于目标靶蛋白的时候,能更好地与之结合。但是与阳性药对比效果就要差一些,对比阳性药和这类化合物的结构,其母核有一个裸露的氨基,可能是因为这个氨基与蛋白结合时形成了氢键的作用。
3 结论
对2,4-二羟基蝶啶的合成能够采用一步法,且收率较高,但下一步反应中,由于2个胺都能发生亲核取代反应,导致反应的收率低,因此可以尝试使用其他的方法提高收率。在本实验部分中,所用到的原材料大多便宜易得,且条件温和操作简便,这在后续的研发过程中也能降低成本。
本文探索了新的蝶啶类衍生物的结构设计,合成了一系列新的化合物,并且通过1H-NMR、13C-NMR和MS(ESI)等现代波谱技术对所合成的化合物的结构进行了分析及表征,经查证实,所有合成的目标化合物均为新的化合物。并对合成的化合物进行体外细胞A549的抑制作用。结果表明:目标化合物的抑制率都没有阳性药Ibrutinib的效果好,但都对A549有一定的抑制效果,有待进一步的优化,其中5h,5j和6o对A549细胞的抑制效果最好。最后希望本文的工作能为后续的科研工作者提供一定的有用信息。

