含吡唑酮基团的喹唑啉衍生物的合成及其作为EGFR/VEGFR-2双靶标酪氨酸激酶抑制剂
许佳敏,魏洪磊,李亚鑫,杨磊夫,莫善雁,胡利明
(北京工业大学 化学与生命科学学院,环境与病毒肿瘤学北京市重点实验室,北京 100124)
喹唑啉类衍生物具有广泛的生物活性,在抗病毒、抗肿瘤、抗菌、抗疟和抗高血压等方面受到广泛的关注[1-3]。近年来,含喹唑啉母核结构的药物用于非小细胞肺癌、慢性粒细胞白血病和乳腺癌等恶性肿瘤的治疗中,如吉非替尼(Gefitinib)、厄洛替尼(Erlotinib)、卡奈替尼(Canertinib)、阿法替尼(Afatinib)、达科替尼(Dacomitinib)和来那替尼(Neratinib)等,这类药物靶向酪氨酸激酶如EGFR、VEGFR-2靶标。由于这类药物使用后易产生抗性,因此克服这种抗性是目前研究针对酪氨酸激酶的新结构小分子抑制剂是临床研究的热点[4-7]。酪氨酸激酶抑制剂的使用导致患者在服药后数月内对表皮生长因子受体靶标的酪氨酸激酶抑制剂(EGFR-TKIs)产生抗药性,其中获得性抗性是继发性T790M(外显子20)中苏氨酸取代的蛋氨酸突变控制点发生的最常见机制[8]。为了克服这种抗性,同时考虑到实体瘤细胞的生长转移都伴随着血管的生成,因此通过抑制肿瘤血管的生成,从而抑制肿瘤细胞生长。由于肿瘤细胞的大量增殖需要新生血管来供应营养物质和新陈代谢,因此表皮生长因子受体-2(VEGFR-2)表达会比较高[9-13]。帕唑帕尼(Pazopanib)和阿西替尼(Axitinib)等含氮杂环药物已用于以VEGFR为靶标的癌症临床治疗中[14-15]。(图1)
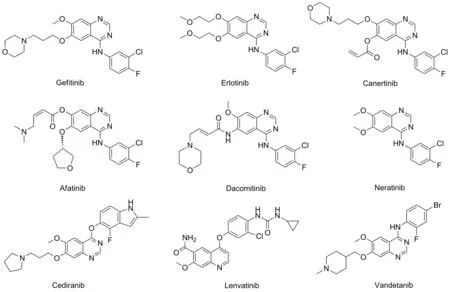
图1 以EGFR或VEGFR-2为靶标用于治疗肿瘤的临床药物
本实验室前期分别针对EGFR和VEGFR开展了酪氨酸激酶抑制剂的研究工作[16-18],在研究过程中发现适当结构的小分子能同时与EGFR和VEGFR相互作用,这就提示了是否能开发出一类EGFR和VEGFR双靶标的抑制剂?多靶标药物是酪氨酸激酶抑制剂研究的热点之一,一方面多靶标药物能改善肿瘤耐药性的出现,另一方面能降低多组分药物的毒副作用,控制药物使用量。
基于本实验前期研究的新型二噁烷并喹唑啉衍生物作为EGFR靶标的酪氨酸激酶抑制剂骨架结构,引入吡唑啉酮环以增强其同VEGFR-2靶标的相互作用,基于多药效团的拼合设计出EGF/VEGFR双靶标酪氨酸激酶抑制剂(图2)。
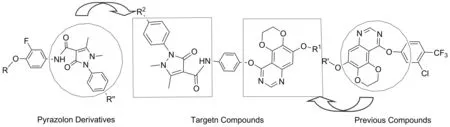
图2 目标化合物设计
反应物二噁烷并喹唑啉中间体参考本实验室的研究工作[16-18]合成,反应物吡唑酮中间体的合成参考文献[19]合成。目标化合物是由二噁烷并喹唑啉中间体和吡唑酮中间体通过亲核取代反应合成。目标化合物骨架结构上的修饰位点较多,能够为其结构改造获得较强生物活性化合物提供可能性。
1 实验部分
1.1 仪器与试剂
FA2004A型电子天秤(上海精天电子仪器有限公司);精密显微熔点测定仪(北京福凯仪器有限公司);Advance 400型核磁共振仪(德国Bruker,TMS为内标,氘代氯仿为溶剂);G3250AALC/MSD TOF型system-高分辨质谱仪(美国安捷伦公司)。
乙酰乙酸乙酯,二氯甲烷,乙酸乙酯,石油醚,甲醇(福晨化学(天津)试剂有限公司),所有试剂均为分析纯;中间体2的合成参考本实验室前期合成路线[16-18],中间体4的合成参考文献[19]。
1.2 中间体氯代二噁烷并喹唑啉衍生物(2)的合成
中间体2的合成路线见图3,具体合成方法参考文献[16-18]。以2,3,4-三羟基苯甲酸为原料,依次于碘甲烷、氯化苄、冰乙酸、1,2-二溴乙烷、钯炭催化脱苄基和与不同的脂肪族卤代烃等6步反应形成相应的8-取代氧基-2,3-二氢苯并[b][1,4]二噁烷-5-羧酸甲酯(1a~1e)。该中间体经硝化、钯炭-氢气催化还原、乙酸甲眯关环反应、再与与三氯氧磷反应生成中间体10-氯-5-取代氧基-2,3-二氢-[1,4]二噁烷[2,3-f]喹唑啉(2a~2e)。
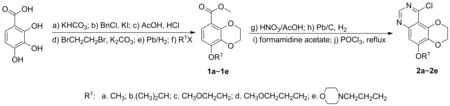
图3 氯代二噁烷并喹唑啉中间体的合成路线
1.3 中间体吡唑酮衍生物4的合成
中间体4的合成路线见图4,合成方法参考文献[19]。以4-取代苯肼盐酸盐和乙酰乙酸乙酯为原料反应生成2-(4-取代苯基)-5-甲基-1,2-二氢-3H-吡唑-3-酮,通过甲基化反应、Vilsmeier反应、氧化反应、酰胺化反应等5步反应生成2-(4-取代苯基)-N-(4-羟基苯基)1,5-二甲基-3-氧代-2,3-二氢-1H-吡唑-4-甲酰胺(4a~4d)。
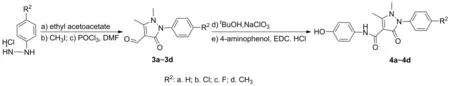
图4 中间体吡唑酮衍生物 4 合成路线
1.4 目标化合物5的合成
目标化合物5的合成采用图5的合成路线,其合成方法为:将化合物2(0.2 mmol)用5 mL异丙醇溶解,加入碳酸钾(69 mg,0.5 mmol),搅拌10 min,再加入化合物4(0.26 mmol),回流反应8 h后冷却至室温有固体析出,过滤,滤饼用异丙醇洗涤(3×45 mL),得白色或灰白色终产物5a~5o。
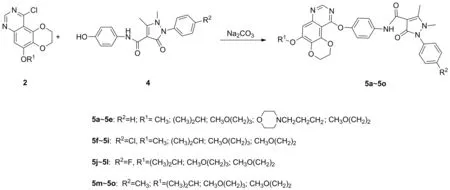
图5 目标化合物 5 合成路线
N-(4-((5-甲氧基-2,3-二氢-[1,4]二噁烷[2,3-f]喹唑啉-10-基)氧基)苯基)-1,5-二甲基-3-氧代-2-苯基-2,3-二氢-1H-吡唑-4-甲酰胺(5a):产率62%;1H NMR(400 MHz,CDCl3)δ:10.78(s,1H),8.52(s,1H),7.79(d,J=8.8 Hz,2H),7.57(t,J=7.6 Hz,2H),7.48(t,J=7.4 Hz,1H),7.39(d,J=7.6 Hz,2H),7.28(s,1H),7.18(d,J=8.8 Hz,2H),7.01(s,1H),4.82(dt,J=12.1 Hz,6.0 Hz,1H),4.47(s,4H),3.50(d,J=5.3 Hz,2H),3.36(d,J=10.6 Hz,3H),2.81(d,J=9.2 Hz,3H),1.51(d,J=6.0 Hz,6H);13C NMR(101 MHz,CDCl3)δ:166.00,164.02,161.46,155.33,153.62,153.06,148.72,148.21,139.26,136.39,133.15,129.80,128.95,128.75,126.42,122.36,120.81,103.01,101.70,100.50,100.06,71.52,64.44,64.19,50.87,33.60,21.78,12.02;HR-MS(ESI)m/z:calcd for C29H26N5O6{[M+H]+},540.1883,found,540.1883。
N-(4-((5-异丙氧基-2,3-二氢-[1,4]二噁烷[2,3-f]喹唑啉-10-基)氧基)苯基)-1,5-二甲基-3-氧代-2-苯基-2,3-二氢-1H-吡唑-4-甲酰胺(5b):产率75%;1H NMR(400 MHz,CDCl3)δ:10.78(s,1H),8.52(s,1H),7.79(d,J=8.8 Hz,2H),7.57(t,J=7.6 Hz,2H),7.48(t,J=7.4 Hz,1H),7.39(d,J=7.6 Hz,2H),7.18(d,J=8.8 Hz,2H),7.01(s,1H),4.82(dt,J=12.1 Hz,6.0 Hz,1H),4.47(s,4H),3.50(d,J=5.3 Hz,2H),3.36(d,J=10.6 Hz,3H),2.95~2.76(m,3H),1.51(d,J=6.0 Hz,6H);13C NMR(101 MHz,CDCl3)δ:166.00,164.02,161.46,155.33,153.62,153.06,148.72,148.21,139.26,136.39,129.80,128.95,128.75,126.42,122.36,120.81,103.01,101.70,100.50,100.06,71.52,64.44,64.19,50.87,33.60,21.78,12.02; HR-MS(ESI)m/z:calcd for C31H30N5O6{[M+H]+} 568.2196,found 568.2198。
N-(4-((5-甲氧基丙氧基-2,3-二氢-[1,4]二噁烷[2,3-f]喹唑啉-10-基)氧基)苯基)-1,5-二甲基-3-氧代-2-苯基-2,3-二氢-1H-吡唑-4-甲酰胺(5c):产率64%;1H NMR(400 MHz,CDCl3)δ:10.78(s,1H),8.53(s,1H),7.78(dd,J=9.5 Hz,2.5 Hz,2H),7.55(dd,J=6.7 Hz,4.8 Hz,2H),7.48(t,J=7.4 Hz,1H),7.43~7.34(m,2H),7.21~7.15(m,2H),7.08(s,1H),4.47(q,J=4.6 Hz,4H),4.12(t,J=7.1 Hz,2H),3.62(t,J=6.1 Hz,2H),3.38(d,J=7.2 Hz,6H),2.81(s,3H),2.21(m,2H);13C NMR(101 MHz,CDCl3)δ:166.03,164.00,161.46,155.28,154.39,153.10,148.59,148.14,139.15,136.44,133.20,132.73,129.79,128.95,126.43,122.36,120.79,101.00,100.01,70.41,68.35,64.47,64.09,59.33,33.59,25.39,12.01; HR-MS(ESI)m/z:calcd for C32H32N5O7{[M+H]+} 598.2302,found 598.2302。
N-(4-((5-(3-吗啉基丙氧基)-2,3-二氢-[1,4]二噁烷[2,3-f]喹唑啉-10-基)氧基)苯基)-1,5-二甲基-3-氧代-2-苯基-2,3-二氢-1H-吡唑-4-甲酰胺(5d):产率62%;1H NMR(400 MHz,CDCl3)δ:10.79(s,1H),8.52(s,1H),7.78(d,J=8.9 Hz,2H),7.56(t,J=7.6 Hz,2H),7.47(t,J=7.4 Hz,1H),7.38(d,J=7.5 Hz,2H),7.18(d,J=8.9 Hz,2H),7.03(s,1H),4.46(d,J=2.4 Hz,4H),4.27(t,J=6.6 Hz,2H),3.85~3.62(m,4H),3.34(d,J=12.3 Hz,3H),2.83~2.71(m,3H),2.57(t,J=7.0 Hz,2H),2.49(s,4H),2.12(p,J=6.8 Hz,2H);13C NMR(101 MHz,CDCl3)δ:166.10,163.96,161.51,155.18,153.04,148.54,148.16,139.12,136.41,133.15,132.50,130.90,129.79,129.01,128.80,126.52,122.31,120.84,103.43,100.02,68.17,64.51,64.20,56.46,50.70,33.53,11.97,10.95; HR-MS(ESI)m/z:calcd for C35H37N6O7{[M+H]+}653.2724,found 653.2718。
N-(4-((5-甲氧基乙氧基-2,3-二氢-[1,4]二噁烷[2,3-f]喹唑啉-10-基)氧基)苯基)-1,5-二甲基-3-氧代-2-苯基-2,3-二氢-1H-吡唑-4-甲酰胺(5e):产率71%;1H NMR(400 MHz,CDCl3)δ:10.79(s,1H),8.54(s,1H),7.79(d,J=8.9 Hz,2H),7.57(t,J=7.6 Hz,2H),7.48(t,J=7.4 Hz,1H),7.41~7.35(m,2H),7.19(d,J=8.9 Hz,2H),7.04(s,1H),4.47(s,4H),4.40~4.28(m,2H),3.97~3.85(m,2H),3.50(s,3H),3.37(s,3H),2.82(s,3H);13C NMR(101 MHz,CDCl3)δ:166.03,164.00,161.46,155.28,154.39,153.10,148.59,148.14,139.15,136.44,133.20,132.73,129.79,128.95,126.43,122.36,120.79,101.00,100.01,70.41,68.35,64.47,64.09,59.33,33.59,25.39,12.01; HR-MS(ESI)m/z:calcd for C31H30N5O7{[M+H]+} 584.2145,found 584.2140。
2-(4-氯苯基)-N-(4-((5-甲氧基-2,3-二氢-[1,4]二噁烷[2,3-f]喹唑啉-10-基)氧基)苯基)-1,5-二甲基-3-氧代-2-苯基-2,3-二氢-1H-吡唑-4-甲酰胺(5f):产率72%;1H NMR(400 MHz,CDCl3)δ:10.69(s,1H),8.57(s,1H),7.79(d,J=8.4 Hz,2H),7.55(d,J=7.9 Hz,2H),7.34(d,J=8.0 Hz,2H),7.19(d,J=8.4 Hz,2H),7.15(s,1H),4.49(s,4H),4.08(s,3H),3.37(s,3H),2.86(d,J=33.6 Hz,3H);13C NMR(101 MHz,CDCl3)δ:166.03,164.00,161.46,155.28,154.39,153.10,148.59,148.14,139.15,136.44,133.20,132.73,129.79,128.95,126.43,122.36,120.79,101.00,100.01,70.41,68.35,64.47,64.09,59.33,33.59,25.39,12.01; HR-MS(ESI)m/z:calcd for C29H25ClN5O6{[M+H]+} 574.1493,found 574.1488。
2-(4-氯苯基)-N-(4-((5-异丙氧基-2,3-二氢-[1,4]二噁烷[2,3-f]喹唑啉-10-基)氧基)苯基)-1,5-二甲基-3-氧代-2-苯基-2,3-二氢-1H-吡唑-4-甲酰胺(5g):产率76%;1H NMR(400 MHz)δ:10.68(s,1H),8.54(s,1H),7.78(d,J=8.9 Hz,2H),7.58~7.50(m,2H),7.33(d,J=8.7 Hz,2H),7.18(d,J=8.9 Hz,2H),7.10(s,1H),4.84(dt,J=12.1 Hz,6.0 Hz,1H),4.47(s,4H),3.34(d,J=12.0 Hz,3H),2.80(d,J=9.6 Hz,3H),1.51(d,J=6.0 Hz,6H);13C NMR(101 MHz,CDCl3)δ:166.03,164.00,161.46,155.28,154.39,153.10,148.59,148.14,139.15,136.44,133.20,132.73,129.79,128.95,126.43,122.36,120.79,101.00,100.01,70.41,68.35,64.47,64.09,59.33,33.59,25.39,12.01; HR-MS(ESI)m/z:calcd for C31H29ClN5O6{[M+H]+} 602.1806,found,602.1801。
2-(4-氯苯基)-N-(4-((5-甲氧基丙氧基-2,3-二氢-[1,4]二噁烷[2,3-f]喹唑啉-10-基)氧基)苯基)-1,5-二甲基-3-氧代-2-苯基-2,3-二氢-1H-吡唑-4-甲酰胺(5h):产率72%;1H NMR(400 MHz,CDCl3)δ:10.68(s,1H),8.54(s,1H),7.78(d,J=8.9 Hz,2H),7.58~7.50(m,2H),7.33(d,J=8.6 Hz,2H),7.19(d,J=8.9 Hz,2H),7.09(s,1H),4.48(s,4H),4.32(td,J=6.5 Hz,3.0 Hz,3H),3.62(t,J=6.1 Hz,2H),3.37(d,J=12.9 Hz,6H),2.81(s,3H),2.29~2.13(m,3H);13C NMR(101 MHz,CDCl3)δ:166.03,164.00,161.46,155.28,154.39,153.10,148.59,148.14,139.15,136.44,133.20,132.73,129.79,128.95,126.43,122.36,120.79,101.00,100.01,70.41,68.35,64.47,64.09,59.33,33.59,25.39,12.01; HR-MS(ESI)m/z:calcd for C32H31ClN5O7{[M+H]+} 632.1912,found 632.1907。
2-(4-氯苯基)-N-(4-((5-甲氧基乙氧基-2,3-二氢-[1,4]二噁烷[2,3-f]喹唑啉-10-基)氧基)苯基)-1,5-二甲基-3-氧代-2-苯基-2,3-二氢-1H-吡唑-4-甲酰胺(5i):产率63%;1H NMR(400 MHz,CDCl3)δ:10.78(s,1H),8.53(s,1H),7.78(dd,J=9.5 Hz,2.5 Hz,2H),7.55(dd,J=6.7 Hz,4.8 Hz,2H),7.48(t,J=7.4 Hz,1H),7.43~7.34(m,2H),7.21~7.15(m,2H),7.08(s,1H),4.47(q,J=4.6 Hz,4H),4.12(t,J=7.1 Hz,2H),3.62(t,J=6.1 Hz,2H),3.38(d,J=7.2 Hz,6H),2.81(s,3H),2.21(m,J=6.3 Hz,2H);13C NMR(101 MHz,CDCl3)δ:167.72,164.15,161.18,156.55,148.20,139.24,136.35,134.72,132.91,132.33,131.86,130.92,128.85,127.31,122.34,120.85,100.69,70.39,65.57,64.49,64.09,59.30,30.58,19.19,13.74,12.08; HR-MS(ESI)m/z:calcd for C31H29ClN5O7{[M+H]+} 618.1756,found 618.1750。
2-(4-氟苯基)-N-(4-((5-异丙氧基-2,3-二氢-[1,4]二噁烷[2,3-f]喹唑啉-10-基)氧基)苯基)-1,5-二甲基-3-氧代-2-苯基-2,3-二氢-1H-吡唑-4-甲酰胺(5j):产率81%;1H NMR(400 MHz,CDCl3)δ:10.72(s,1H),8.52(s,2H),7.41~7.33(m,2H),7.30~7.25(m,2H),7.18(d,J=8.9 Hz,2H),7.04(s,1H),4.92~4.73(m,1H),4.47(s,4H),4.32(t,J=6.7 Hz,2H),3.31(s,3H),2.80(s,3H),1.51(d,J=6.1 Hz,7H);13C NMR(101 MHz,CDCl3)δ:166.03,164.00,161.46,155.28,154.39,153.10,148.59,148.14,139.15,136.44,133.20,132.73,129.79,128.95,126.43,122.36,120.79,101.00,100.01,70.41,68.35,64.47,64.09,59.33,33.59,25.39,12.01; HR-MS(ESI)m/z:calcd for C31H29FN5O6{[M+H]+} 586.2102,found 586.2096。
2-(4-氟苯基)-N-(4-((5-甲氧基丙氧基-2,3-二氢-[1,4]二噁烷[2,3-f]喹唑啉-10-基)氧基)苯基)-1,5-二甲基-3-氧代-2-苯基-2,3-二氢-1H-吡唑-4-甲酰胺(5k):产率74%;1H NMR(400 MHz,CDCl3)δ:10.72(s,1H),8.52(s,1H),7.80~7.75(m,2H),7.39~7.34(m,2H),7.30~7.22(m,2H),7.21~7.15(m,2H),7.06(s,1H),4.46(q,J=4.6 Hz,4H),4.31(td,J=6.6 Hz,4.4 Hz,3H),3.61(t,J=6.1 Hz,2H),3.36(d,J=18.5 Hz,6H),2.79(s,3H),2.31~2.14(m,2H);13C NMR(101 MHz,CDCl3)δ:166.03,164.00,161.46,155.28,154.39,153.10,148.59,148.14,139.15,136.44,133.20,132.73,129.79,128.95,126.43,122.36,120.79,101.00,100.01,70.41,68.35,64.47,64.09,59.33,33.59,25.39,12.01; HR-MS(ESI)m/z:calcd for C32H31FN5O7{[M+H]+} 616.2208,found 616.2202。
2-(4-氟氯苯基)-N-(4-((5-甲氧基乙氧基-2,3-二氢-[1,4]二噁烷[2,3-f]喹唑啉-10-基)氧基)苯基)-1,5-二甲基-3-氧代-2-苯基-2,3-二氢-1H-吡唑-4-甲酰胺(5l):产率69%;1H NMR(400 MHz,CDCl3)δ:10.72(s,1H),8.54(s,1H),7.77(t,J=7.9 Hz,2H),7.43~7.33(m,2H),7.27(d,J=8.9 Hz,2H),7.19(d,J=8.9 Hz,2H),7.04(d,J=15.0 Hz,1H),4.47(s,4H),4.31(d,J=6.7 Hz,2H),3.97~3.83(m,2H),3.50(s,3H),3.35(s,3H),2.81(s,3H);13C NMR(101 MHz,CDCl3)δ:166.03,164.00,161.46,155.28,154.39,153.10,148.59,148.14,139.15,136.44,133.20,132.73,129.79,128.95,126.43,122.36,120.79,101.00,100.01,70.41,68.35,64.47,64.09,59.33,33.59,25.39,12.01; HR-MS(ESI)m/z:calcd for C31H29FN5O7{[M+H]+} 602.2051,found 602.2046。
2-(4-甲基苯基)-N-(4-((5-异丙氧基-2,3-二氢-[1,4]二噁烷[2,3-f]喹唑啉-10-基)氧基)苯基)-1,5-二甲基-3-氧代-2-苯基-2,3-二氢-1H-吡唑-4-甲酰胺(5m):产率69%,1H NMR(400 MHz,CDCl3)δ:10.82(s,1H),8.52(s,1H),7.81~7.74(m,2H),7.35(d,J=8.1 Hz,2H),7.25(d,J=8.3 Hz,2H),7.20~7.15(m,2H),7.04(s,1H),4.82(m,J=6.0 Hz,1H),4.46(s,4H),3.34(s,3H),2.79(s,3H),2.43(s,3H),1.50(d,J=6.1 Hz,6H);13C NMR(101 MHz,CDCl3)δ:166.03,164.00,161.46,155.28,154.39,153.10,148.59,148.14,139.15,136.44,133.20,132.73,129.79,128.95,126.43,122.36,120.79,101.00,100.01,70.41,68.35,64.47,64.09,59.33,33.59,25.39,12.01; HR-MS(ESI)m/z:calcd for C32H32N5O6{[M+H]+} 582.2353,found 582.2347。
2-(4-甲基苯基)-N-(4-((5-甲氧基丙氧基-2,3-二氢-[1,4]二噁烷[2,3-f]喹唑啉-10-基)氧基)苯基)-1,5-二甲基-3-氧代-2-苯基-2,3-二氢-1H-吡唑-4-甲酰胺(5n):产率78%;1H NMR(400 MHz,CDCl3)δ:10.82(s,1H),8.52(s,1H),7.78(d,J=8.4 Hz,2H),7.35(d,J=7.6 Hz,2H),7.25(d,J=7.7 Hz,2H),7.17(d,J=8.4 Hz,2H),7.05(s,1H),4.46(s,4H),4.30(t,J=5.6 Hz,2H),3.61(t,J=5.5 Hz,2H),3.36(d,J=17.7 Hz,6H),2.78(s,3H),2.43(s,3H),2.31~2.12(m,2H);13C NMR(101 MHz,CDCl3)δ:166.03,164.00,161.46,155.28,154.39,153.10,148.59,148.14,139.15,136.44,133.20,132.73,129.79,128.95,126.43,122.36,120.79,101.00,100.01,70.41,68.35,64.47,64.09,59.33,33.59,25.39,12.01; HR-MS(ESI)m/z:calcd for C33H34N5O7{[M+H]+} 612.2458,found 612.2453。
2-(4-甲基苯基)-N-(4-((5-甲氧基乙氧基-2,3-二氢-[1,4]二噁烷[2,3-f]喹唑啉-10-基)氧基)苯基)-1,5-二甲基-3-氧代-2-苯基-2,3-二氢-1H-吡唑-4-甲酰胺(5o):产率79%;1H NMR(400 MHz,CDCl3)δ:10.83(s,1H),8.55(s,1H),7.79(d,J=8.9 Hz,2H),7.36(d,J=8.1 Hz,2H),7.28(d,J=6.6 Hz,2H),7.18(d,J=8.9 Hz,2H),7.08(s,1H),4.47(s,4H),4.37~4.25(m,4H),4.00~3.85(m,J=11.9 Hz,3H),3.34(d,J=13.5 Hz,3H),2.80(s,3H),2.44(s,3H);13C NMR(101 MHz,CDCl3)δ:166.03,164.00,161.46,155.28,154.39,153.10,148.59,148.14,139.15,136.44,133.20,132.73,129.79,128.95,126.43,122.36,120.79,101.00,100.01,70.41,68.35,64.47,64.09,59.33,33.59,25.39,12.01; HR-MS(ESI)m/z:calcd for C32H32N5O7{[M+H]+} 598.2302,found 598.2296。
1.5 EGFR和VEGFR-2抑制活性评价
采用ADP-Glo激酶活性检测方法测定15个目标化合物对EGFR或VEGFR-2的抑制活性,方法如下:(1)化合物稀释:从最高浓度5000 nM开始进行5倍梯度稀释,配制成5000 nM、1000 nM、200 nM、40 nM和8 nM共5个浓度; (2)底物配制:取10 μL DMSO和190 μL(1×Buffer)配置成5%的DMSO溶液; (3)加抑制剂:取一块白底96孔板,除对照组外,在每孔中加入5 μL不同浓度的抑制剂(用5% DMSO稀释制得),用5 μL 5% DMSO设置对照组,阳性对照(激酶,底物+ATP、5% DMSO)、阴性对照(底物+ATP、5% DMSO、1×反应Buffer); (4)加激酶溶液(除阴性对照组外):在上述每孔中加入10 μL激酶溶液(1×反应Buffer稀释制得),阴性对照组中用10 μL×反应Buffer设置激酶对照组 ;(5)加底物及ATP混合液:在上述每孔中加入10 μL混合溶液(含5 μL底物酪蛋白及5 μL的ATP),室温下孵育60 min; (6)加入ADP-Glo TM试剂:在上述每孔中分别加入25 μL ADP-Glo TM试剂室温下孵育40 min,终止反应进程; (7)激酶试剂检测:向上述每个孔中分别加入50 μL激酶检测试剂室温下避光孵育30 min; (8)将96孔板放入Envision仪,调取相应的程序检测信号; (9)原始数据的分析和处理:将药物浓度和相应抑制率输入GraphPad Prism 5计算处理,化合物的抑制率计算方法如下:抑制率(%)=[1-(实验孔读值-阴性对照孔读值)/(阳性对照孔读值-阴性对照孔读值)]×100%。用GraphPad Prism5软件处理得出相应的IC50值(均设置2个重复组)。
1.6 A549和Hela细胞抗增殖评价
分别选用人肺癌细胞(A549)和人宫颈癌细胞(Hela)采用CCK-8法测试部分化合物的体外抗肿瘤活性,方法如下:(1)从液氮中取出Hela/A549细胞,37 ℃温水中复苏细胞,将细胞放入含有10% FBS、80 U/mL青霉素及0.08 mg/mL链霉素的培养基中,在37 ℃恒温培养箱中抚育48h; (2)将培养基中的培养液吸出,用10% PBS缓冲溶液洗涤细胞2次,在细胞培养瓶中加入300 μL胰酶,稍后加入1 mL PBS缓冲溶液中和胰酶,将培养瓶放入37 ℃培养箱中消化1min,将消化后的细胞吹打均匀后移入15 mL离心管中,以800 rpm 转速离心5h; (3)移出上清液,加入含有10% PBS的DMEM培养液吹打均匀,取10 μL细胞悬浮液和10μL 0.4%胎盼蓝混匀,在细胞计数仪下进行计数; (4)在96孔板中,给每孔加入100 μL的细胞悬液(约10000个细胞),每组设5个复孔重复实验,将处理好的96孔板放入37 ℃培养箱中培育48 h,使细胞贴壁; (5)化合物稀释:用DMSO配置化合物浓度,从最高浓度5000 nM开始进行5倍浓度稀释,设5000 nM、1000 nM、200 nM、40 nM和8 nM浓度梯度; (6)按照每孔接种3000细胞/80 μL的细胞悬液到96孔板中,设置阳性和空白对照孔; (7)用培养液稀释对应的化合物浓度,然后在每个对应孔中分别加入20 μL培养液,DMSO终浓度为0.25%; (8)培育72 h后,在每个孔中加入10 μL CCK-8试剂,培养2 h; (9)使用多功能读板机在450 nm处读出其吸光值; (10)数值计算:细胞存活率(%)=[(As-Ab)/(Ac-Ab)]×100%,As:实验孔(含有细胞的培养基、CCK-8、化合物)的OD值,Ac:对照孔(含有细胞的培养基、CCK-8)的OD值,Ab:空白孔(不含细胞和化合物的培养基、CCK-8)的OD值; (11)然后将数值导入Graphpad Prism5软件进行曲线拟合,计算IC50值。
1.7 HUEVC细胞抗增殖活性评价
选用人脐静脉内皮细胞(HUVEC)采用CCK-8法测试部分化合物的体外抗增殖活性,方法如下:(1)首先配置Fibronectin溶液和ECM培养基。Fibronectin的配置:先将Fibronectin置于室温30 min后加入5 mL无菌水静置30 min,使其完全溶解,终浓度为1 mg/mL,以200 μL/管的体积分装,放置于-20 ℃保存。ECM完全培养基:500 mL ECM培养基中加入25 mL FBS、5 mL ECGS和5 mL P/S Solution,注意配制过程中避光; (2)在Fibronectin包被的T75培养瓶中用上述ECM完全培养基培养状态良好的低代次HUVEC细胞; (3)实验当天包被96孔板(包被时Fibronectin的浓度为2 μg/cm3,每孔40 μL溶液),于37 ℃培养箱中培养至少2 h; (4)从液氮中取出HUVEC细胞,37 ℃温水中复苏细胞,将细胞放入含ECM培养基中,在37 ℃恒温培养箱中孵育48 h; (5)将培养基中的培养液吸出,用10% PBS缓冲溶液洗涤细胞2次,加入300 μL胰酶在细胞培养瓶中,稍后加入1 mL PBS缓冲溶液中和胰酶,将培养瓶放入37 ℃培养箱中消化1min,消化后的细胞吹打均匀后移入15 mL离心管中,以800 rpm转速离心5 h; (6)移出上清液加入含有10% PBS的DMEM培养液吹打均匀,取10 μL细胞悬浮液和10 μL 0.4%胎盼蓝混匀,在细胞计数仪下进行计数;7)在96孔板中给每孔加入100 μL的细胞悬液(约10000个细胞),每组设5个复孔进行重复实验,将加好的96孔板放入37 ℃培养箱中培育48 h使细胞贴壁; (8)化合物稀释:用DMSO配置化合物浓度,从最高浓度5000 nM开始进行5倍浓度稀释,设5000 nM、1000 nM、200 nM、40 nM和8 nM共5个浓度梯度; (9)按照每孔接种3000细胞/80 μL的细胞悬液到96孔板中,设置阳性和空白对照孔; (10)用培养液稀释对应的化合物浓度,然后在每个对应孔中分别加入20 μL培养液,DMSO终浓度为0.25%; (11)培育72 h后,在每个孔中加入10 μL CCK-8试剂培养2h; (12)使用多功能读板机在450 nm处读出其吸光值; (13)数值计算:细胞存活率(%)=[(As-Ab)/(Ac-Ab)]×100% As:实验孔(含有细胞的培养基、CCK-8、化合物)的OD值Ac:对照孔(含有细胞的培养基、CCK-8)的OD值Ab:空白孔(不含细胞和化合物的培养基、CCK-8)的OD值; (14)然后将数值导入Graphpad Prism5软件进行曲线拟合,计算IC50值。
1.8 分子对接方法
受体的晶体结构从PDB数据库(https://www.rcsb.org/)中下载,其中VEGFR晶体结构的PDB id为3WZD[20],EGFR晶体结构的PDB id为1M17[21]。分子对接前,首先对受体结构进行预处理,包括合并非极性氢,删除共晶水,合并电荷去除孤对电子,去除非标准氨基酸链等。随后,小分子结构使用Discovery Studio 4.0软件进行结构优化。使用晶体结构中的共晶配体定义结合口袋位置。在默认参数下,使用AutoDock Vina[22]软件将化合物5l对接到受体活性位点,选取对接打分最优的构象进行后续分析。使用PyMOL软件进行蛋白-配体结合模式分析。
2 结果与讨论
2.1 目标化合物的生物活性
测定了所有化合物针对EGFR和VEGFR-2激酶的抑制活性和部分化合物对宫颈癌细胞(Hela)、人肺癌细胞(A549)和人脐静脉内皮细胞(HUVEC)的抗增殖活性,结果见表1。结果发现当R1为甲氧基乙基时,化合物对EGFR的抑制活性IC50=10~37 nM,与对照药物阿法替尼(Afatinib)相当,对VEGFR-2的抑制活性IC50=15~30 nM,与对照药物索拉菲尼(Sorafenib)相当。化合物5e、5i、5l和5o对EGFR/VEGFR-2同时具有良好的抑制活性。R1为甲氧基丙基时,化合物对EGFR的抑制活性IC50=57~436 nM,对VEGFR-2的抑制活性IC50=88~241 nM,化合物5c、5h、5k和5n的抑制活性明显低于R1为甲氧基丙基化合物的5e、5i、5l和5o。这说明R1烷烃链的长度对化合物的活性有较大的影响,长度增加则化合物的活性降低,原因可能是结合口袋空间较小,化合物不能很好地进入酶的活性口袋。为了验证这一思路,将R1链进一步增长体积增大合成了化合物5d,其对EGFR和VEGFR-2的抑制活性IC50分别为899 nM和712 nM,吗啉取代的丙基很难结合到激酶的活性口袋,导致化合物5d抑制活性进一步降低。接着研究了取代基R1对化合物活性的影响,结果发现:当R1为卤素时,其对EGFR和VEGFR-2激酶的抑制活性普遍高于氢和甲基,尤其是R1为氟原子时活性最强,化合物5l对EGFR和VEGFR-2激酶的抑制活性IC50分别为10 nM和15 nM。表中的IC50>500 nM判定为无抑制活性。综上所述:(1)当取代基R1基团为甲氧基乙基时,化合物的抑制活性较好,而取代基碳链太长或太短其抑制活性降低;(2)当取代基R2为吸电子基团时,化合物对EGFR和VEGFR-2具有良好的抑制活性,而为给电子基团时,化合物活性明显减弱;(3)相比较而言,取代基R1对活性的影响大于取代基R2。
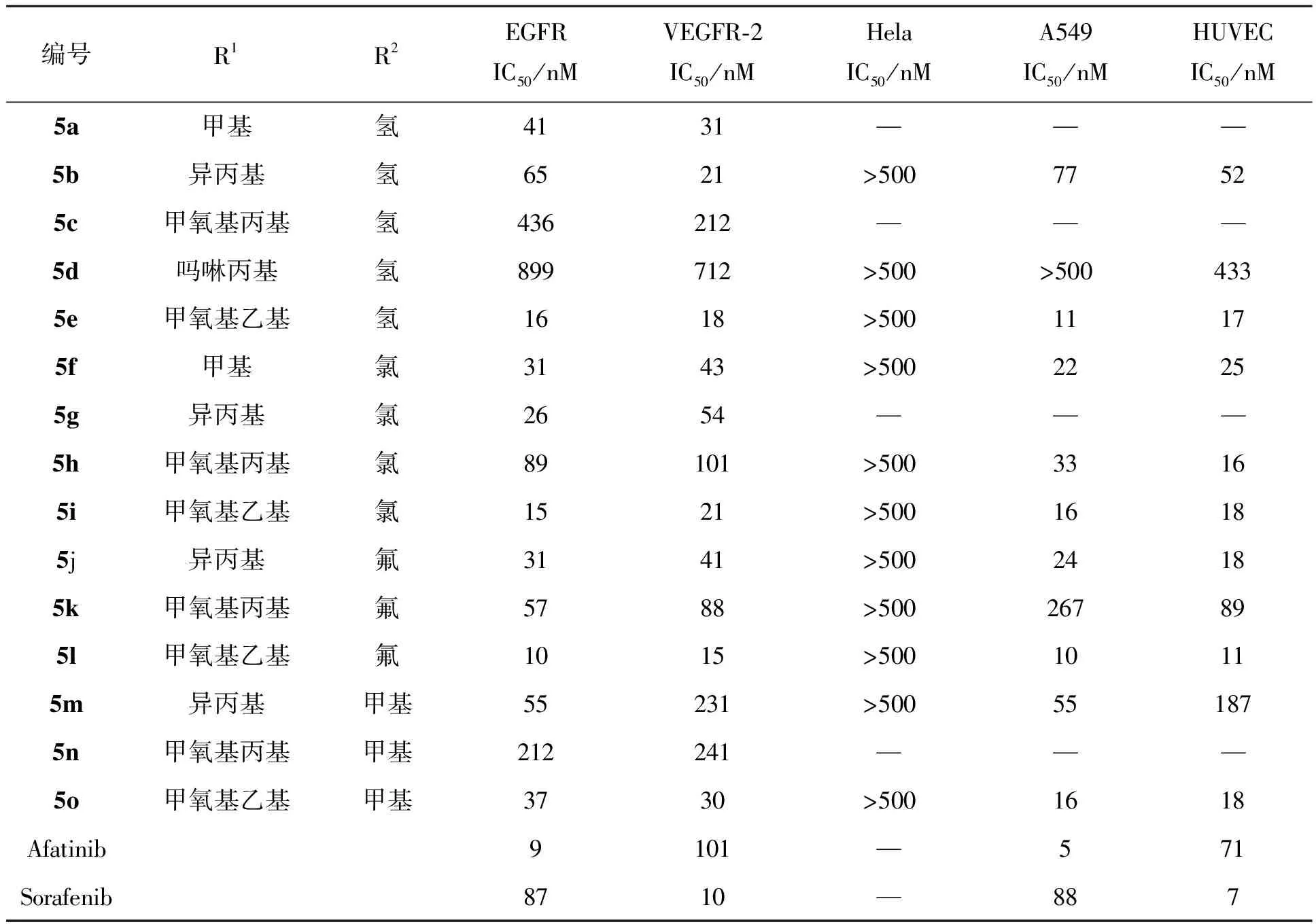
表1 目标化合物5a~5o的生物活性
利用宫颈癌细胞(Hela)、人肺癌细胞(A549)和人脐静脉内皮细胞(HUVEC)分别选取部分化合物进行了细胞增殖活性测定,结果表明:在激酶活性检测中表现出良好抑制活性的化合物在细胞增殖活性测定中对A549细胞和HUVECs细胞也表现出良好的抑制活性。化合物5e、5i、5l和5o对A549细胞的抑制活性IC50=10~16 nM,与对照药物Afatinib相当,对HUVEC细胞的抑制活性IC50=11~18 nM,与对照药物Sorafenib相当。所测化合物对Hela细胞的抗增殖能力较弱,进一步说明目标化合物的抗增殖活性与被测试细胞中靶标激酶EGFR和VEGFR-2相关。
2.2 化合物5l与EGFR和VEGFR-2的结合模式分析
化合物5l对EGFR和VEGFR-2表现出良好的抑制活性,为了探索其与激酶的相互作用模式,分别采用分子对接方法,分子对接结果如图6所示,化合物5l的喹唑啉氮原子作为氢键受体与VEGFR2铰链区关键氨基酸残基Cys919形成了氢键,酰胺基NH与羰基氧原子作为氢键供体与氢键受体分别与Glu885和Asp1046形成了氢键网络,五元氮杂环与末端苯环深入到后口袋部分,同时与Phe1047形成了π-π堆积相互作用(图6a)。化合物5l的喹唑啉氮原子与EGFR铰链区Met769形成了关键氢键相互作用,位于溶剂可及区的含氧脂肪链与Lys704同样形成了氢键相互作用。在5l的氢键供体-受体富集区,2个羰基氧原子分别与Lys721和Asp831形成了氢键相互作用。值得一提的是,末端吸电子取代的苯环与去质子化的Asp831还存在阴离子-π相互作用(图6b)。
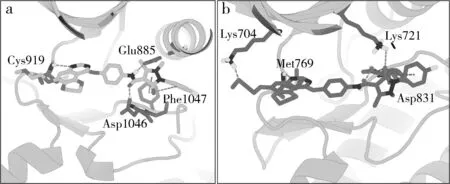
图6 化合物5l与VEGFR-2(a)和EGFR(b)的非共价相互作用,包括氢键、π-π堆积和阴离子-π相互作用
3 结论
本文设计并合成了15个以EGFR和VEGFR-2为双靶标的新型二噁烷并喹唑啉化合物,这些化合物均未见文献报道,通过1H NMR、13C NMR、HR-MS等进行了结构表征,并测定了它们对EGFR和VEGFR-2两种激酶的抑制活性,探讨了其人肺癌细胞(A549)和人脐静脉内皮细胞(HUVECs)的抗增殖活性,并对其结构与活性关系进行了初步研究。化合物5l对EGFR的抑制活性IC50=10 nM,对VEGFR的抑制活性IC50=15 nM;当取代基R1为甲氧基乙基时,所合成的化合物对EGFR和VEGFR-2激酶均表现出良好的抑制活性。化合物5l对A549细胞和HUVEC细胞也表现出良好的抗增殖活性,其抑制活性IC50分别为10 nM和11 nM。同样,当取代基R1为甲氧基乙基时,所合成的化合物对A549细胞和HUVEC均表现出良好的抑制活性。活性测定结果表明:该化合物的作用靶标为EGFR和VEGFR-2激酶。选用抑制活性最强的化合物5l采用分子对接方法初步研究其与EGFR和VEGFR-2相互作用方式,结果显示:化合物5l能较好地插入到EGFR激酶和VEGFR-2激酶口袋中,其主要作用方式为氢键、π-π堆积和阴离子-π相互作用。该工作为双靶点抗肿瘤药物的研究与开发奠定了良好的基础。
作者许佳敏和魏洪磊对本工作具有同等贡献。

