构建1,3,5-三嗪环新方法的研究进展
谭玉敏,刘 纤,陈怡诺,黄绍强,曾 明
(九江学院 药学与生命科学学院,江西 九江 332005)
1,3,5-三嗪类化合物具有抗病毒、抗菌、抗肿瘤和抗炎等多种生物活性[1-7],是一类极其重要的含氮杂环化合物,最早应用于农业领域,作为除草剂、杀虫剂等[8-9]。随着分子生物学、药物化学等学科的发展,1,3,5-三嗪类化合物逐渐被应用于药物研发[10],目前已有多个以三嗪为母核的小分子化合物进入临床研究阶段或者已被FDA批准上市[11-14],如恩西地平(2017年经FDA批准治疗急性髓系白血病),PKI-587(2022年经FDA批准治疗乳腺癌),PRQ-309(临床Ⅱ期),PQR-620(临床Ⅱ期)等(图1)。因此,如何构建三嗪环并对三嗪环进行衍生化引起了有机化学工作者和药物化学工作者的广泛关注[15]。

图1 三嗪类代表性活性化合物
传统的合成三嗪衍生物的方法主要从1,3,5-三聚氯氰出发,通过多步亲核取代反应或Suzuki偶联反应得到多取代的三嗪类化合物[16]。然而,传统方法主要面临着原料不稳定、反应活性不高和三嗪类化合物结构多样性不够等问题。因此,近年来化学工作者在构建1,3,5-三嗪环新方法和三嗪类化合物的衍生化等工作方面开展了大量的研究工作。
本文主要对近十年来三嗪类化合物的合成新方法进行了总结和归纳,根据反应初始原料的不同,将这些反应主要分为3类:(1)以脒类化合物为原料;(2)以胍类化合物为原料;(3)以其他含氮化合物为原料。期望通过对这些1,3,5三嗪环合成新方法的综述与总结,为类药性1,3,5三嗪小分子库的构建提供参考。
1 构建1,3,5-三嗪环的反应机理
脒类化合物和胍类化合物是合成构建1,3,5-三嗪环的主要原料,根据底物的不同,可以将构建1,3,5-三嗪环的反应机理归纳为2类:(1)当以脒类化合物为原料时,主要通过[1+2+3]环合的方式进行构建;(2)当以胍类化合物为原料时,主要通过[1+5]环合的方式进行构建。
1.1 [1+2+3]环合
脒类与亲电试剂反应通过[1+2+3]环合构建1,3,5-三嗪环的反应机理:脒类化合物1首先与亲电性的碳供体(一般为醛的前体化合物如活性甲基、醇、醚和卤代甲基等)缩合得到中间体A,然后A再与另一分子的脒发生亲核加成得到化合物B,B发生分子内的环合得到化合物C,然后C在一定条件下脱去一分子氨气形成化合物D,最后D在氧或过渡金属催化条件下发生芳构化得到1,3,5-三嗪类化合物(图2)。
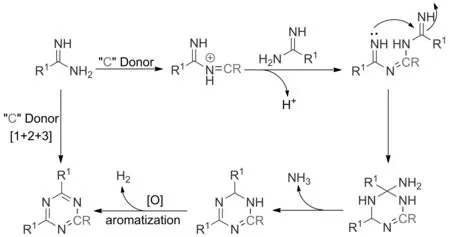
图2 [1+2+3]环合反应机理
1.2 [1+5]环合
胍类化合物与亲电试剂通过[1+5]环合构建1,3,5-三嗪环的机理:首先双胍1异构化形成化合物A,然后A与亲电性的碳供体(一般为醛及其前体化合物如醇、活性甲基等)发生脱水缩合得到化合物B,B进一步发生分子内环合得到中间体C,最后C在氧或过渡金属催化条件下发生芳构化得到1,3,5-三嗪类化合物(图3)。

图3 [1+5]环合反应机理
2 1,3,5-三嗪环的构建方法
2.1 以脒类化合物为原料
脒类化合物是合成三嗪化合物的重要原料之一,该类反应主要通过[1+2+3]环合的机理进行,其中C1供体主要来源于胺类化合物、芳基甲烷、卤代烃、醇类化合物和醛类化合物等。2014年,LI等[17]首次开发了以一价铜(CuI)为催化剂,脒类化合物为原料,DMF为碳源,吡啶为碱,90 ℃条件下反应合成2,4-二取代-1,3,5三嗪类化合物的新方法。该方法具有操作简单,底物范围广等优点,收率可达66%(图4)。

图4 铜(I)催化脒与N,N-二甲基甲酰胺反应合成三嗪化合物
2015年,JIANG等[18]以脒类化合物为原料,Cu(OAc)2为催化剂,K3PO4为碱,氧气为氧化剂,DMSO或三乙胺为碳源合成1,3,5-三嗪类化合物,收率达85%(图5)。此外,底物适用性结果显示:当以CuCl2为催化剂,DMF为溶剂时,脒类化合物与DMF发生分子间缩合得到1-甲基-3-芳基三氮唑类化合物。2018年,YAN等[19]发现脒类化合物与叔胺在碘的作用下通过一锅法2步C—N的形成得到对称的1,3,5-三嗪衍生物,首次证明了该反应是在碘正离子的促进下通过自由基机理进行的。
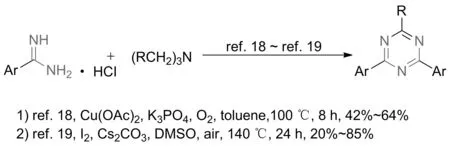
图5 铜(II)催化脒与胺类化合物反应合成三嗪化合物
2016年,BHALCHANDRA等[20]以苄胺类化合物和脒类盐酸盐为原料,O2为氧化剂,PEG600为溶剂,开发了一种绿色、高效的合成不对称的1,3,5-三嗪类化合物的合成方法,收率达97%(图6),其中在氧气条件下,芳香苄胺脱氨转化为芳香醛是该反应关键步骤,避免了有毒溶剂及过渡金属的使用。此外,PEG600可以通过萃取、回收使用之后,产物收率仍可达到95%左右。

图6 碳酸钙催化苄胺类化合物与脒反应合成三嗪类化合物
2015年,GUO等[21]开发了一种在无金属条件下,以TBHP为氧化剂,甲基芳烃和脒为原料制备2,4,6-三取代1,3,5-三嗪类化合物合成新方法。该方法以甲基芳烃为碳源,其具有良好的官能团耐受性,反应条件温和,收率达77%(图7)。

图7 甲基芳烃为碳源合成1,3,5-三嗪
2020年,ZHANG等[22]以2-甲基喹啉和脒类化合物为原料,K2S2O8为氧化剂,DMSO∶PhCl=1∶1(V∶V)为溶剂,在I2的催化作用下反应合成1,3,5三嗪类化合物。该反应不需要过渡金属的参与,收率达92%(图8),为喹啉取代的三嗪衍生物的合成提供了新的思路。
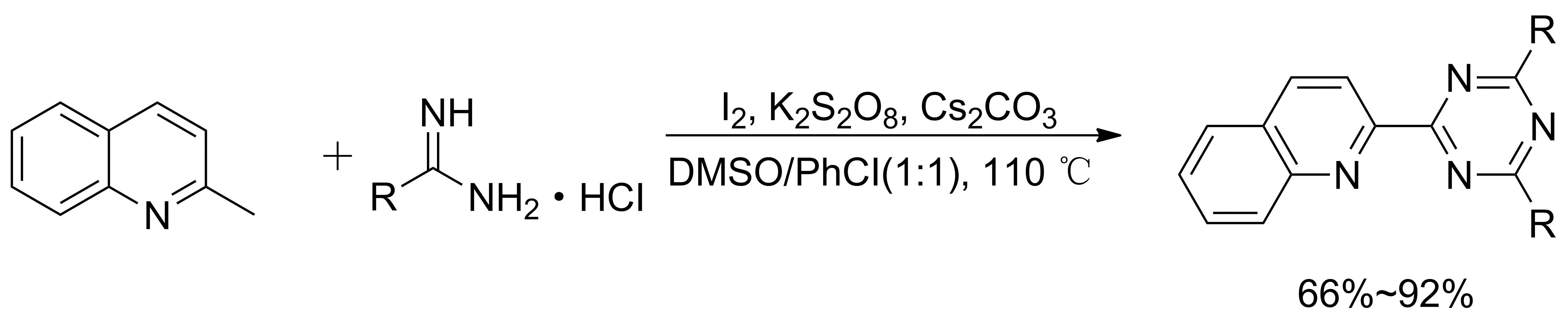
图8 喹啉取代的1,3,5-三嗪化合物的合成
2020年,WU等[23]以甲基酮为碳源,氰胺和芳胺为原料,I2的催化作用下通过连续4步C—N偶联反应合成芳甲酰基取代的1,3,5三嗪类化合物,收率达75%(图9)。该反应条件温和,底物适用性广泛。
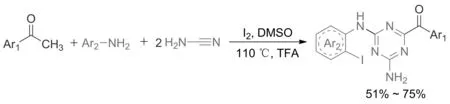
图9 碘催化多组分一锅法合成2,4-二氨基-1,3,5-三嗪
2018年,YAN等[24]首次开发了在无过渡金属条件下以烷基醚化合物为碳源合成2,4-二取代1,3,5-三嗪的新方法。烷基醚与脒类化合物反应合成三嗪化合物经历了C—N形成、C—O断裂、亲核加成、缩合和氧化芳构化等多个过程,收率达85%(图10)。该方法操作简单、绿色环保,且反应过程中伴随着醇、氨和水等化合物的生成,目标产物易分离,适用于2,4-二取代1,3,5-三嗪类化合物的制备。
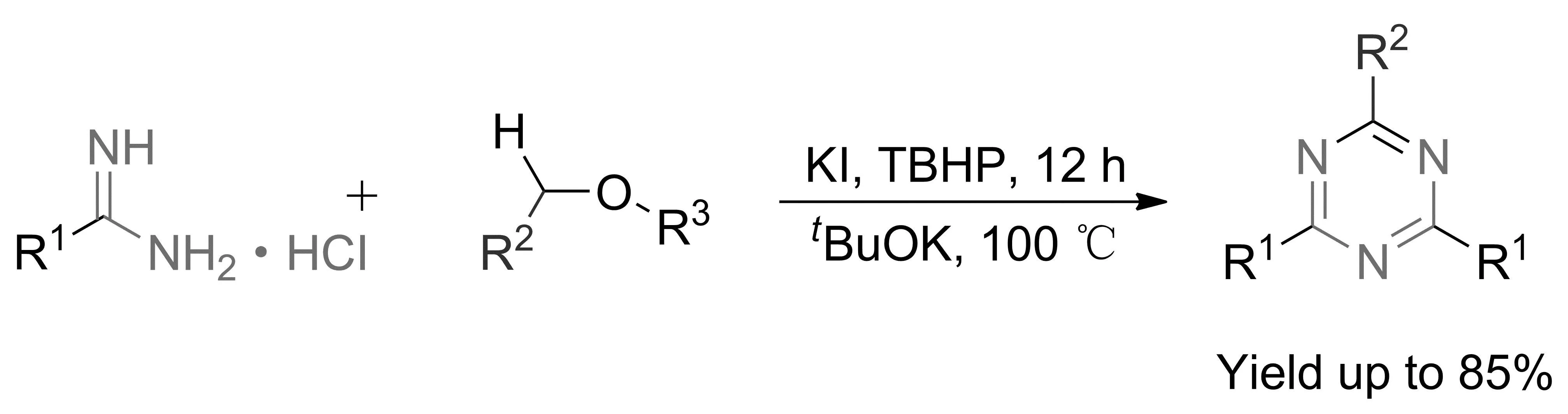
图10 碘化钾催化烷基醚与脒类化合物环合合成1,3,5-三嗪
2019年,该研究团队[25]又以二氯甲烷为碳源,氯化亚铜为催化剂,1,10-菲啰啉为配体,在空气氛围下与脒类化合物反应合成2,4-二取代的1,3,5-三嗪衍生物,收率20%~80%(图11),通过同位素标记的二氯甲烷对反应机理进行了研究,证实了二氯甲烷中碳为三嗪C1的来源。

图11 铜催化二氯甲烷为碳源合成2,4-二取代的1,3,5-三嗪
2019年,SONG等[26]首次报道了以1,1-二氟-1-溴氟乙酸乙酯与脒类化合物在无过渡金属条件下环化合成2,4-二取代-1,3,5-三嗪类化合物的方法,收率达86%(图12)。底物适用性研究结果显示,当以2种不同的脒盐酸盐为原料时,反应主要得到2种对称和不对称的2,4-二取代-1,3,5-三嗪。

图12 1,1-二氟-1-溴氟乙酸乙酯为碳源合成1,3,5-三嗪
2019年,YAN等[27]以1,1-二氟-1-氯-乙酸钠替代1,1-二氟-1-溴氟乙酸乙酯,以Cs2CO3为碱,在乙腈溶剂中与脒类盐酸盐环合得到2,4-二取代-1,3,5-三嗪类化合物,收率提高至96%,该反应中,1,1-二氟-1-氯-乙酸钠作为合成三嗪化合物的C1的来源,同时羧酸钠分解为低毒的二氧化碳、氟化铯和氯化钠等(图13)。

图13 1,1-二氟-1-氯-乙酸钠与脒类化合物反应合成1,3,5-三嗪
2019年,HAN等[28]发现苄氯类化合物与脒类盐酸盐在单质硫催化作用下经亲核取代、消除和亲核加成等过程得到对称的三芳基取代的三嗪衍生物,收率达88%,其中单质硫的用量为反应物的75%。然而,由于单质硫的销售和使用受相关部门的管制,该方法的应用受到了一定的限制(图14)。

图14 苄氯与脒类化合物反应合成1,3,5-三嗪
脒类化合物和醛类化合物在一定条件下经缩合、环合可制备1,3,5-三嗪类化合物[29],然而,醛化学性质相对不稳定,在反应过程中往往会发生副反应,因此,以醇代替醛作为C-烷基化或N-烷基化试剂受到了化学工作者的广泛关注。
2014年,ZHANG等[30]首次开发了以芳香甲醇和脒类化合物为原料,在[RuCl2(p-cymene)]2/Cs2CO3的催化剂体系下经氢转移反应合成1,3,5-三嗪类衍生物的新方法,收率达85%(图15),然而当底物为乙脒盐酸盐或脂肪族醇时,反应几乎不发生。2015年,ZHANG等[31]在上述反应基础上进行了进一步的探索,发现当以Cu(OAc)2为催化剂,O2为氧化剂,Na2CO3为碱,甲苯为溶剂时,反应底物适用性与[RuCl2(p-cymene)]2/Cs2CO3的催化剂体系相比有较大的提升,甲醇、乙醇和丁醇脂肪族醇等都适用于该反应。在上述基础上,ABHISHEK等[32]报道了一种无过渡金属催化的醇与脒的盐酸盐反应合成1,3,5-三嗪类化合物的新方法,该方法仅需催化量的NIS(N-碘代丁二酰亚胺)和更低的反应温度。2019年,MENG等[33]对上述反应进行了改进,开发了一种绿色、高效的氧化锰八面体分子筛(OMS-2)/氧气催化体系,反应收率达95%。在该反应中,OMS-2表现出较好催化活性,且重复使用5次后,反应收率仍可达到90%以上。该反应具备操作简单、底物适用性广泛和催化剂可循环利用等优点,符合绿色化学的发展理念。2022年,SIDDIKI等[34]制备了一种氧化铝负载的铂纳米颗粒(Pt/AI2O3)催化剂,进一步对上述反应进行了优化,发现在Pt/AI2O3的催化作用下,芳香甲醇和脒类化合物通过无受体脱氢、缩合和脱水等步骤可以得到1,3,5-三嗪衍生物。值得一提的是,反应中Pt/AI2O3催化剂也可重复使用,收率可达95%以上。
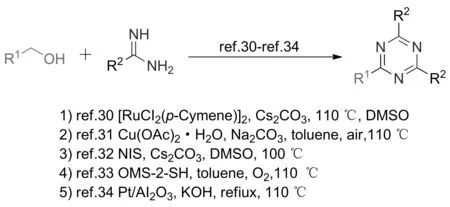
图15 基于醇类化合物的脱氢偶联反应合成1,3,5-三嗪
2020年,MA等[35]发现N,N-二甲基乙醇胺和脒类盐酸盐在氯化铜催化作用下可得到2种不同取代的三嗪衍生物(图16)。当以芳基脒盐酸盐为底物时,反应产物为2,4-二取代的1,3,5-三嗪;当以N-取代的芳基脒盐酸盐为底物时,反应产物为1,2,4-三取代-1,2-二氢-1,3,5-三嗪。

图16 氨基醇与脒类化合物反应合成二氢三嗪衍生物
近年来,通过光催化反应制备有机小分子化合物的合成新方法受到化学工作的关注。2019年,ZHANG等[36]报道了一种在可见光催化条件下脒类化合物、异硫氰酸和1,1,3,3-四甲基胍通过[3+1+2]环合得到不对称的1,3,5-三嗪衍生物的新方法,收率为35%~77%(图17)。该反应具有原料易得、对空气和水分不敏感、底物适用性广、原子经济性高和条件温和等优点。2021年,WANG等[37]开发了一种全新的生物催化体系,发现当以兔血红蛋白为催化剂,过氧叔丁醇(TBHP)为氧化剂,DMSO为溶剂时,绝大部分产物收率在90%以上,该反应原料在很短时间内(反应时间约10 min)迅速转化为目标分子,兔血红蛋白添加量仅为0.05%(物质的量分数),为不对称三嗪类化合物的合成提供了参考。

图17 [3+1+2]环合制备不对称1,3,5-三嗪
2021年YUAN等[38]报道了一种制备不对称三嗪衍生物的方法,首先以取代的酰基异氰酸酯和脒类化合物为原料,甲苯为溶剂,加热至130 ℃得到了三嗪酮,然后三嗪酮在三氯氧磷作用下得到氯代三嗪衍生物,为不对称三嗪衍生物的合成提供了全新的思路。该方法与传统方法相比,操作简单,后处理简单,通过简单的水洗、过滤即可得到纯度较高的产品(图18)。

图18 以三嗪酮为中间体制备1,3,5-三嗪
2018年,CHANG等[39]报道了以N-苯并咪唑基脒类化合物和醛在碘化亚铜/碘作用下构建1,3,5三嗪环的新方法。在反应过程中,碘可作为氧化剂,同时也可作为Lewis酸促进反应的进行。该反应过程操作简单且对空气不敏感,收率可达95%(图19)。
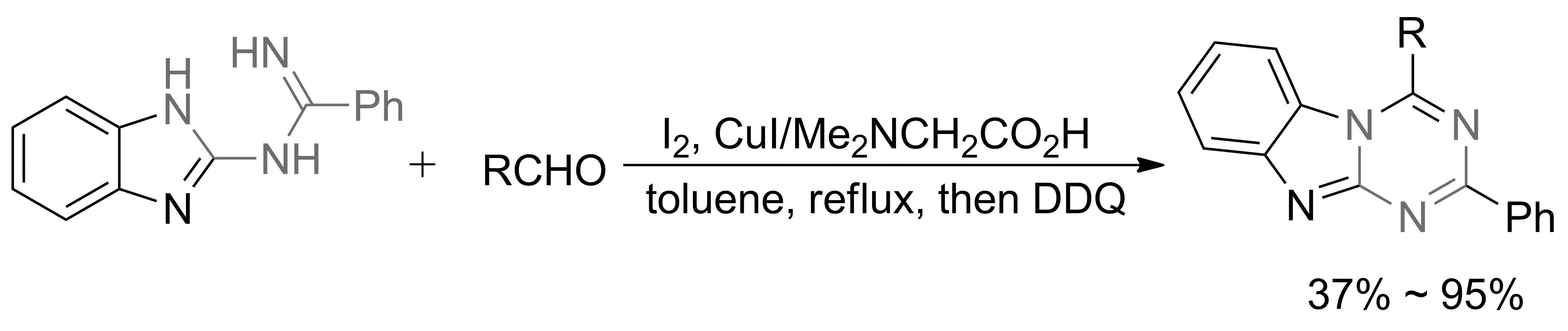
图19 铜催化三嗪[1,2-a]并苯并咪唑类化合物的合成
2.2 以胍类化合物为原料
胍类化合物与酯、羧酸、酰氯和醛等化合物在碱性条件下缩合制备1,3,5-三嗪类化合物是最常见的方法之一[40],然而这些原料往往存在活性不高或者性质不稳定等问题。因此,化学工作者不断尝试以胍类化合物为底物,寻找性质稳定、绿色环保的可替代的烷化剂,开发新的三嗪衍生物的合成方法。
醇的氢转移反应(也称借氢反应,Hydrogen Transfer or Hydrogen Borrowing)是一种原子经济性很高的绿色合成方法,反应一般伴随着水的产生。一般反应过程如下:在过渡金属催化条件下,醇转化为醛,氢以金属氢复合物(MH2)的形式暂时储存起来,然后醛与亲核试剂反应形成不饱和键,最后金属氢复合物与不饱和键发生还原反应或者在一定条件下释放氢气实现氢转移过程[41]。
2016年,本课题组[42]以醇和双胍盐酸盐为原料,以1,5-环辛二烯二氯化钌为催化剂,叔丁醇钾为碱,经氢转移反应得到了1,3,5-三嗪衍生物,收率达83%(图20)。2018年,本课题组进一步对反应的底物适用性进行了研究,发现当以芳基烯丙醇为底物,Ru(PPh3)Cl2为催化剂时,产物为芳乙基取代的三嗪衍生物。值得一提的是,当芳基甲醇与2-胍基苯并咪唑或胍基脲为底物时,在相同条件下也可以获得相应的二氢三嗪或三嗪酮类的化合物[43-44]。2020年,BHANAGE等[45]采用更廉价的石墨烯氧化物为催化剂对上述反应进行了改进,该反应以甲苯为溶剂,叔丁醇钾为碱,收率可达93%,石墨烯氧化物重复使用6次后,反应收率仍可达到80%左右。
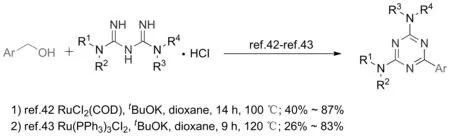
图20 基于醇的氢转移反应制备1,3,5-三嗪
2017年,ZHANG等[46]报道了以1,1-二溴烯烃和双胍类化合物为原料,碘化亚铜为催化剂,联吡啶为配体,磷酸钾为碱,通过C—N偶联反应制备三嗪衍生物的方法,收率达86%(图21)。反应底物适用性良好,1,1-二溴烯烃的芳环上有供电子取代基或吸电子取代基均能获得良好的反应收率。

图21 铜催化1,1-二溴烯烃与双胍反应合成1,3,5-三嗪
2019年,LIANG等[47]报道了在光催化条件下,全氟烷基卤化合物与双胍经单电子转移反应、HF消除、电环化和芳构化等过程合成全氟烷基取代的1,3,5-三嗪衍生物的新方法,收率达87%(图22)。

图22 可见光促进的全氟烷基取代的三嗪类化合物的合成
2019年,JUNAID等[48]报道了在微波辐射条件下,氰胍、芳香醛和芳胺3组份通过缩合、Dimroth重排和脱氢芳构化等步骤构建1,3,5三嗪环的方法。该反应以乙醇为溶剂,反应时间50 min左右,底物适用性良好,收率达80%(图23)。
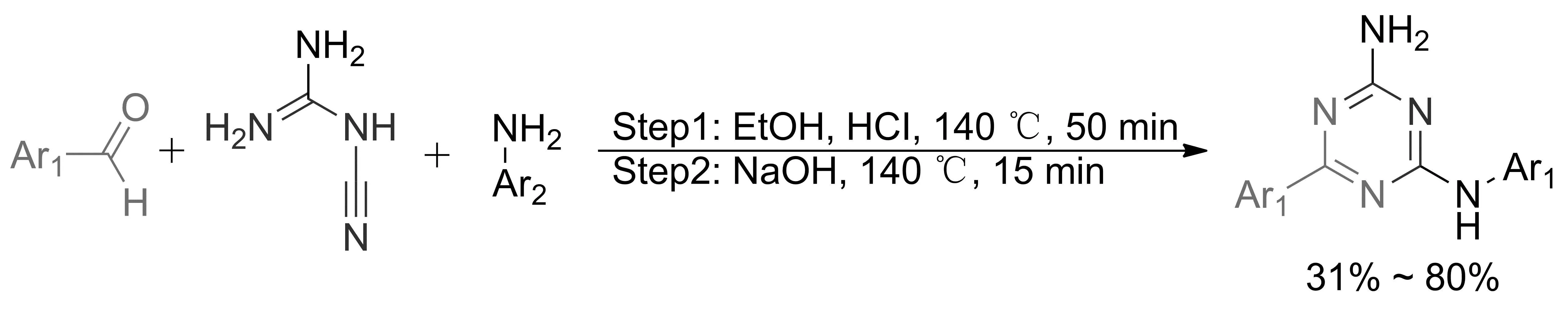
图23 三组分一锅法合成1,3,5-三嗪
2.3 其他类
2018年,FELICIA等[49]通过2-氨基-1,3-咪唑类化合物、氰胺和三原酸酯在微波辐射条件下构建咪唑[1,2-a]并[1,3,5]三嗪的方法,该反应具有较好的区域选择性和化学选择性。然而,当三原酸酯的R为位阻较大的取代基如异丙基、丁基时,收率在30%左右;当R取代基为甲基、乙基等取代基时,收率可达61%(图24)。

图24 咪唑[1,2-a]并[1,3,5]三嗪的构建
2020年,GAO等[50]开发了一种以2-氨基苯并咪唑、甲醛和碘化铵为原料,在空气氛围下高效合成1,3,5-三嗪并二氮杂茂的方法。该反应以碘化铵作为构建三嗪环的氮源,通过一锅法4步C—N的形成合成目标分子,收率达79%(图25)。该合成方法具有操作简单、高效和无过渡金属参与等优点。
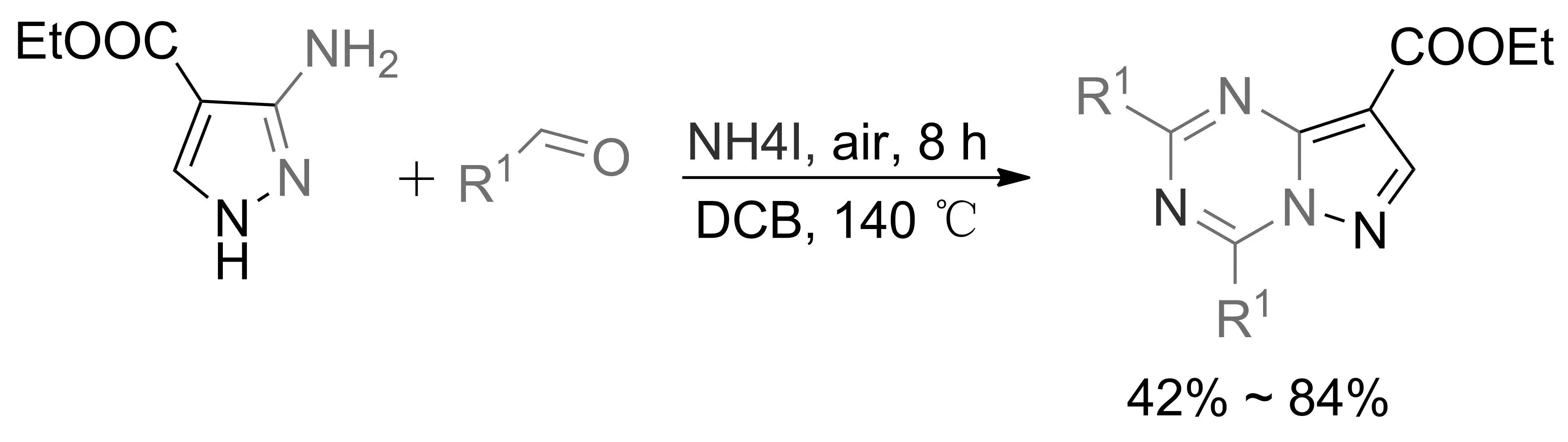
图25 邻二氮杂茂[1,5-a]并[1,3,5]-三嗪化合物的制备
2022年,DENG等[51]在上述反应基础上以2-氨基苯并咪唑为原料,碘化铵为碳源开发了合成新型的三嗪并苯并咪唑化合物的方法,反应收率达90%(图26)。

图26 三嗪并[1,2-a]苯并咪唑化合物的构建
2020年,XIAO等[52]以碘化铵为唯一氮源,醛为碳源,氯化铁为催化剂,开发了2,4,6-三取代1,3,5三嗪类化合物的方法。该方法具有较高的原子经济性和广泛的底物适用范围,当以苯甲醛为原料时,该方法收率最高为72%,然而,当以2,4,6-三甲基苯甲醛为原料时,反应几乎不发生(图27)。
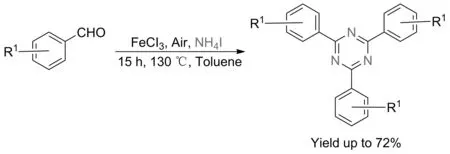
图27 醛与碘化铵反应合成1,3,5-三嗪
3 结论与展望
1,3,5-三嗪化合物在材料、化工和医药等领域有着广泛的应用前景,然而传统的1,3,5-三嗪类化合物的合成方法受底物影响使得三嗪类小分子化合物缺乏结构多样性,这极大地限制了1,3,5-三嗪类化合物的开发与利用。本文综述了以含氮小分子(脒类化合物和胍类化合物)为原料,通过[1+2+3]环合、[1+5]环合一锅法构建1,3,5-三嗪衍生物新方法。这些新方法所使用的原料廉价易得、操作方便、反应后处理简单,大多数方法底物适用性强,收率较高,能够广泛应用于三嗪小分子化合物的合成。然而,个性化合成含特定取代基的三嗪化合物仍面临着巨大的挑战。与三嗪环直接相连的碳、氮等[53-56]原子具有一定的化学活性,开发高效、绿色的合成方法通过官能团转化合成新型三嗪衍生物是科研人员不断探索的新方向。

