新型大黄酸丹皮酚偶联物的合成及抗炎活性
刘成波,何 冰,谭鸿舟,吴 虹,何黎琴*
(1.安徽中医药大学 药学院,安徽 合肥 230038; 2.皖西卫生职业学院,安徽 六安 237000)
骨关节炎(Ostoarthritis,OA)是世界范围内常发于中老年人群体的一种慢性、退行性疾病[1]。近几十年来OA发病率以及致残率在全球范围内稳步增长,严重影响了患者的生活质量,也增加了家庭经济负担[2]。目前治疗骨关节炎的常用药物是非甾体抗炎药,但由于长期用药对胃肠道的不良反应较多,降低患者的依从性。因此,寻找高效及副作用小的新型抗骨关节炎药物具有重要的现实意义。
大黄酸是传统中药大黄的主要活性成分,具有广泛的药理活性,如抗菌、抗氧化、抗炎和抗肿瘤等作用[3-6]。研究发现,大黄酸能有效降低受损软骨细胞和滑膜细胞中TNF-α,IL-1β和IL-6的mRNA水平,可通过抑制炎性因子的产生发挥抗炎作用[7-11]。大黄酸溶解性能较差,生物利用度低,这一缺陷严重影响其在临床上的应用。临床实践发现,通过对大黄酸的结构修饰,可以获得临床应用的药物。比如用于治疗骨关节炎的双醋瑞因就是大黄酸羟基的双乙酰化产物,通过对其羟基修饰,可以达到减轻腹泻的副作用。受此鼓舞,激发了众多药物研究者从事大黄酸的结构修饰工作,并取得了丰硕的研究成果。
丹皮酚是中药牡丹皮中的主要有效单体成分,具有抗炎、抗血小板聚集等多种生物活性[12]。临床上丹皮酚主要用于镇痛、抗炎、解热和抑制变态反应等方面的治疗。研究表明,对丹皮酚进行结构修饰和改造可以得到抗炎活性增强的丹皮酚衍生物[13]。课题组前期也着手丹皮酚的结构修饰和改造,得到了多个在抗血小板聚集活性方面具有研发前景的丹皮酚衍生物[14-16]。基于此,考虑到大黄酸和丹皮酚(1)均具有良好的抗炎作用,加上大黄酸具备与骨组织中羟基磷灰石结合的条件,具有骨亲和性[17],本研究利用药物化学的拼合原理,将大黄酸的2-位羧基和丹皮酚的2-位羟基通过不同链长的连接臂偶联,设计合成了5个目标化合物3a~3e(图1);采用脂多糖刺激巨噬细胞(RAW264.7)构建细胞炎症模型,RT-qPCR检测炎性因子TNF-α,IL-1β和IL-6的mRNA表达,对目标化合物进行体外抗炎活性初步评价,期望得到的目标化合物能够发挥骨亲和性和协同抗炎作用,为获得疗效良好、不良反应少的抗骨关节炎药物打下基础。

图1 目标化合物3a~3e的合成路线
1 实验部分
1.1 仪器与试剂
Bruker AVⅢ 600MHz型核磁共振仪;Mel-TEMP Ⅱ型数字熔点仪(上海索光光电技术有限公司);Dinnigan LCQ Advantage MAX型液质联用质谱仪;ZF-7型暗箱线分析三用紫外仪;CO2细胞培养箱(美国Thermo Fisher公司);LightCycler 480 Ⅱ型全自动荧光定量PCR仪(美国Roche公司)。
丹皮酚,大黄酸(98%,西安小草植物科技有限公司);二溴烷烃,N-N二甲基甲酰胺(DMF),K2CO3(分析纯,国药集团化学试剂有限公司);脂多糖(LPS;美国Sigma-Aldrich公司);DMEM(南京维森特公司);胎牛血清(FBS;美国GIBCO公司);TRIzol试剂(苏州新赛美公司);逆转录试剂盒和SYBR Green Master Mix试剂(上海翊圣生物科技有限公司)。其他所用试剂均为分析纯。小鼠巨噬细胞RAW264.7购自中国科学院上海细胞库。
1.2 合成
(1) 化合物2的合成
以化合物1为原料,通过Williamson合成法在碱性条件下利用2-位羟基与二溴烷烃Br(CH2)nBr进行反应,得到中间体丹皮酚溴代烷基醚(2)。将265 mg(1.0 mmol)化合物1,120 mg(3.0 mmol) NaOH,10 mL DMF置于50 mL圆底烧瓶内,35 ℃下搅拌20 min,再加入相应的二溴烷烃(6.0 mmoL),继续搅拌反应,TLC检测跟踪反应结束后,抽滤反应液,将滤液倒入100 mL水中,加入二氯甲烷萃取(3×50 mL)。有机相经饱和食盐水洗涤、适量无水硫酸钠干燥后浓缩,柱层析分离(乙酸乙酯:石油醚=1∶4,V∶V)得2a:白色固体212 mg,产率78.2%;2b:白色固体216 mg,产率79.3%;2c:白色固体224 mg,产率为82.4;2d:白色固体219 mg,产率为80.5%;2e:白色固体223 mg,产率为82.1%。
(2) 化合物3的合成
化合物2与大黄酸羧基进行亲核取代反应得到化合物3。向50 mL圆底烧瓶中加入426 mg(1.5 mmol)大黄酸,276 mg(2.0 mmol)碳酸钾,10 mL DMF在60 ℃下搅拌反应30 min后,滴加相应的中间体丹皮酚溴代烷基醚(1.0 mmoL),继续60 ℃搅拌反应,TLC检测跟踪反应结束后,抽滤,二氯甲烷洗涤滤饼,滤液加100 mL水稀释,二氯甲烷萃取(3×50 mL)。有机相经饱和食盐水洗涤、适量无水硫酸钠干燥后浓缩,经柱层析分离(乙酸乙酯∶石油醚=1∶3,V∶V)得黄色固体3a~3e。
3a:黄色固体,220 mg,产率46.3%,m.p.136.2~137.5 ℃;1H NMR(CDCl3,600 MHz),δ:12.03(s,1H),11.95(s,1H),8.43(s,1H),7.94(s,1H),7.86(d,2H,J=8.2 Hz),7.73(t,1H,J=7.7 Hz),7.34(d,1H,J=8.4 Hz),7.26(s,1H),6.57(d,1H,J=8.7 Hz),6.48(s,1H),4.82(t,2H,J=7.2 Hz),4.43(t,2H,J=7.1 Hz),3.86(s,3H),2.60(s,3H);13C NMR(151 MHz,Chloroform-d)δ:164.43,162.42,137.77,133.47,132.88,130.82,128.81,125.30,124.90,120.40,120.12,105.88,99.16,68.16,66.13,55.55,31.86; HR-MS(ESI-TOF),m/z:Calcd for C26H20O9{[M+H]+} 476.1171,found 476.1154。
3b:黄色固体,223 mg,产率47.8%,m.p.138.2~139.5 ℃;1H NMR(600 MHz,CDCl3),δ:11.94(s,1H),8.39(d,1H,J=1.7 Hz),7.92(d,1H,J=1.7 Hz),7.86(d,1H,J=7.5 Hz),7.83(d,1H,J=8.8 Hz),7.72(t,1H,J=7.9 Hz),7.33(d,1H,J=8.4 Hz),7.25(s,1H),6.52(d,1H,J=2.3 Hz),6.46(d,1H,J=2.3 Hz),4.62(t,2H,J=6.3 Hz),4.22(t,2H,J=6.1 Hz),3.84(s,3H),2.60(s,3H),2.43~2.35(m,2H);13C NMR(151 MHz,Chloroform-d)δ:197.33,192.76,180.79,164.41,164.29,162.80,162.38,160.20,137.90,137.70,133.92,133.48,132.69,125.19,124.84,121.31,120.32,120.06,118.25,115.82,105.22,98.95,67.81,65.47,55.44,31.88,25.61;HR-MS(ESI-TOF),m/z:Calcd for C27H22O9{[M+H]+} 490.1337,found 490.1348。
3c:黄色固体,258 mg,产率51.3%,m.p.140.5~141.6 ℃,1H NMR(CDCl3,600 MHz),δ:11.99(s,1H),11.93(s,1H),8.37(d,1H,J=1.6 Hz),7.89(d,1H,J=1.7 Hz),7.86~7.82(m,1H),7.80(d,1H,J=8.7 Hz),7.71(d,1H,J=8.0 Hz),7.32(d,1H,J=8.5 Hz),6.48(d,1H,J= 2.3 Hz),6.41(d,1H,J=2.3 Hz),4.47(m,2H),4.12(m,2H),3.81(s,3H),2.59(s,3H),2.09~2.01(m,4H);13C NMR(151 MHz,Chloroform-d)δ:197.33,192.76,180.79,164.41,164.29,162.80,162.38,160.20,137.90,137.70,133.92,133.48,132.69,125.19,124.84,121.31,120.32,120.06,118.25,115.82,105.22,98.95,67.81,65.47,55.44,31.88,25.97,25.61; HR-MS(ESI-TOF),m/z:Calcd for C28H24O9{[M+H]+} 504.1473,found 504.1483。
3d:黄色固体,252 mg,产率48.7%,m.p.141.3~142.9 ℃,1H NMR(CDCl3,600 MHz),δ:12.01(s,1H),11.95(s,1H),8.39(d,1H,J=1.7 Hz),7.91(d,1H,J=1.7 Hz),7.86(d,1H,J=7.4 Hz),7.80(d,1H,J=8.9,3.2 Hz),7.72(t,1H,J=8.0 Hz),7.31(d,1H,J=8.3 Hz),6.52~6.45(m,1H),6.42(d,1H,J=2.5 Hz),4.43(t,2H,J=6.7 Hz),4.13~4.01(m,2H),3.83(d,3H,J=4.2 Hz),2.58(d,3H,J=10.2 Hz),2.00~1.81(m,2H),1.68(m,2H),1.41(d,2H,J=7.1 Hz);13C NMR(151 MHz,Chloroform-d)δ:197.49,192.80,180.88,164.44,164.36,162.81,162.40,160.37,138.02,137.69,136.03,133.95,133.51,132.65,125.21,124.85,121.29,120.34,120.11,119.34,105.16,98.95,69.76,68.32,55.45,31.90,31.58,30.30,22.86; HR-MS(ESI-TOF),m/z:Calcd for C29H26O9{[M+H]+} 518.1637,found 518.1642。
3e:黄色固体,产率49.4%,m.p.142.2~143.4 ℃,1H NMR(CDCl3,600 MHz)δ:11.94(s,1H),11.89(s,1H),7.92~7.83(m,1H),7.82~7.63(m,3H),7.33~7.26(m,1H),7.27(s,1H),6.48~6.35(m,2H),4.39(t,2H),4.03(t,2H,J=6.4 Hz),3.79(s,3H),2.55(s,3H),1.94~1.91(m,2H),1.90(t,2H,J=6.5 Hz),1.65~1.51(m,2H),1.28~1.24(m,2H);13C NMR(151 MHz,Chloroform-d)δ:197.49,192.80,180.88,164.44,164.36,
162.81,162.40,160.37,138.02,137.69,136.03,133.95,133.51,132.65,125.21,124.85,121.29,120.34,120.11,119.34,105.16,98.95,69.76,68.32,55.45,31.90,31.58,30.30,29.66,28.82; HR-MS(ESI-TOF),m/z:Calcd for C30H28O9{[M+H]+} 532.1786,found 532.1793。
1.3 体外抗炎活性分析[18]
将生长状态良好的巨噬细胞(RAW264.7)加至12孔板中(5×105/孔),加培养基培养过夜(培养基为含10% FBS及双抗的DMEM)。次日更换细胞新鲜培养基,向孔中加入20 μg/mL浓度的目标化合物3a~3e,30 min后加入LPS(0.1 μg/mL)刺激细胞,6 h后收集细胞,Trizol裂解,提取总RNA,进行反转录,实时荧光定量PCR检测TNF-α,IL-1β和IL-6的mRNA水平,平行实验重复3次。结果如表1所示。结果显示:目标化合物在20 μg/mL浓度下可下调炎症因子TNF-α,IL-1β和IL-6 mRNA的表达。
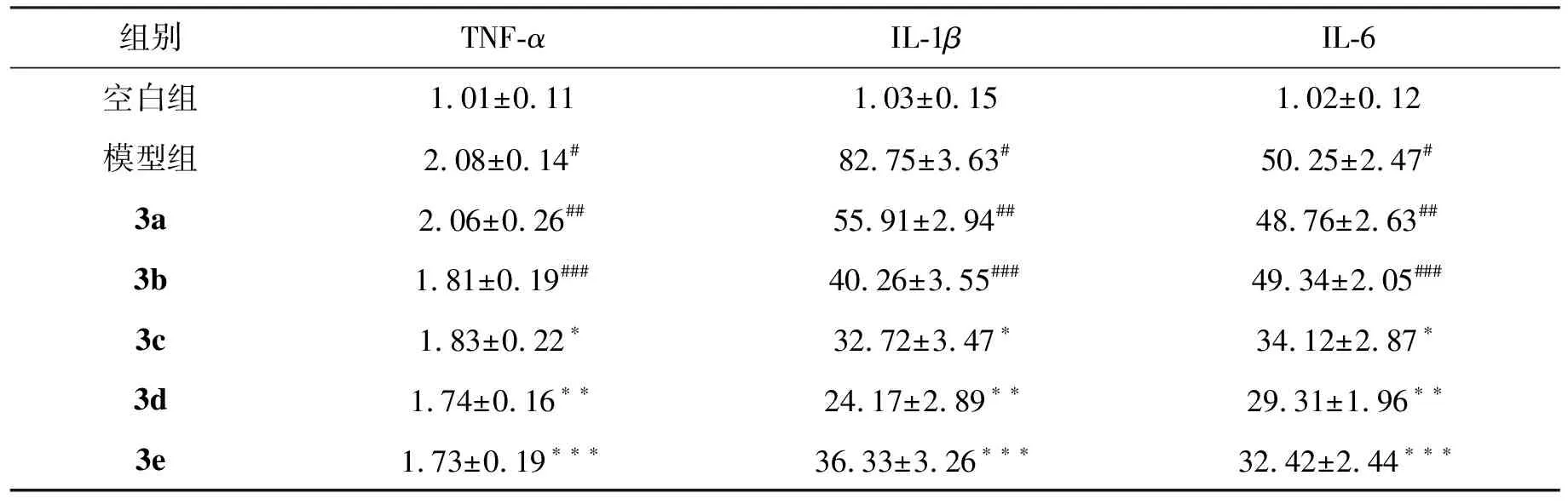
表1 20 μg/mL浓度下3a~3e对TNF-α、IL-1β、IL-6 mRNA表达的影响
2 结果与讨论
2.1 目标化合物合成工艺优化分析
在目标化合物的合成中,本文曾设计如下合成路线(图2):将大黄酸与不同链长的二溴烷烃反应得到相应的大黄酸溴代烷基酯(化合物4a~4e),然后再与丹皮酚(化合物1)的2-位酚羟基反应所得目标化合物3a~3e。进一步分析发现,此合成路线尽管可以以较高产率得到溶解性能较好的大黄酸溴代烷基酯,但在第二步反应中,在强碱和温度较高的反应条件下,中间体大黄酸溴代烷基酯的稳定性会受到影响。此外,大黄酸分子中的酚羟基也会以酚氧离子的形式存在,与丹皮酚的酚氧离子产生竞争,导致副产物增多,影响目标化合物的产率,增大后处理的难度。本文也曾按照该反应路线进行尝试,结果如上述分析相近,第二步反应杂点多,后处理难度较大,且产率很低。后续按图1中路线进行反应,即先将丹皮酚与二溴烷烃反应,再与大黄酸偶联,发现反应能顺利进行。在实验过程中,本文对第二步的反应物配比进行了优化,得到最佳反应物配比为:大黄酸∶丹皮酚溴代烷基醚=1.5∶1.0,n∶n,在此条件下能以较高的产率(46.3%~51.3%)得到目标化合物。

图2 目标化合物3a~3e的原合成设计路线
2.2 目标化合物的溶解性分析
由于大黄酸在水中不溶,在乙醇、丙酮、乙酸乙酯和二氯甲烷等有机溶剂中极难溶解(<0.5 mg/mL),会在一定程度上影响其药效的发挥。本研究对大黄酸进行修饰的目的之一是改善其溶解性能。为此,对合成的目标化合物进行了简单的溶解性定性实验,发现其在乙醇、丙酮、乙酸乙酯和二氯甲烷等有机溶剂中溶解度均大于10 mg/mL,较大黄酸相比有了很好的改善,但其在水中的溶解度与大黄酸相似,仍小于0.5 mg/mL,可能会对其药效的发挥产生影响,有待进一步的结构修饰和改造。
2.3 体外抗炎活性分析
炎症因子是炎症反应中重要的细胞活性因子,它们对细胞炎症都有直接或间接的作用。IL-1β、IL-6、TNF-α是重要的促炎因子,TNF-α、IL-6和IL-1β的mRNA高表达,导致IL-1β、IL-6、TNF-α等促炎因子释放增加。研究表明:IL-1β已成为治疗全身和局部炎症性疾病的靶标,可通过降低IL-1β活性达到治疗效果[19]。TNF-α是一个经典的炎症指标,表达量的多少可以直接反映炎症的严重程度[20]。IL-6具有抗炎和致炎的双向作用[21]。为检测所得目标化合物是否具有抗炎作用,本研究以LPS刺激小鼠巨噬细胞RAW264.7构建体外炎症模型,采用实时荧光定量PCR检测目标化合物对炎性因子TNF-α,IL-1β和IL-6 mRNA表达的影响。结果表明(表1):20 μg/mL浓度下3a~3e均可下调炎症因子TNF-α,IL-1β和IL-6 mRNA表达,尤其对IL-1β的mRNA表达影响明显。其中,化合物3c、3d和3e下调TNF-α、IL-1β和IL-6的mRNA表达作用强于化合物3a和3b,尤其以3d作用最为显著。研究结果表明,目标化合物可减轻LPS诱导的RAW264.7细胞炎症反应。
3 结论
本论文利用拼合原理,以不同碳数的烷烃链为连接臂,将均具有抗炎作用的大黄酸和丹皮酚偶联,得到相应的大黄酸丹皮酚偶联物(3a~3e),其结构经1H NMR、13C NMR和HR-MS(ESI)表征。采用LPS刺激巨噬细胞(RAW264.7)构建细胞炎症模型,荧光定量PCR检测炎性因子TNF-α,IL-1β和IL-6的mRNA表达。结果显示,目标化合物能够抑制LPS诱导的炎症因子的表达,尤其以3d的作用最佳,在抗炎活性方面具有一定的开发潜力。在实验过程中,本文发现目标化合物在乙醇等有机溶剂中具有较好的溶解性能(优于大黄酸),但在水中的溶解度仍然很低,有待进一步的结构修饰和改造。

