Aβ1-42诱导的阿尔茨海默病细胞模型中神经损伤及凋亡的机制
王昱驰,马宏玉,王振宇,张少轩,张育泰,高宇航,孙嘉伟(石河子大学医学院基础医学系病理生理学教研室,石河子 832002;通讯作者,E-mail:jiaweisun01@163.com)
AD是老龄化人口中普遍存在的一种进行性神经系统退行性疾病,主要以脑皮质与海马神经元丢失、β-淀粉样蛋白(Aβ)沉积和Tau蛋白磷酸化(p-Tau)引起的神经纤维缠结为特征,其临床表现为进行性认知功能障碍和记忆力损害[3-5]。AD可导致神经元细胞的广泛凋亡,但其具体致病机制至今仍不明确[6]。已知细胞凋亡中最主要的病理性生化事件为半胱天冬酶(cysteiny laspartate specific proteinase,CASP)级联反应的激活,且半胱氨酸酶-3(Caspase-3)是细胞凋亡过程中最主要的终末剪切酶,研究表明在AD患者的样本中检测到其水平的改变[7]。早期AD中常见的病理变化为神经元突触素(synapsin,SYP)、维持微管稳定的蛋白(microtubule associated protein 2,MAP-2)的降低导致突触处于不稳定状态甚至损伤,以及淀粉样蛋白(amyloid β,Aβ)不受控制的寡聚化和聚集造成的神经元细胞凋亡[8]。故我们选择Caspase-3、SYP、MAP-2作为鉴别AD神经元的蛋白指标。此外,神经突蛋白1(Neuritin 1,NRN1)是一种与神经发育和神经可塑性密切相关的营养因子,对损伤神经元具有一定的修复作用[9],其在神经元中的表达具有一定的积极意义。
Aβ来自于其前体淀粉样蛋白前体蛋白(amyloid precursor protein,APP)第672~711残基裂解片段。有研究表明,Aβ1-42是AD患者脑中主要的淀粉样蛋白沉积物,且Aβ1-42是Aβ中传播性最强的亚型[10,11]。据报道,过多的Aβ可直接或间接通过影响线粒体的结构或者功能进而诱发氧化应激、激活凋亡信号通路等级联反应,导致大量的神经元细胞损伤[12]。因此,结合Aβ的作用结果以及AD的病理特征,我们选择Aβ1-42来诱导AD细胞模型的建立。
目前治疗AD药物的研发进展缓慢,AD预防和治疗依然是相关研究领域的热点[2]。已有的细胞模型缺乏对凋亡机制的预测和研究,因此建立适宜的AD细胞模型,有利于进一步研究AD发病机制及其预防和治疗方法。本实验拟通过Aβ1-42诱导小鼠海马神经元细胞HT22建立AD细胞模型,并通过生物信息学分析进一步明确Aβ1-42导致细胞凋亡的相关信号通路。
1 材料与方法
1.1 材料与试剂
Aβ1-42寡聚肽购自上海强耀科技有限公司;10%FBS和0.25%Trypsin-EDTA购自美国Thermo Fisher公司;DMEM培养基购自美国HyClone公司;0.01 mol/L PBS购自美国Sangon公司;Triton X-100购自加拿大Biosharp公司;BSA购自德国VETEC公司;PVDF膜购自美国Immobilon公司;RIPA裂解液、10%SDS、SDS-PAGE电泳液、CCK-8试剂盒、BCA蛋白浓度测定试剂盒均购自上海碧云天生物技术有限公司;cleaved-Caspase-3抗体、Caspase-3抗体、ERK抗体、p-ERK抗体均购自美国CST公司;MAP-2抗体、SYP抗体和NRN1抗体购自英国abcam公司;β-actin抗体以及山羊抗兔IgG、山羊抗小鼠IgG二抗均购自北京中杉金桥生物技术有限公司。
1.2 设备
生化培养箱购自上海博迅医疗生物仪器股份有限公司;荧光倒置显微镜购自德国ZEISS公司;多功能酶标仪与高速离心机购自美国Thermo Fisher公司;免疫印迹反式半干转仪购自美国Bio-rad公司;全自动化学成像仪购自上海天能生命科学有限公司。
1.3 方法
1.3.1 细胞培养及实验分组 HT22细胞株由黄瑾教授课题组惠赠,使用含10%FBS的DMEM培养基在37 ℃,5%CO2的细胞培养箱中培养,细胞每隔2 d传一代,传代前1 d半量换液,定期观察细胞形态及生长、贴壁情况。将HT22细胞悬液转移至96孔细胞培养板中(100 μL/孔,约5 000个/孔),在细胞培养箱中孵育,待细胞贴壁;使用0.01 mol/L PBS(pH=7.4)溶解Aβ1-42粉末,配制不同浓度的Aβ1-42溶液(0,0.625,1.25,2.5,5,10,20,40 μmol/L),置于-80 ℃冻存,使用前置于37 ℃下老化7 d。分别使用各浓度Aβ1-42溶液干预处于生长对数期的细胞,其中Aβ1-42浓度为0 μmol/L的细胞中仅添加同体积PBS,以便与其他组别形成对照。每个浓度设置5个复孔,2 d后观察细胞形态、检测细胞存活率。每组实验重复3次,确定建立AD细胞模型的最适浓度;随后使用最适浓度干预HT22细胞,分别在6,12,24,48 h后观察细胞形态、检测细胞存活率。每组实验重复3次,确定建立AD细胞模型的最适时间。

1.3.3 AD细胞模型的特征性蛋白鉴定 为明确Aβ1-42干预HT22细胞建立AD细胞模型的有效性,在Aβ1-42干预HT22细胞建立AD细胞模型的最适条件下,将细胞分为AD组(Aβ1-42+PBS)和NC组(PBS)。AD组取已用PBS配制好的20 μmol/L Aβ1-42溶液,NC组取同体积PBS溶液,分别干预处于生长对数期的细胞24 h。提取各组细胞蛋白,使用BCA试剂盒测定各组蛋白浓度,Western blot检测cleaved-Capase-3、SYP、NRN1、MAP-2、ERK蛋白表达情况,免疫荧光检测MAP-2分布情况。一抗分别为anti-cleaved-Caspase-3(1∶1 000)、anti-Caspase-3(1∶1 000)、anti-SYP(1∶5 000)、anti-MAP-2(1∶1 000)、anti-NRN1(1∶1 000)、anti-ERK(1∶1 000)、anti-p-ERK(1∶2 000),4 ℃孵育过夜;TBST洗膜4次,每次8 min,室温下孵育二抗(1∶5 000)2 h,TBST洗膜4次,每次8 min,室温孵育2 h,使用全自动化学成像仪曝光,以anti-β-actin(1∶1 000)作为内参。
样品配制:0.2 mL臭牡丹粗提物溶液(5.0 mg/mL)与0.2 mL DPPH甲醇溶液(25.0 mg/mL)混合均匀,37 °C下避光孵育30 min,直接进行HPLC-QTOF-MS/MS检测.等体积甲醇替代DPPH自由基溶液作为空白对照组.
制作AD组和NC组细胞爬片,使用anti-MAP-2(1∶200)一抗4 ℃孵育过夜;孵育后第2天,室温静置30 min,使用PBS清洗3次,每次5 min;滴加二抗(FITC Goat anti-Rabbit IgG,1∶100),37 ℃孵育30 min。PBS洗3次,每次5 min。使用含DAPI的封片剂封片,避光阴干,荧光倒置镜下观察各组细胞MAP-2荧光分布情况。从滴加二抗开始,全程避光。
1.3.4 生物信息学分析 为探索Aβ、ERK与凋亡三者间可能存在的相关性,在Genecards上检索了Aβ、ERK与Caspase-3相关基因。同时,在美国国家生物信息技术中心(National Center for Biotechnology Information,NCBI)网站GEO Data Sets数据库中(https://www.Ncbi.nlm.nih.gov/gds)以阿尔茨海默病和海马体为指标进行检索,排除表观遗传学的影响,获得了在AD模型海马体CA1中表达的基因数据集(GSE28146)。之后,筛选出数据集中AD样本(n=22),通过boxplot进行箱线图绘制使得数据标准化,使用Spearman相关分析来描述不考虑分布情况的相关基因变量之间的相关性,并通过R软件包pheatmap进行多基因相关性热图的展示,P<0.05被认为差异具有统计学意义。

2 结果
2.1 确定Aβ1-42建立AD细胞模型的最适浓度
2.1.1 不同浓度下细胞形态学变化 倒置显微镜下观察细胞形态,结果显示:正常HT22细胞(Aβ1-42浓度为0时),细胞伸展良好、细胞透亮,神经突明显;随着Aβ1-42浓度梯度的增加,细胞形态变化明显,体积变小,核固缩、细胞碎片明显增多,存活细胞数量明显减少(见图1)。
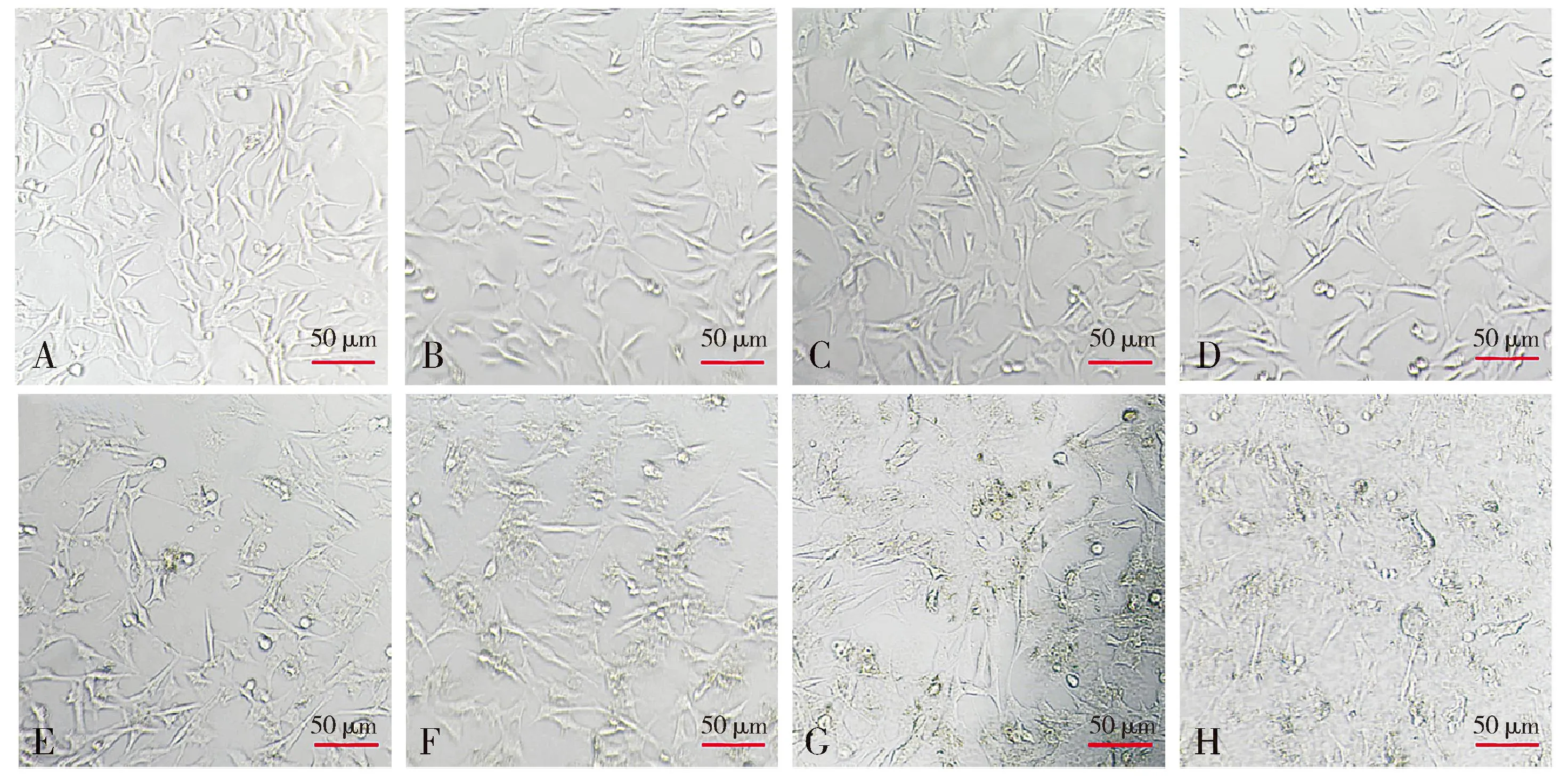
注:A-H.Aβ1-42浓度分别为0,0.625,1.25,2.5,5,10,20,40 μmol/L。图1 不同浓度Aβ1-42干预HT22细胞的形态观察Figure 1 Morphological changes of HT22 cells after intervened with different concentrations of Aβ1-42
2.1.2 不同浓度下细胞存活率变化 CCK-8结果显示,随着Aβ1-42浓度的增加,细胞活性逐渐降低;与正常HT22细胞相比,20 μmol/L Aβ1-42作用后,HT22细胞存活率降低,差异具有统计学意义(P<0.000 1,见图2),且部分存活细胞仍能保持正常细胞的形态。结合形态学观察和存活率检测,选择20 μmol/L作为Aβ1-42干预HT22细胞建立AD细胞模型的最适浓度。
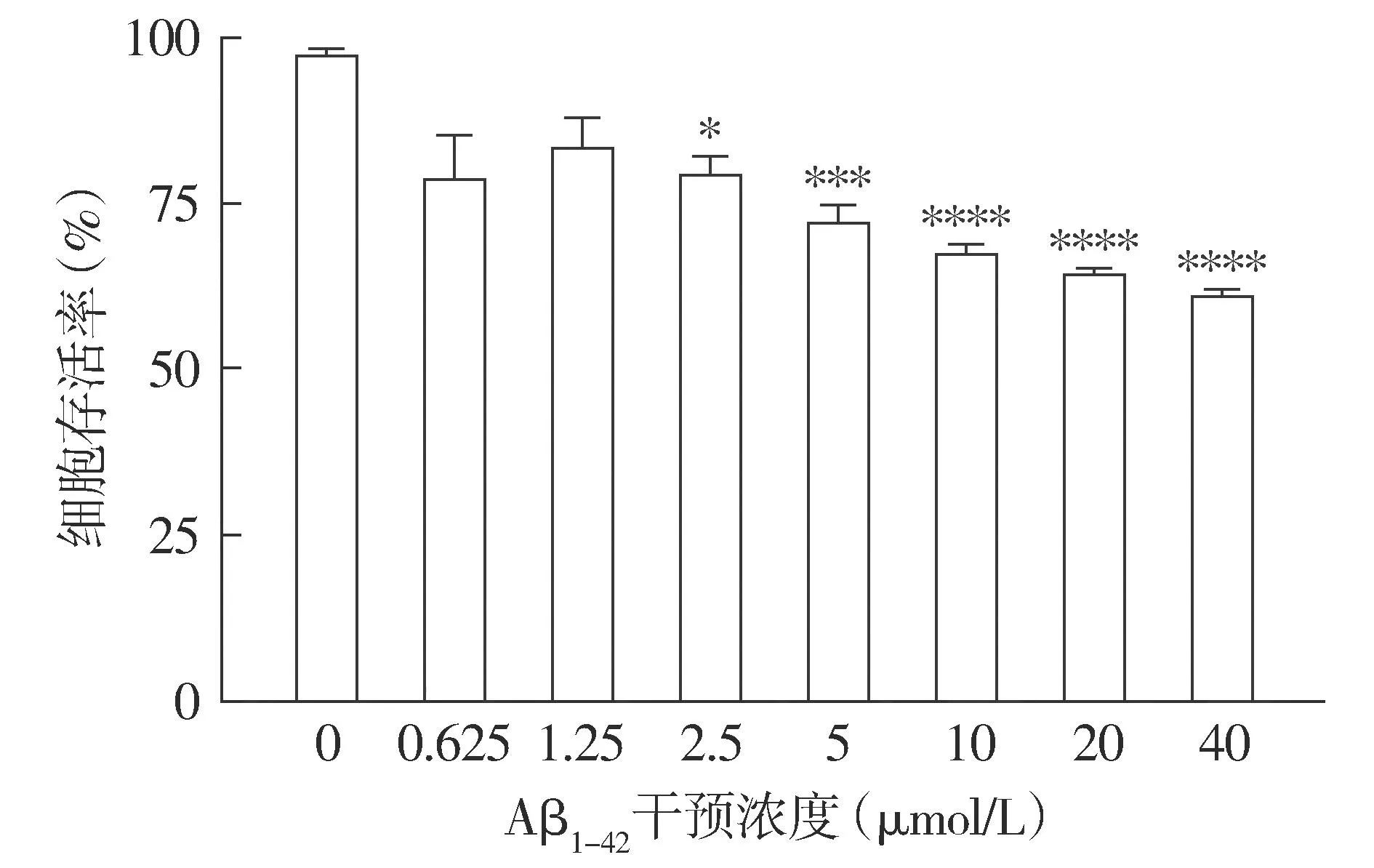
注:与0 μmol/L相比较,*P<0.05,***P<0.001,****P<0.000 1。图2 不同浓度Aβ1-42干预后HT22细胞存活率的变化Figure 2 Viability of HT22 cells after intervened with different concentrations of Aβ1-42
2.2 确定Aβ1-42建立AD细胞模型的最适时间
2.2.1 不同干预时间后细胞形态学变化 根据上述实验,我们使用Aβ1-42的最适浓度20 μmol/L干预HT22细胞,分别在6,12,24,48 h观察各组细胞形态学变化。结果显示:随着干预时间的延长,细胞胞体收缩、变形,细胞膜完整性破坏,细胞外基质杂乱不清,可见较多凋亡、坏死细胞(见图3)。
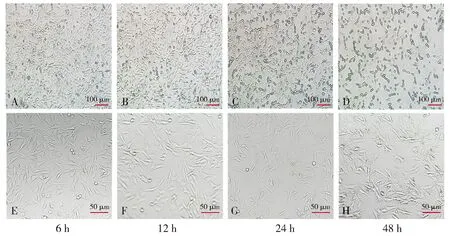
图3 不同时间Aβ1-42干预HT22细胞的形态观察Figure 3 Morphological changes of HT22 cells after Aβ1-42 intervention for different time
2.2.2 不同干预时间后细胞存活率变化 CCK-8结果显示,随着干预时间延长,Aβ1-42对细胞的毒性作用明显增加,细胞活性呈整体降低趋势(见图4);与6 h相比,干预24 h时,细胞存活率降低,差异有统计学意义(P<0.001,见图4),且部分存活细胞仍能保持正常细胞的形态。结合形态学观察和存活率检测,选择24 h作为Aβ1-42干预HT22细胞建立AD细胞模型的最适时间。

注:与6 h相比较,***P<0.001。图4 20 μmol/L Aβ1-42干预不同时间后HT22细胞存活率变化Figure 4 Viability of HT22 cells after intervention with 20 μmol/L Aβ1-42 for different time
2.3 Aβ1-42干预HT22细胞建立AD细胞模型的特征性蛋白鉴定
2.3.1 AD细胞模型的凋亡蛋白及神经营养因子检测 Western blot结果显示,与NC组相比,AD组中cleaved-Caspase-3的表达明显增多,且cleaved-Caspase-3/Caspase-3比值升高(P<0.01,见图5);AD组中NRN1蛋白的表达降低(P<0.000 1,见图5)。

注:与NC组相比较,**P<0.01,****P<0.000 1。图5 Western blot检测Aβ1-42对HT22细胞凋亡及神经营养相关蛋白表达的影响Figure 5 Effect of Aβ1-42 on expressions of apoptosis- and neurotrophic-related proteins in HT22 cells detected by Western blot
2.3.2 AD细胞模型的神经突触生长检测 Western blot结果显示,与NC组相比,AD组SYP蛋白与MAP-2蛋白的表达降低(P<0.01,见图6)。免疫荧光检测各组MAP-2在HT22细胞中的表达及分布情况,结果显示:AD组细胞核周围的MAP-2蛋白含量明显减少(见图7)。
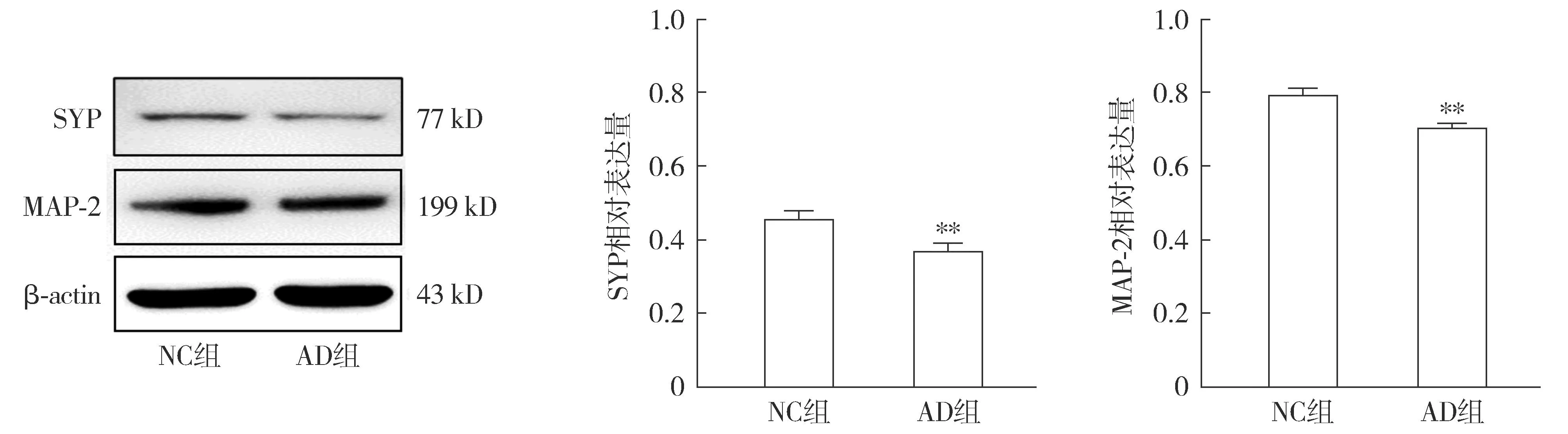
注:与NC组相比较,**P<0.01。图6 Western blot检测Aβ1-42对HT22细胞神经突触生长相关蛋白表达的影响Figure 6 Effects of Aβ1-42 on expressions of synaptic growth-related proteins in HT22 cells detected by Western blot
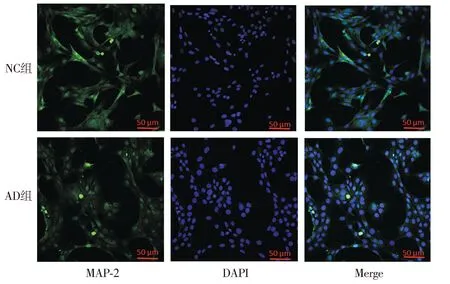
注:MAP-2为绿色荧光(FITC),细胞核为蓝色荧光(DAPI)。图7 AD细胞模型中MAP-2免疫荧光结果Figure 7 Immunofluorescence results of MAP-2 in AD cell models
2.4 AD模型相关信号通路的生物信息学分析及鉴定
2.4.1 AD模型相关信号通路的生物信息学分析 Genecards检索结果示Aβ和ERK1/2蛋白的结构基因为APP、MAPK3、MAPK1;Swiss-Prot数据库结果示Caspase-8,9,10参与凋亡通路的激活,其结构基因分别为CASP8、CASP9、CASP10。相关性分析结果显示:22个AD样本基因表达量基本相同,可认为样本同质(见图8A);MAPK3(ERK1)与APP呈明显正相关(r=0.634,P<0.01),与CASP9(Caspase-3重要的激动剂)呈正相关(r=0.513,P<0.05,见图8B)。

图8 AD模型相关信号通路的生物信息学分析Figure 8 Bioinformatics analysis of signaling pathways associated with AD models
2.4.2 AD细胞模型中ERK信号通路变化的检测 Western blot结果显示,与NC组相比,AD组中p-ERK/ERK比值升高,差异具有统计学意义(P<0.05,见图9)。表明本文建立的AD细胞模型中ERK激活增多,提示ERK信号通路的激活可能与AD进展(Aβ表达增加)相关。
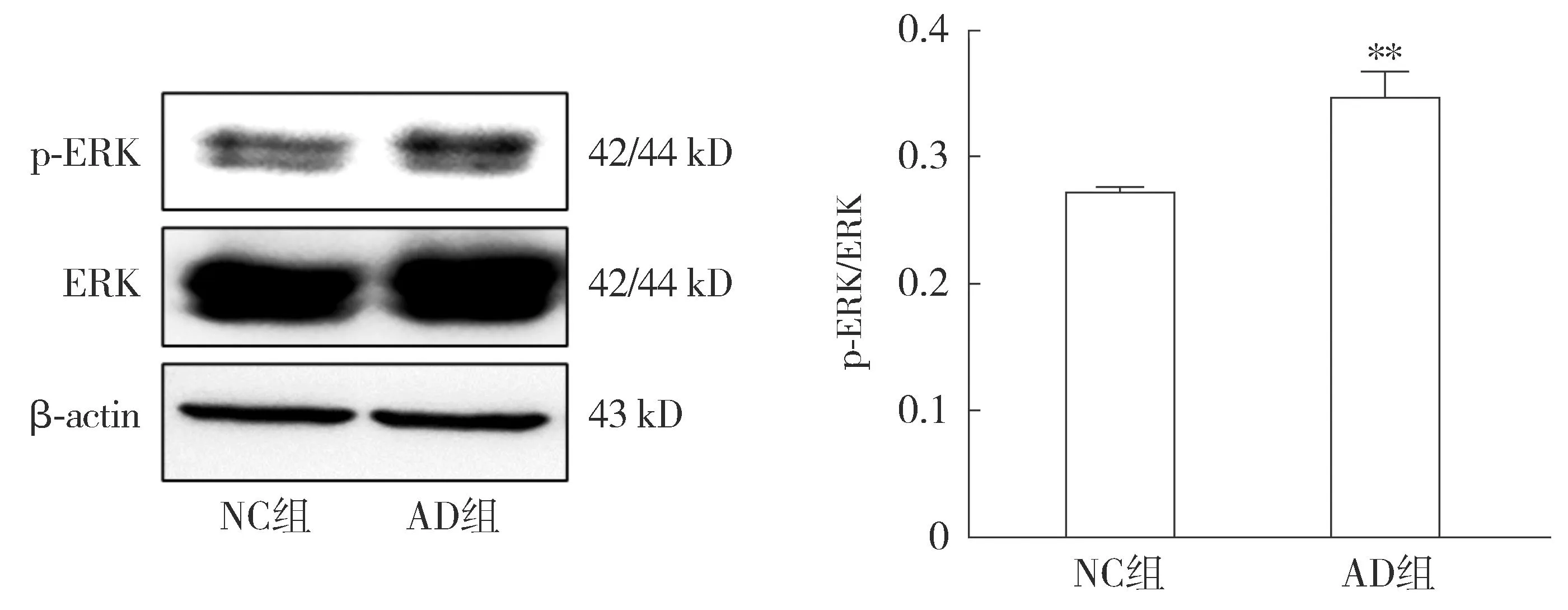
注:与NC组相比较,**P<0.01。图9 Western blot检测Aβ1-42对HT22细胞ERK信号通路相关蛋白表达的影响Figure 9 Effects of Aβ1-42 on the expressions of ERK signaling pathway-related proteins in HT22 cells detected by Western blot
3 讨论
AD是一种常见的神经系统退行性疾病,其核心表现为脑内淀粉样斑块堆积和MAPT/tau神经纤维缠结。Aβ清除失调对于其在大脑内的积聚和斑块的形成具有重要意义[13]。目前的研究仍然无法明确AD疾病发病的确切机制,它的诊断治疗和干预措施也受到限制[14]。关于AD的发病机制,目前提出了淀粉样蛋白学说、细胞凋亡学说、氧化应激学说、钙超载学说、胆碱能学说等多种学说[15,16]。研究表明,AD的发生发展多与神经元丢失、神经元凋亡密切相关[17]。为进一步探索其发生机制,我们建立了适宜的AD细胞模型。
本实验采用不同浓度梯度的Aβ1-42干预HT22细胞,在一定范围内,Aβ1-42浓度和干预时间均与HT22细胞活性整体呈负相关,较高浓度和较长干预时间的Aβ1-42能够更好地诱导HT22细胞分化成AD样细胞。因此,根据细胞存活率以及镜下观察结果得出,当Aβ1-42浓度为20 μmol/L,干预时间为24 h时,能够保证HT22细胞在较高存活率的前提下,在细胞水平上表现出明显的早期AD样特征:神经元结构受损、突触可塑性降低、和部分神经元凋亡。
为确保模型的有效性,本实验通过Western blot和免疫荧光来分析AD组和NC组在细胞凋亡相关蛋白Caspase-3,神经突触生长相关蛋白SYP、MAP-2,神经营养因子NRN1的表达差异。结果显示:与NC组相比,AD组凋亡活化指标cleaved-Caspase-3蛋白表达升高,神经营养因子NRN1表达降低,神经元结构相关指标SYP、MAP-2蛋白表达降低。上述结果表明AD组细胞凋亡增多、神经元结构受损、突触稳定性下降。这与AD早期病理变化特征相一致,提示Aβ1-42对HT22细胞具有明显的毒性作用。以上实验证明我们所建立的AD细胞在蛋白水平上具有较典型的AD样特征,即可认为Aβ1-42干预浓度和时间分别为20 μmol/L和24 h,为较理想的AD建模条件。
大量证据表明,神经元的丢失与多种信号通路的相互作用密切相关[18-21]。即AD退行性进展与其信号通路的改变有关。细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)信号通路是经典MAPK信号通路成员之一,其成员包括ERK1和ERK2,分子量分别为44 kD和42 kD[22]。有研究发现,ERK在中枢神经系统中对神经细胞增殖和分化、突触可塑性、学习记忆能力和轴突生长等具有重要意义[23]。据报道,ERK主要存在神经元细胞的轴突、树突中,其通路激活(即ERK磷酸化)可以将刺激信号传导到细胞核内,且ERK信号通路参与了AD的病理发展过程,在APP的加工过程中发挥重要作用[24]。Pak等[20]和Hong等[21]最新研究发现,ERK(正常调控范围下)能激活细胞外信号调节激酶(cAMP)反应元件结合蛋白信号通路(ERK/CREB),进而激活Ras-MAPK通路促进神经元生长再生。另外,Sun等[22]的研究表明,ERK信号通路激活能增加α-分泌酶的活性,进而促进可溶性APPα释放,减少Aβ的产生和沉积。
为探讨Aβ1-42导致HT22分化及凋亡的机制,我们通过分析ERK与Aβ及凋亡基因的相关性来分析可能的靶向信号通路,结果显示:在基因组水平上,ERK与APP,CASP9表达呈正相关。而Caspase-9为Caspase-3的激动剂,可以通过促进Caspase-3剪切成cleaved-Caspase-3激活细胞凋亡机制。据报道,分子层面上,Aβ斑块可刺激促进神经元中与细胞周期进展相关的因子的异常表达,从而导致Caspase-3激活增加,促进神经元凋亡[25]。为进一步明确Aβ、ERK与凋亡的相关性,我们通过Western blot发现AD组ERK磷酸化比例增高,即ERK信号通路处于高激活状态。现有研究报道,AD细胞中多个信号通路共同作用,具体表现为:Ras-ERK信号通路参与细胞周期和凋亡的进展、JNK信号通路与抗凋亡蛋白表达呈负相关、ERK信号通路磷酸化与不可溶性蛋白沉积密切相关、JAK-STAT信号通路增强Caspase-3介导的神经变性[4,26]。因此,我们推测Aβ1-42可能增强Ras-ERK信号级联,而ERK信号通路很可能为Aβ1-42导致HT22细胞凋亡、阻滞细胞分裂,分化为AD细胞的靶向通路之一。
结合众多研究,我们认为ERK通路对AD进展可能具有轻度抑制作用。但由于AD病程不可逆性的加剧,APP基因调控生成Aβ斑块的能力可能大于ERK通路清除Aβ斑块的能力,故ERK在一定程度上可能延缓AD进展,但并不能逆转AD进程。因此我们推测:AD病程不可逆性的加剧可能与ERK通路磷酸化程度有关,即p-ERK/ERK比值。然而,ERK是否在AD进程中发挥抑制作用,以及ERK在AD进程中发挥作用的具体机制仍未完全阐明。因此,未来我们将把更多精力投入在AD细胞模型中ERK信号通路相关蛋白的监测上,以期通过荧光显微镜技术等标记信号分子和细胞结构,通过活细胞成像实时观察信号分子的动态变化。
综上所述,在Aβ1-42浓度为20 μmol/L,干预时间为24 h的培养条件下,HT22细胞表现出较明显的AD病理特征,可以认为是较理想的AD细胞建模条件。同时,本实验利用生物信息学的技术,分析并验证Aβ1-42导致神经损伤及细胞凋亡的候选靶向信号通路之一是ERK,继而为探索AD的发病机制提供新的思路,对于在细胞水平和分子水平上研究AD的发病机制提供科学依据。

