补肺纳肾丸治疗慢性阻塞性肺疾病大鼠的效果及对肺组织ERK 1/2的影响
闫文瑞, 张常喜, 平昕翀, 赵思超
(1.宁夏医科大学中医学院,银川 750004; 2.宁夏回族自治区中医医院暨中医研究院,银川 750021; 3.甘肃中医药大学,兰州 730000)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是以气道炎症及持续气流受限为主要特征的呼吸系统疾病,病变累及气道、肺实质、肺血管;病情进展呈持续性,且病程迁延反复,发病率及病残病死率均逐年增高[1],也是全球呼吸系统慢性疾病的主要死亡原因之一[2]。现代医学治疗COPD 的疗效肯定,但仍然存在诸多局限性[3-4]。长期使用激素类药物可出现如耐药性、胃肠功能紊乱等情况。本课题组采用补肺纳肾丸(bufeinashen pills,BFNSP)复方制剂防治COPD 及肺相关疾病,发现BFNSP 不仅可以改善COPD 患者临床症状、提高患者生活质量,还可改善肺功能,降低炎性因子白细胞介素-6(IL-6)、白细胞介素-8(IL-8)的表达[5-6]。香烟烟雾是COPD 发展的主要危险因素[7],且烟雾会导致肺部明显的慢性炎症,增加炎性介质的释放,如白细胞介素-1β(IL-1β)、肿瘤坏死因子-α(tumor necrosis factor,TNF-α)等[8]。同时有研究[9]显示,炎性细胞因子是加快COPD 患者病情进展的重要因素,如IL-1β 在COPD 患者中的水平明显升高,加重肺部炎症的发展。COPD 病理生理学改变是外周气道炎症及结构改变致气道狭窄的相互作用过程[10],细胞外信号调节激酶(ERK)是丝裂原活化蛋白激酶(MAPKs)之一,是包括炎症反应在内的细胞转录活性的重要介质[11],烟雾暴露(cigarette smoke,CS)激活ERK,在慢性气道炎症中起重要作用[12-13]。有研究[14]表明,ERK 1/2 在COPD 模型大鼠中广泛表达。本研究通过观察不同浓度的BFNSP 对COPD 大鼠模型干预效果及对肺组织中ERK 1/2 蛋白的活化情况及炎性因子IL-1β 的变化,以期为BFNSP 防治COPD 的临床实践提供实验依据。
1 材料与方法
1.1 动物
SPF 级雄性SD 大鼠38 只,10~12 周龄,体质量(200±20)g,购于成都达硕实验动物有限公司,生产许可证号SCXK(川)2020-030;大鼠饲养造模及灌胃于四川大学华西医院科技武侯区科园四路1 号的动物房内。大鼠自由进食、饮水,温度20~26 ℃,相对湿度45%~75%,适应性喂养1周后进行实验。动物实验经四川大学华西医院实验动物伦理委员会批准(批准号:20230625001)。后续大鼠组织实验于宁夏回族自治区中医医院进行。
1.2 药物与试剂
BFNSP(黄芪、肉苁蓉、细辛、蝉蜕、防风、续断、白术、荆芥穗、紫苏叶、党参、紫苏子、益智仁、瓜蒌、葶苈子、地龙、全蝎等)购于宁夏回族自治区中医医院暨中医研究院(规格:60 g/瓶),分别制备0.125 g·mL-1、0.25 g·mL-1、0.5 g·mL-1的药液,4 ℃保存备用;脂多糖(Lipopolysaccharide,LPS)(批号:517 L031,规格10 mg/瓶,北京索莱宝科技有限公司);地塞米松片(批号:LB21135,浙江仙琚制药股份有限公司)。
苏木素染色液(G1004X,武汉赛维尔生物科技有限公司);伊红染色液(YE2080,合肥博美生物科技有限责任公司);盐酸(7647-01-0,成都市科隆化学品有限公司);Rat IL-1β ELISA 试剂盒(ZC-36391,上海茁彩生物科技有限公司);BCA蛋白含量检测试剂盒(P0009,上海碧云天生物技术股份有限公司);细胞裂解液(P0013;上海碧云天生物技术股份有限公司);P-ERK 1/2 抗体(AP0974X,美国ABclonal 生物科技有限公司);鼠抗β-actin(AC026,美国ABclonal 生物科技有限公司);Goat Anti-Rabbit IgG(H+L)HRP(S0001,美国affbiotech 公司);Molpure®Cell/Tissue Total RNA Ki[t19221ES50,翌圣生物科技(上海)股份有限公司];PrimeScriptTMRT reagent Ki[tRR047A,宝日医生物技术(北京)有限公司];TB Green®Premix Ex TaqTMⅡ(Tli RNaseH Plus)[RR820A,宝日医生物技术(北京)有限公司]。
1.3 仪器
组织石蜡包埋机(BMJ-A,常州市郊区中威电子仪器厂)、轮转式石蜡切片机(徕卡-2016,德国徕卡公司);数字切片扫描仪(Pannoramic 250,3DHISTECH 公司);酶标仪(SpectraMAX Plus384,上海美谷分子仪器有限公司);实时荧光定量(RT-PCR)仪(QuantStudioTM3,美国Thermo Fisher 科技公司);垂直电泳槽(JY-SCZ4+,北京君意东方电泳设备有限公司);荧光图像分析系统(5200 Multi,上海天能科技有限公司)。
1.4 COPD 大鼠模型的构造
除对照组外,其余大鼠采用香烟烟熏法(烟碱量15 mg,尼古丁量1.0 mg,一氧化碳量13 mg)联合LPS 制备大鼠COPD 模型。在造模期的第1、14、28 天对大鼠进行麻醉,当日不熏蒸,在气道内滴注LPS 溶液(1 mg·kg-1);在第2~13、15~27、29~49 天将大鼠置于自制染毒箱被动吸烟,每次吸30 支香烟,每次30 min,2 次/d,两次间隔时间12 h,共49 d。同时对照组大鼠在熏蒸箱中呼吸正常空气,并于麻醉后第1、14、28 天用生理盐水0.2 mL 代替LPS 溶液滴入气道。期间,观察大鼠呼吸状态、毛发、进食情况、活动度等;第50天,随机解剖2 只大鼠进行肺组织病理观察,显示COPD 建模成功。
1.5 分组及给药
将38 只大鼠按随机数表法分为对照组(6只)、COPD 组(8 只)、BFNSP 高剂量(BFNSP-H)组(6 只)、BFNSP 中剂量(BFNSP-M)组(6 只)、BFNSP 低剂量(BFNSP-L)组(6 只)、地塞米松组(6 只)。随机选取COPD 组2 只大鼠解剖进行肺组织病理观察,显示COPD 建模成功后,中药给药剂量按照成人日用量与裸鼠体表面积折算成等效剂量,对照组(6 只)和COPD 组(6 只)灌胃生理盐水2 mL/次,1 次/d;BFNSP-H 组(6 只)灌胃(0.5 mL/100 g)、BFNSP-M 组(6 只)灌胃(0.25 mL/100 g)、BFNSP-L 组(6 只)灌胃(0.125 mL/100 g),1 次/d,地塞米松组(6 只)灌胃(0.02 mL/100 g),1 次/d;各组大鼠均连续给药8 周。
1.6 HE 染色观察大鼠肺组织病理学变化
灌胃给药结束24 h 后,取肺脏组织以4%多聚甲醛固定24 h,经脱水、浸蜡、包埋、切片、展片、捞片、烤片后,进行苏木精和伊红染色,封片,在光镜下观察肺组织病理学变化。
1.7 酶联免疫吸附试验测定大鼠气管肺泡灌洗液中IL-1β 水平
将大鼠安乐处死,软管气管插管后,5 μL 预冷PBS 灌洗,重复3 次,收集其支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF),采用酶联免疫吸附试验测定BALF 中IL-1β 水平,操作过程严格按照试剂盒说明进行。
1.8 免疫印迹法检测大鼠肺组织中P-ERK 1/2蛋白表达
肺组织样本在预冷的RIPA 裂解液中均质,提取总蛋白,使用BCA 试剂盒进行蛋白定量,并在95 ℃条件下变性5 min。通过SDS-PAGE 凝胶电泳分离蛋白质,转膜,封闭,4 ℃条件下用特异性抗体P-ERK 1/2(1∶2 000)及内参β-actin(1∶50 000)孵育过夜。1×TBST 洗膜3 次,每次10 min。加入山羊抗兔IgG(H+L)HRP(1∶50 000)二抗,室温孵育2 h。1×TBST 洗涤后,最后ECL化学发光液显影,Image J 8.0 软件测定条带灰度值,β-actin 作为内参蛋白。
1.9 RT-qPCR 检测大鼠肺组织中ERK 1/2 mR-NA 表达
取-80 ℃保存肺组织标本,用Trizol 试剂提取组织总RNA,反转录合成cDNA。PCR 反应参数:95 ℃预变性30 s,95 ℃变性5 s,55 ℃退火30 s,72 ℃反应30 s,45 个循环。使用Thermo Scientific PikoReal 软件对实验过程中样品的CT值进行PCR 结果分析,以β-actin 为内参,并使用2-ΔΔCt计算mRNA 的相对表达。ERK 1/2 引物由Sangon Biotech 设计合成。引物序列见表1。
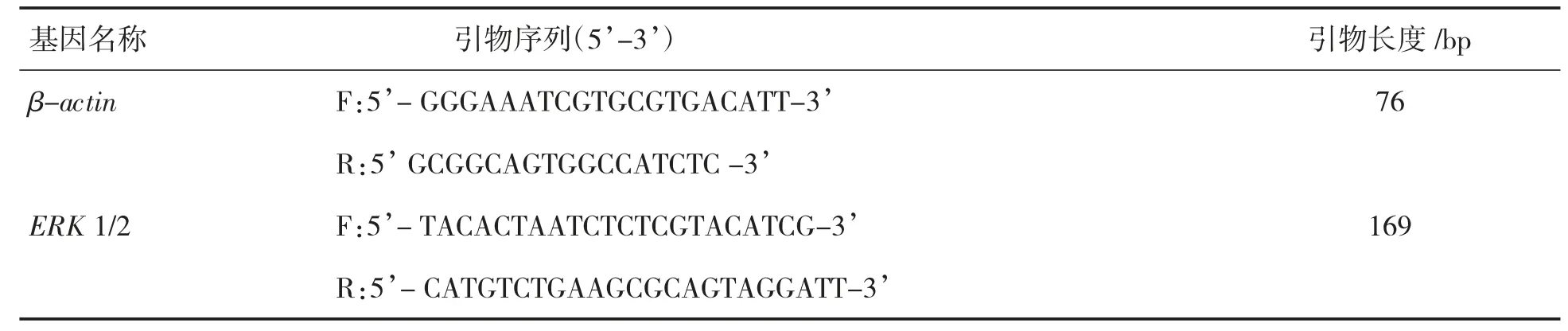
表1 各基因PCR 引物序列
1.10 统计学方法
数据采用SPSS 26.0 软件进行统计分析,对数据进行正态性及方差齐性检验,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD 法。P≤0.05 为差异有统计学意义。
2 结果
2.1 动物一般状况
大鼠共38 只,实验过程中,除确认造模随机处死2 只COPD 大鼠外,其余各组大鼠均无死亡。实验结束时,对照组大鼠精神状态良好,发育正常,无咳喘等表现;其余各组大鼠均有不同程度精神差、活动性差、饮食差、被毛脱落、咳嗽、呼吸急促、打喷嚏、鼻腔分泌物增多等表现。经药物干预后,BFNSP-L 组、BFNSP-M 组、BFNSP-H 组及地塞米松组大鼠症状逐渐减轻,精神及活动状态等较COPD 组明显改善。
2.2 BFNSP 减轻COPD 大鼠肺组织病理损伤
对照组肺脏组织表面被覆浆膜,未见明显水肿、炎性浸润或纤维结缔组织增生;各级支气管结构完整清晰,支气管上皮细胞形态正常,无明显变性、坏死或脱落;肺泡上皮细胞形态较为正常,未见明显变性、坏死,间质未见明显炎性细胞浸润及纤维组织增生。COPD 组少量肺泡上皮细胞脱落于肺泡腔内,见少量肺泡上皮细胞变性、坏死,坏死细胞胞质溶解,胞核固缩崩解,亦见不同程度的肺泡腔扩张,肺泡腔体积扩大,肺泡隔断裂,周围肺泡腔被挤压、皱缩;间质内见不同程度炎性细胞浸润,主要为分叶核或杆状核的中性粒细胞,并伴有极少量纤维组织增生,可见核呈长椭圆形的成纤维细胞,见组织内血管瘀血,可见红细胞蓄积。BFNSP 低中高剂量组、地塞米松组病理改变较模型组均有不同程度的改善,在不同浓度BFNSP 处理组中,以高剂量组肺组织病理改善最为明显,见图1。

图1 BFNSP 减轻COPD 大鼠肺组织损伤(HE×200)
2.3 BFNSP 降低COPD 大鼠支气管BALF 中IL-1β 含量
与对照组比较,COPD 组大鼠肺泡灌洗液中IL-1β 含量升高(P<0.05)。与COPD 组比较,BFNSP-L 组、BFNSP-M 组、地塞米松组、BFNSP-H组大鼠肺泡灌洗液中IL-1β 含量依次降低(P 均<0.05);BFNSP-H 组肺泡灌洗液中IL-1β 含量较地塞米松组降低(P<0.05);BFNSP 不同剂量组内比较,以高剂量组肺泡灌洗液中IL-1β 含量降低最明显(P<0.05),见表2。
表2 ELISA 检测BFNSP 对COPD 大鼠支气管BALF 中IL-1β 含量的影响(±s)
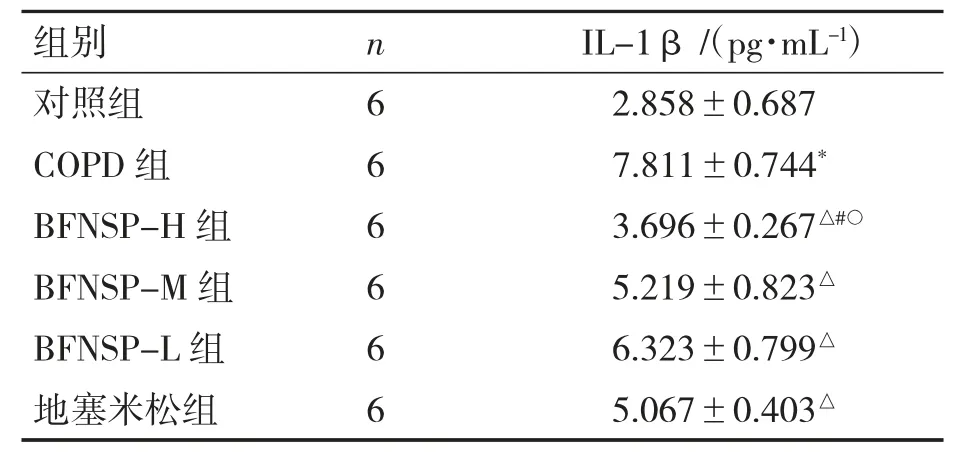
表2 ELISA 检测BFNSP 对COPD 大鼠支气管BALF 中IL-1β 含量的影响(±s)
与对照组比较*P<0.05;与COPD 组比较△P<0.05;与地塞米松组比较#P<0.05;与BFNSP-L 组比较○P<0.05。
组别nIL-1β/(pg·mL-1)对照组62.858±0.687 COPD 组67.811±0.744*BFNSP-H 组63.696±0.267△#○BFNSP-M 组65.219±0.823△BFNSP-L 组66.323±0.799△地塞米松组65.067±0.403△
2.4 免疫印迹检测BFNSP 对COPD 大鼠肺组织中P-ERK 1/2 的表达
与对照组比较,COPD 组肺组织中P-ERK 1/2 表达升高(P<0.05);与COPD 组比较,BFNSP-L组、BFNSP-M 组、地塞米松组、BFNSP-H 组大鼠肺组织中P-ERK 1/2 表达依次降低(P 均<0.05);且BFNSP-H 组肺组织中P-ERK 1/2 表达较地塞米松组降低(P<0.05);BFNSP 不同剂量组内比较,以高剂量组肺组织中P-ERK 1/2 表达降低最明显(P<0.05)。见图2、表3。

图2 免疫印迹法检测BFNSP 对COPD 大鼠P-ERK 1/2 表达的影响(n=3)
表3 BFNSP 对COPD 大鼠肺组织中P-ERK 1/2 相对表达量的影响(±s)
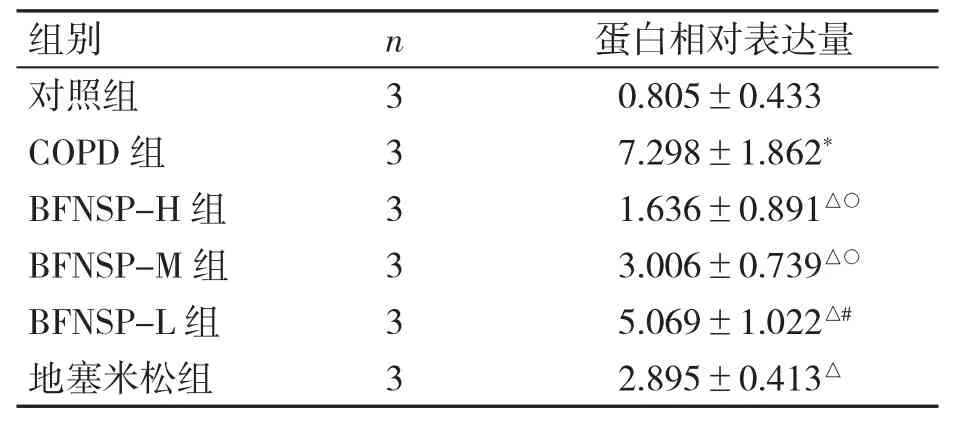
表3 BFNSP 对COPD 大鼠肺组织中P-ERK 1/2 相对表达量的影响(±s)
与对照组比较,*P<0.05;与COPD 组比较,△P<0.05;与地塞米松组比较,#P<0.05;与BFNSP-L 组比较,○P<0.05。
组别n蛋白相对表达量对照组30.805±0.433 COPD 组37.298±1.862*BFNSP-H 组31.636±0.891△○BFNSP-M 组33.006±0.739△○BFNSP-L 组35.069±1.022△#地塞米松组32.895±0.413△
2.5 RT-qPCR 检测BFNSP 对COPD 大鼠肺组织中ERK 1/2 mRNA 表达量的影响
与对照组比较,COPD 组肺组织中ERK 1/2 mRNA 表达量升高(P<0.05);与COPD 组比较,BFNSP 高、中剂量组及地塞米松组肺组织中ERK 1/2 mRNA 表达量均降低(P 均<0.05);与地塞米松组比较,BFNSP-H 组肺组织中ERK 1/2 mRNA 表达量明显降低(P<0.05);不同浓度BFNSP组内比较,以BFNSP-H 组肺组织中ERK 1/2 mRNA 表达量降低最明显(P<0.05),见表4。
表4 BFNSP 对COPD 大鼠肺组织中ERK 1/2 mRNA表达量的影响(±s)

表4 BFNSP 对COPD 大鼠肺组织中ERK 1/2 mRNA表达量的影响(±s)
与对照组比较*P<0.05;与COPD 组比较△P<0.05;与地塞米松组比较#P<0.05;与BFNSP-L 组比较○P<0.05。
组别nERK 1/2 mRNA 表达量对照组30.730±0.242 COPD 组38.446±0.787*BFNSP-H 组31.466±0.151△#○BFNSP-M 组36.237±3.794△BFNSP-L 组34.920±0.582地塞米松组34.238±3.147△
3 讨论
COPD 是慢性呼吸系统疾病,慢性气道炎症和气道重塑是COPD 的重要表现,且气道重塑是COPD肺部病理核心[15],尤其在小气道(内径<2 mm)更为明显[16];由于COPD 患者长期反复受气道炎症刺激,引起气道损伤后非正常修复,导致一系列气道壁、结构壁改变等病理状态,包括气道上皮细胞增生、网状基底膜(RBM)增厚、胶原蛋白沉积、气道上皮间质转化、支气管平滑肌增厚纤维化等病理改变[17]。这与多种细胞因子及细胞信号通路存在密切关系。目前认为,COPD 发病机制与气道炎症[18]、上皮间质转化[19]、蛋白酶—抗蛋白酶失衡[20]、氧化应激等有关[21]。吸烟被公认为是导致COPD 发展的重要危险因素[22],同时大量烟雾刺激气道促炎细胞因子的募集(如IL-1β),研究显示[18],IL-1β 在COPD 大鼠血清中水平增高,IL-1β 可刺激单核细胞和巨噬细胞介导对中性粒细胞的趋化,也可诱导内皮细胞活化直接参与炎性反应,由此发生呼吸道反复炎症并加重气道阻塞[23-24];从本研究各组大鼠的一般情况及组织病理形态可以看出,COPD 造模大鼠在模型制备期间出现咳嗽、打喷嚏、气喘、鼻腔分泌物增多、精神状态差等症状,与患者临床表现一致,且HE 染色结果发现,COPD 大鼠的支气管壁存在大量炎性细胞,肺泡腔扩大融合,与慢性阻塞性肺疾病的主要病理特征相似,证明本研究模型制备成功。同时,COPD 大鼠模型BALFIL-1β 含量升高,且不同浓度BFNSP 干预组能显著下调COPD 大鼠中IL-1β 的含量,说明BFNSP 能够缓解COPD 大鼠模型中性粒细胞的聚集,从而抑制相关炎性因子的释放,减轻炎症反应,缓解COPD进展。结合本实验HE 染色病理结果,不同浓度BFNSP 药物组及地塞米松组大鼠肺组织形态等各方面均较COPD 组大鼠明显改善,BFNSP-H组肺组织中IL-1β 含量较地塞米松组降低明显,且BFNSP 高、中、低剂量组内比较,高剂量组降低显著。这提示BFNSP 可能在慢性阻塞性肺疾病的治疗过程中具有积极的意义。
细胞外调节蛋白激酶是MAPKs 信号通路的关键调控因子,ERK 的上游蛋白会磷酸化ERK,活化后的P-ERK 作用于细胞质内多种信号分子,同时也会进入细胞核,进而作用于转录因子,对基因表达进行调控[25],促进细胞增殖、分化、凋亡等过程[26],同时也参与炎性反应的调控,可以促进炎性细胞因子和趋化因子的释放[27]。ERK 信号通路可被多种炎性介质激活,包括CS[28]。研究[29-30]表明,在COPD 病程进展中,ERK 激活产生促炎性细胞因子,如TNF-α、IL-1β、IL-6 等,加重肺部炎症。也有研究[31-32]表明,ERK 在气道平滑肌细胞中广泛表达,参与COPD 细胞增殖与气道重塑。有报道[33]显示,香烟提取物可通过P-ERK 1/2 上调线粒体自噬及溶酶体活性,进而诱导气道平滑肌细胞增殖恶化,导致COPD 支气管的组织损失和结构重塑。有研究[34]表明,HDAC6 可通过抑制ERK 1/2 表达发挥抑制胶原合成及COPD 患者气道和血管重塑的支气管平滑肌细胞和肺动脉平滑肌细胞增殖。本研究的Western blot 及RT-qPCR 结果显示,COPD 大鼠肺组织中ERK 1/2 mRNA 表达增加,ERK 1/2 蛋白被激活,P-ERK 1/2 增加,经过不同浓度BFNSP 中药干预后,肺组织中ERK 1/2 mRNA 表达及ERK 1/2 磷酸化可被抑制,与西药地塞米松组比较,BFNSP-H 组肺组织中ERK 1/2 mRNA表达及ERK 1/2 磷酸化表达降低,BFNSP 高、中、低剂量组内比较,以BFNSP-H 组作用最佳。
中医学根据反复咳、痰、喘的临床特点,COPD 多属中医肺胀、喘证等范畴。《灵枢·胀论》日:“肺胀者,虚满而喘咳”。中医学认为肺主肃降,其认为本病多因长期反复咳喘气逆发作,久病肺虚在此基础上,痰、饮、瘀阻为其病理因素,且贯穿疾病始终[35]。肺气虚证是痰瘀互结的基石,痰瘀互结、气道涩滞则是导致肺气受阻不能敛降而成肺胀的基础[36]。以此为依据,研制出宁夏回族自治区中医医院暨中医研究院院内制剂BFNSP,由黄芪、黄精、肉苁蓉、细辛、蝉蜕、防风、续断、白术、荆芥穗、紫苏叶、党参、紫苏子、益智仁、瓜蒌、葶苈子、地龙、全蝎等17 味药物组成。诸味药联合运用,共奏调补肺肾、止咳平喘、化痰祛瘀之效。
综上所述,BFNSP 对COPD 大鼠肺组织形态结构及气道炎症均有一的定改善作用;并可抑制肺组织中ERK 1/2 mRNA 及蛋白表达,其机制可能与ERK 1/2 信号通路有关,但其具体干预机制仍需进一步研究。

