孕前体质量指数与孕期血脂、甲状腺激素的相关性及对妊娠期糖尿病患病的影响
邓丽娟, 雍敏婕, 王 婕, 石勤丽
(银川市妇幼保健院,银川 750001)
妊娠期糖尿病(gestational diabetes mellitus,GDM)是常见于妊娠期的糖代谢紊乱疾病,可发生巨大儿、胎儿宫内窘迫、难产等不良后果[1-2]。孕妇出现妊娠胰岛素抵抗与孕期血清三酰甘油(triglyceride,TG)水平明显升高有关,提示孕期高血脂水平对机体葡萄糖的代谢具有较大影响[3],母体血脂水平可作为GDM 的潜在预测因素。甲状腺功能异常是妊娠期内分泌紊乱的主要发病因素之一,妊娠期甲状腺功能紊乱者GDM 发病率较高。本研究选择适应亚洲人群的体质量指数(BMI)分类标准,探究孕前体质量指数(pBMI)异常与孕期血脂、甲状腺激素水平的相关性及对GDM 发病的影响,以期为GDM 的早期识别及干预提供一定的依据。
1 资料与方法
1.1 临床资料
选择2021 年7 月至2022 年12 月于银川市妇幼保健院就诊的107 例GDM 患者为GDM 组,同期100 例健康妊娠女性为健康对照组。所有患者均完成治疗及随访。纳入标准:GDM 的诊断标准参考《妇产科学(第9 版)》[4];所有患者均为自然受孕,单胎妊娠;在妊娠24~28 周时进行糖脂功能、血清甲状腺水平检测;孕前血脂、血糖水平正常;孕期未接受诱发相关研究指标改变的药物治疗,进行规律产检及饮食指导;所有资料完整。排除标准:神志异常或精神疾病无法配合治疗者;因故无法顺利完成试验者;辅助生殖或多胎妊娠者;合并妊娠高血压、多囊卵巢综合征等其他影响糖脂代谢的疾病者。本项研究已通过医院伦理委员会审查。两组患者一般资料差异均无统计学意义(P 均>0.05),具有可比性,见表1。

表1 两组患者基本资料比较
1.2 方法
1.2.1 孕前体质量及孕前体质量指数 对所有入组者孕前(末次月经)体质量及身高进行记录,根据公式:(BMI)=体质量(kg)/身高(m2),计算(pBMI)。
1.2.2 糖脂代谢指标检测 晨取空腹静脉血5 mL,经低温离心机2 000 r·min-1离心10 min,获得上清液,置于-20 ℃冰箱内待检。应用日立LABOSPECT008AS 全自动生化分析仪进行检测,采用己糖激酶法检测空腹、服糖后1 h 和服糖后2 h血糖;采用三酰甘油测定试剂盒(GPO-PAP)对TG 水平进行检测;采用胆固醇氧化酶法对总胆固醇(total cholesterol,TC)水平进行检测;应用直接法-表面活性剂清除法对低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)水平进行检测;应用选择抑制法对高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)水平进行检测。
1.2.3 血清甲状腺激素检测 采取德国罗氏Cobas 6000C601 全自动电化学发光免疫分析仪对三碘甲状腺原氨酸(triiodothyronine,T3)、游离三碘甲状腺原氨酸(free triiodothyronine,FT3)、甲状腺素(thyroxine,T4)、游离甲状腺素(free thyroxine,FT4)、促甲状腺刺激激素(thyroid stimulating hormone,TSH)水平进行检测,以免疫、发光法进行血清甲状腺激素水平检测。
1.3 观察指标
比较两组患者pBMI、血脂指标、血清甲状腺激素指标水平,分析pBMI 与血脂指标、甲状腺激素指标的相关性,探究pBMI、血脂指标、甲状腺激素指标对GDM 发病的影响。
1.4 统计学方法
数据应用SPSS 23.0 软件进行统计学分析。计量资料以均数±标准差(±s)表示,组间比较采用独立样本t 检验,计数资料以例(率)表示,组间比较采用卡方检验;采用Pearson 相关性进行相关分析,采用Logistic 回归分析进行多因素分析。P≤0.05 为差异有统计学意义。
2 结果
2.1 两组患者pBMI 比较
GDM 组患者pBMI 为(24.36±3.75)kg·m-2,健康对照组为(21.03±2.03)kg·m-2,GDM 组pBMI 高于健康对照组(P<0.05)。与健康对照组相比,GDM 组pBMI<18.5 kg·m-2、18.5 kg·m-2≤pBMI≤23.9 kg·m-2占比较低,pBMI>23.9 kg·m-2占比较高(P 均<0.05),见表2。
2.2 两组血脂指标比较
与健康对照组相比,GDM 组TG、LDL-C 水平较高,HDL-C 水平较低(P 均<0.05),见表3。
表3 两组血脂水平比较(±s,mmol·L-1)
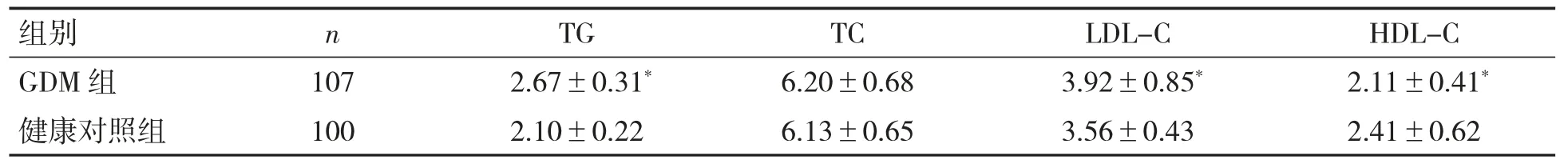
表3 两组血脂水平比较(±s,mmol·L-1)
与健康对照组比较*P<0.05。
组别n GDM 组107 100健康对照组TGTCLDL-CHDL-C 2.67±0.31*6.20±0.683.92±0.85*2.11±0.41*2.10±0.226.13±0.653.56±0.432.41±0.62
2.3 两组血清甲状腺激素指标比较
与健康对照组相比,GDM 组T3、FT4 水平较低(P<0.05),TSH 水平较高(P 均<0.05)。T4、FT3水平两组比较差异无统计学意义(P 均>0.05),见表4。
表4 两组血清甲状腺激素指标比较(±s)

表4 两组血清甲状腺激素指标比较(±s)
与健康对照组比较*P<0.05。
T3/(pmol·L-1)T4/(pmol·L-1)TSH/(μIU·mL-1)FT3/(pmol·L-1)FT4/(pmol·L-1)2.88±0.42*12.25±1.835.53±0.67*4.48±0.589.35±1.79*4.12±0.5612.54±1.742.73±0.344.55±0.5713.38±1.92组别n GDM 组107健康对照组100
2.4 pBMI 与血脂、甲状腺激素指标的相关性分析
经Pearson 相关性分析发现,pBMI 与TG、LDL-C、TSH 水平均呈正相关关系,与HDL-C、T3、FT4 水平呈负相关(P 均<0.05),见表5。

表5 pBMI 与血脂、甲状腺激素指标的相关性分析
2.5 多因素Logistic 回归分析
以GDM 为因变量,以pBMI、TG、LDL-C、HDL-C、T3、TSH 及FT4 水平为自变量,赋值情况见表6。结果显示,pBMI ≥24.0 kg·m-2、TG ≥1.7 mmol·L-1、LDL-C ≥1.55 mmol·L-1、TSH≥4.2 μIU·mL-1、HDL-C <1.9 mmol·L-1、T3 <1.3 nmol·L-1、FT4<12 pmol·L-1均为GDM 发生的危险因素(P 均<0.05),见表7。

表6 自变量赋值情况

表7 pBMI、血脂、甲状腺激素指标影响GDM 发病的多因素Logistic 回归分析
3 讨论
肥胖在GDM 的发生发展中具有重要作用,而BMI 是评估肥胖的可靠指标[5]。孕妇存在胰岛素抵抗可能与血清TG 水平异常增高有紧密关系,孕期高血脂可能会对人体内葡萄糖代谢产生严重影响,孕妇血脂水平可能是GDM 的潜在预测因素[6]。本研究结果显示,GDM 组除pBMI>23.9 kg·m-2外,其他患者占比均较健康对照组低,提示GDM 患者pBMI 较正常妊娠孕妇高。随着pBMI 升高,孕妇机体胰岛素抵抗性增加,使葡萄糖耐受性下降,进一步下调脂肪细胞对胰岛素的敏感度,促使胰岛素分泌增高,诱发胰岛过度损害,导致GDM 发病风险增加[7]。经多因素Logistic 回归分析显示,pBMI 升高为GDM发生的危险因素,提示pBMI 异常与GDM 相关,故需要注意pBMI 异常患者的孕期饮食和规律产检,从而有助于降低GDM 发病率。在血脂与GDM 相关性的研究中发现,与健康对照组相比,GDM 组患者TG、LDL-C 水平较高,HDL-C 水平较低,提示GDM 患者有孕期血脂异常,可能的机制与高血脂水平诱发胰岛β 细胞功能受损,降低胰岛素敏感性有关。高血脂状态能够诱使机体内氧化应激加剧[8],进而导致胰岛素基因表达受到抑制、胰岛素分泌紊乱,产生胰岛素抵抗作用,最终使GDM 发病率上升。此外有研究[9]显示,孕前超重或肥胖会加剧孕妇机体中血脂水平与甲状腺激素水平的的异常改变,进而诱发胰岛素抵抗,最终形成恶性循环。
妊娠期女性下丘脑—垂体—甲状腺轴具有特殊应激反应,能够诱发血清甲状腺激素水平异常波动。妊娠期甲状腺功能异常是常见的妊娠期内分泌疾病。有研究[10]证实,妊娠早、中、晚期FT4呈降低趋势,低体质量儿游离T4 及总T3、T4 水平较低,但目前较少有探讨孕期甲状腺激素水平改变与GDM 发病相关性的研究[11-13]。本研究显示,与健康对照组相比,GDM 组T3、FT4 水平较低,TSH 水平较高,提示GDM 组孕期母体FT3 及FT4 水平较健康组较低,TSH 水平的改变可能是由于妊娠期FT3 及FT4 水平降低,对垂体分泌TSH 产生刺激,进而导致TSH 水平较妊娠升高。但FT4 是否在整个孕期均处于下降趋势需进一步研究。经多因素Logistic 回归分析显示,pBMI、TG、LDL-C、TSH、HDL-C、T3、FT4 均为GDM 发生的影响因素。其可能的原因是,甲状腺激素有增加组织糖利用、加速糖原合成、提高糖代谢速率的作用,致使孕妇孕期存在甲状腺功能异常风险。甲状腺功能异常也会诱发机体产生胰岛素抵抗[14]。
综上所述,在GDM 管理中需关注孕妇的pBMI、血脂、甲状腺激素水平的变化,针对pBMI超重、孕期体质量增长过多,以及TG、LDL-C、TSH 偏高和HDL-C、T3、FT4 偏低者,需加强管理、加强监测、及早干预,从而预防由此导致的GDM 及相关并发症发生。

