羽衣甘蓝类受体激酶FERONIA基因克隆、表达及与相互作用蛋白分析
荀宝茹 秦洪涛 马 蕊 郭楠枫 刘运平 吴 莹 蓝兴国
(东北盐碱植被恢复与重建教育部重点实验室,东北林业大学,哈尔滨 150040)
在开花植物中,柱头能特异地识别本物种的花粉而拒绝其他远源花粉和真菌孢子等的萌发,这一过程极为复杂,花粉和柱头的精准识别决定授粉事件的成功完成[1-2]。柱头作为雌蕊授粉的受感面,当花粉落到柱头后,会迅速启动一条基本反应途径,花粉经过黏附、水合、萌发最终生长出花粉管,穿过花柱,进入子房,一直到达胚珠并完成受精,此过程受到多种关键分子调控[3-5]。自然界中,许多开花植物进化出一种自交不亲和性遗传机制,排斥自身花粉,接受异花花粉,以避免近亲繁殖,促进杂种优势[6-8]。在十字花科(Brassicaceae)中,自交不亲和性(SI)遗传机制受S位点控制[9],雄性S位点决定因子为SP11/SCR,雌性S位点 决 定因子为SRK[10]。SP11/SCR 和SRK 之间相互作用能够诱导SRK 自磷酸化,触发下游信号级联反应,导致自身花粉被排斥[11]。M-位点蛋白激酶MLPK 和具有E3泛素连接酶活性的臂重复蛋白ARC1 已 被 鉴 定 为SRK 直 接 下 游 效 应 因 子[12-14]。SRK 磷酸化后激活下游效应因子ARC1,使其泛素化 进 而 降 解 亲 和 因 子Exo70A1[15]、GLO1[16]和PLD1[17],导致SI反应。
一些类受体激酶RLKs 在雌雄相互作用中已被鉴定,具有感知信号分子的功能[18-19]。FERONIA(FER)属于类受体激酶CrRLKL1家族,在植物生长、发育、激素信号转导、生物和非生物胁迫等多种生物过程发挥着重要调控作用[20-25]。FER 的功能缺失会导致雄性不育、根毛、下胚轴、叶片、种皮等细胞伸长、根系发育及对病原菌应答等缺陷[26-31]。FER-Rac/Rop 信号能够调控NADPH 氧化酶产生活性氧(ROS),导致结球白菜(Brassica rapa)SI 反应[6]。类受体激酶CrRLKL1 家族另一个成员ANJEA(ANJ),也在柱头中高度表达[28,32]。在拟南芥(Arabidopsis thaliana)中,花粉外被蛋白(PCP-B)和快速碱化因子(RALF23/33)竞争性与ANJ-FER 复合物结合,导致柱头中ROS下降,促进花粉水合、萌发[33]。自交不亲和花粉或种间花粉与柱头SRK 结合,能够招募FER,激活SI 柱头中FER 介导的ROS 产生信号转导途径,以排斥不亲和花粉[6,26,34-36],SRK 和FER 整合了种内和种间生殖屏障的潜在机制,可为十字花科作物远缘育种提供可行性途径[37]。
目前FER 在羽衣甘蓝(Brassica oleraceavar.acephala)授粉早期事件及其潜在靶向效应因子等方面研究非常少。本研究从羽衣甘蓝柱头中成功克隆得到BoFER基因,对其氨基酸序列、组织特异性和授粉后不同时间的表达模式进行分析,并鉴定其与已报道的SI 因子互作关系,以期进一步了解BoFER 可能发挥的功能,为深入解析BoFER 在生殖发育过程中的作用奠定基础。
1 材料与方法
1.1 试验材料
羽衣甘蓝自交不亲和系(S13-bS13-b)与亲和系(S45S45)种植于东北林业大学花卉生物工程研究所(45°72′53″N,126°62′92″E)。分别用来自S45S45株系和自身(S13-bS13-b)的花粉对去雄后的S13-bS13-b株系成熟柱头进行亲和及不亲和授粉,收集亲和及不亲和授粉后0、30、60 min的雌蕊,同时采集S13-bS13-b株系萼片、花瓣、柱头、花柱及子房等样本,随后用液氮立即冷冻样本,于冰箱中-80 ℃存储。
1.2 羽衣甘蓝BoFER基因克隆
根据NCBI 数据库提供的甘蓝基因组序列,设计BoFER基因的CDS 序列特异性引物BoFERCDS-F 和BoFER-CDS-R,用于BoFER基因CDS 区的克隆。在BoFER 激酶结构域(KD)序列两端设计特异性引物BoFER-KD-F 和BoFER-KD-R,用于BoFER 激酶域的克隆,引物均由华大基因合成(见表1)。通过E.Z.N.A.™ Plant RNA Kit(OMEGA)试剂盒提取S13-bS13-b柱头总RNA,利用TranScript One-Step gDNA Removal and cDNA Synthesis Super-Mix(TransGen)试剂盒获得柱头cDNA。参考李阳等[38]的方法进行载体构建,利用LATaqDNA 聚合酶(TaKaRa)克隆基因,使用E.Z.N.A.®Gel Extraction Kit(OMEGA)试剂盒回收PCR 扩增产物,并将回收产物连接到pMD19-T 载体连接,热激法转化到大肠杆菌(Escherichia coli)DH5α中,涂于相应抗性平板上,挑取单克隆,进行菌液PCR,符合目的片段大小的菌液送至华大基因进行测序,利用TIANprep Mini Plasmid Kit(TIANGEN)试剂盒提取测序结果正确的菌液质粒。

表1 引物信息Table 1 Primer sequences information
1.3 BoFER的生物信息学分析
参照栗赫铭等[39]提供的生物信息学方法,通过ProtParam(https://web.expasy.org/protparam/)预测蛋白分子量及理论等电点等。使用SMART(http://smart.embl-heidelberg.de/)进 行 结 构 域 分析。通过NCBI(https://www.ncbi.nlm.nih.gov/)进行氨基酸序列分析。
1.4 qRT-PCR表达分析
利用E.Z.N.A.™ Plant RNA Kit(OMEGA)试剂盒提取亲和及不亲和授粉后不同时间雌蕊,以及S13-bS13-b株系雄蕊、花萼、花瓣、柱头、花柱及子房总RNA,使用TranScript One-Step gDNA Removal and cDNA Synthesis SuperMix(TransGen)合成cDNA。参照李晗等[40]的方法进行qRT-PCR,使用Trans-Start®Top Green qPCR SuperMix(TRANS)试剂盒配制20 µL 反应体系如下:TransStart Top Green qPCR SuperMix(2X) 10 µL,cDNA 1 µL,BoFER基因上游特异性引物0.4 µL,下游特异性引物0.4 µL(引物序列见表1),ddH2O 8.2 µL,通过LightCyker480Ⅱ(Roche)仪器进行目的基因qRT-PCR 分析,程序设置:94 ℃预变性 30 s,94 ℃变性5 s,58 ℃退火30 s,40 个循环,每个循环结束后采集荧光信号,所有循环结束后绘制熔解曲线。每个样品进行3 次技术重复。BoACTIN基因作为内参基因[41],通过比值分析方法计算目的基因相对表达量。
1.5 BoFER相互作用蛋白分析
将BoFER-KD 的序列构建到pGADT7(激活域,AD)表达载体上(见表1)。将BoSRK13-b-KD、Bo-MLPK 及Bo-ARC1 的ORF 序 列 构 建 到pGBKT7(DNA 结合域,BD)表达载体上,根据酵母转化手册将重组的AD 和BD 质粒共转化到酵母菌株Y2HGold 中,共转化质粒组合(见表2)。将酵母转化子涂布到SD/-Leu-Trp 缺陷型平板上进行培养2~3 d。挑取单个酵母菌落加入到含5 mL SD/-Leu-Trp 缺陷型液体培养基中,220 r·min-1培养1 d 后,取5 µL 培养液滴加在SD/-Leu-Trp 和SD/-Leu-Trp-His+x-α-gal 缺陷型平板上进行培养。利用含有3-氨基-1,2,4-三唑(3-AT)的SD/-Leu-Trp-His缺陷型平板对自激活试验进行验证。

表2 BoFER酵母共转化质粒组合Table 2 Combination of BoFER yeast co-transformation plasmids
2 结果与分析
2.1 BoFER基因的克隆
以羽衣甘蓝S13-bS13-b株系柱头cDNA 为模板,通过RT-PCR 克隆得到BoFER(见图1),通过测序结果发现BoFER大小为2 682 bp,编码893 个氨基酸(见图2)。BoFER蛋白分子质量大小为97.25 kDa,等电点为5.89。通过SMART 数据库分析,BoFER蛋白结构域主要由信号肽区域、Malectin-like 区域、跨膜螺旋区域、Ser/Thr激酶结构域及低成分复杂区组成(见图3)。从NCBI数据库中检索出油菜(Brassica napus)、白菜(B.rapa)、拟南芥的FER 氨基酸序列,与BoFER 进行序列相似度分析发现,与油菜BnFER 序列相似度达98.5%,与白菜BrFER序列相似度达96.5%,与拟南芥AtFER序列相似度达81.3%,且BoFER 激酶结构域及Ser/Thr 激酶结合位点高度保守(见图4)。
图1 羽衣甘蓝BoFER的RT-PCR扩增结果Fig.1 Results of RT-PCR amplification product of BoFER

图2 BoFER核苷酸及氨基酸序列Fig.2 The nucleotide and amino acid sequences of BoFER
2.2 BoFER基因的组织特异性表达分析
对羽衣甘蓝S13-bS13-b株系的萼片、花瓣、花药、柱头、花柱及子房中的BoFER的表达量进行qRTPCR 分析。结果表明,BoFER在被测组织中均有表达,在柱头中表达水平最高,显著高于在其他被测组织中的表达水平,在花药中表达水平最低(见图5)。
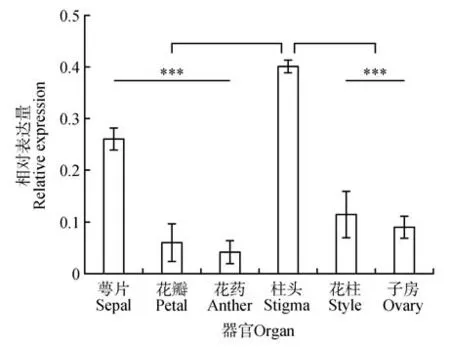
图5 BoFER在花器官中表达分析***.P<0.001.Fig.5 BoFER expression analysis in floral organ
2.3 BoFER 基因在亲和及不亲和授粉过程中的表达模式分析
对S13-bS13-b株系进行亲和及不亲和授粉,选取亲和及不亲和授粉后0、30、60 min 的雌蕊,对BoFER的表达量进行qRT-PCR 分析。结果表明,BoFER在亲和及不亲和授粉后的各检测时间点均有表达,在不亲和授粉后表达水平逐渐升高,在不亲和授粉后60 min 表达水平达到最高(见图6A),BoFER在亲和授粉后表达水平逐渐下降,在亲和授粉后60 min表达水平达到最低(见图6B)。
2.4 BoFER相互作用蛋白鉴定
利用酵母双杂交分析FER 激酶结构域(BoFER-KD)与十字花科植物中自交不亲和相关因子的相互作用,构建酵母表达载体pGADT7-BoFER-KD 与pGBKT7-SRK13-b-KD、pGBKT7-MLPK及pGBKT7-ARC1。将被检测质粒组合pGADT7-BoFER-KD 与pGBKT7-SRK13-b-KD、pGBKT7-MLPK及pGBKT7-ARC1 分别共转化至Y2HGold 酵母感受态细胞中,通过SD/-Trp-Leu 和SD/-Trp-Leu-His+x-α-gal+3mM 3-AT 缺陷型培养基平板中菌落生长状态,鉴定目的蛋白间相互作用情况。结果发现在SD/-Trp-Leu二缺平板上,阳性对照、阴性对照以及共转化酵母生长良好,在SD/-Trp-Leu-His+x-αgal+3mM 3-AT 缺陷型培养基平板中,阳性对照生长且变蓝,阴性对照没有生长,pGADT7-BoFERKD 与pGBKT7-SRK13-b-KD 的组合生长且变蓝,pGADT7-BoFER-KD 与pGBKT7-MLPK 和pGBKT7-ARC1 的组合没有生长(见图7)。这些结果表明,BoFER-KD 与BoSRK13-b-KD 存在相互作用,BoFERKD与BoMLPK、BoARC1不存在相互作用。

图7 BoFER与BoSRK相互作用分析Fig.7 Protein interaction analysis between BoFER and BoSRK
3 讨论
本研究从羽衣甘蓝自交不亲和系(S13-bS13-b)中分离出BoFER基因。其开放阅读框大小为2 682 bp,编码含有893 个氨基酸残基的蛋白质。BoFER 蛋白由信号肽结构域、Malectin-like 结构域、跨膜螺旋结构域、Ser/Thr 激酶结构域及低成分复杂区组成。对BoFER 氨基酸序列进行比对分析发现,与油菜BnFER 序列相似度达98.5%,与白菜BrFER序列相似度达96.5%,与拟南芥AtFER序列相似度81.3%,这表明BoFER序列高度保守。
分析羽衣甘蓝BoFER的组织表达特性发现其在萼片、花瓣、花药、柱头、花柱及子房组织中均有表达,且在柱头中的表达量要显著高于在其他花器官中的表达量,这个结果表明BoFER可能在柱头中发挥着重要作用。Duan等[34]发现拟南芥FER是花粉管穿透柱头乳突细胞,最终进入配子体完成生殖过程的重要调控因子。本研究进一步对羽衣甘蓝BoFER在授粉过程中的表达模式进行研究,结果显示BoFER在亲和及不亲和授粉后的各时间点均有表达,在不亲和授粉后表达水平逐渐升高,而在亲和授粉后其表达水平逐渐下降,表明BoFER可能在羽衣甘蓝亲和授粉及不亲和授粉中发挥作用。Zhang 等[6]研究发现,在白菜中,对BrFER的研究也有类似的表达特性,BrFER的表达水平下降,能够打破自交不亲和反应,促进亲和授粉花粉管的生长。说明BoFER可能在授粉中发挥重要作用。
为了进一步研究BoFER 在自交不亲和中的作用,通过酵母双杂交技术研究了BoFER-KD 与已知自交不亲和相关因子的相互作用关系,发现BoFER-KD 与BoMLPK、BoARC1 不存在相互作用,与BoSRK13-b-KD 存在相互作用,表明BoFER 可能通过与BoSRK13-b的相互作用来参与自交不亲和反应。在白菜中也发现了BrFER1-KD与BrSRK46-KD的相互作用关系,BrSRK 通过招募BrFER,增加柱头中ROS 含量,排斥自身花粉,也排斥种间花粉[37]。
本研究中对羽衣甘蓝BoFER基因进行克隆,序列分析及蛋白结构分析,同时分析了该基因的组织表达特异性和在授粉过程中的表达模式,并通过酵母双杂交鉴定BoFER 与其他自交不亲和相关因子的相互作用。不仅丰富了对芸薹属植物BoFER 的认识,而且为进一步探讨BoFER 与BoSRK13-b间的相互作用以及BoFER 的生物学功能奠定了基础。这将为更好地开发植物授粉过程所依赖的信号转导途径提供线索,为未来作物育种提供重要的分子育种策略。

