植被控制对人工更新紫椴幼树根系性状的影响
杨立学 刘士林 付瀚萱 周思雨 刘会锋 申方圆*
(1.东北林业大学林学院,森林生态系统可持续经营教育部重点实验室,国家林业草原东北乡土树种工程技术研究中心,哈尔滨150040; 2.大兴安岭地区农业林业科学研究院,加格达奇 165300)
幼龄林时期是决定苗木成活成林的关键阶段,此时造林树种多处于幼树阶段,树体相对矮小,对不良环境抵抗力差,常与其周围草本灌木存在激烈的地上和地下竞争。通过割灌除草等方式控制目标树种周围竞争性植被盖度,促进目标树种生长更新,是中幼龄林抚育过程中典型的森林经营方式之一[1]。研究发现,地表植被控制不仅可以通过降低物种间竞争关系促进幼树的生长,缩短林分郁闭时间[2],而且针对特定树种还可以发挥生物遮荫功能,起到调节幼树光照条件的作用,植被控制强度越大,幼树受光面积越大,光照强度越大,从而促进幼树更新发育[3]。
细根(直径≤2 mm)是植物重要的营养和功能器官之一,负责水分和养分的运输,其性状特征对植物的生长发育具有重要作用[4-5]。按照根序分级法来划分根系[6],能够很好地反映其形态特征的变化规律,通常将最末端的前3 级定义为吸收根,其在吸收水分和养分上发挥重要作用,4 级和5 级根大多数已木质化,被认为是运输根[7]。根系作为重要的养分捕获器官,通过改变自身特征适应环境变化,保证更有效地吸收养分[8],其形态特征包括根直径、比根长、比表面积和根组织密度等指标[9]。研究表明,较小的根直径、较大的比根长和比表面积有利于提高植物对资源的吸收和利用效率[10]。陈菊艳等[11]研究野鸦椿(Euscaphis japonica)幼苗形态特征对遮光条件的响应发现,随着光照强度的减弱,苗木根长呈现先增加后减小的趋势,根幅在60%遮光处理下最大,90%遮光处理下最小,侧根数呈现下降的趋势。闫兴富等[12]研究光环境对柠条锦鸡儿(Caragana korshinskii)幼苗形态特征的影响发现,其主根长在55.5%光照条件下最大,0.5%光照条件下最小。吴小健等[13]研究不同杉木(Cunninghamia lanceolata)细根生态化学计量特征的差异发现,细根氮和磷含量随着根序的增加呈现下降的趋势,而碳含量呈现增加的趋势。可溶性糖和淀粉可以提高植物应对不良环境的适应能力,具有稳定渗透压等功能,在植物的生长过程中起着非常重要的作用[14]。张玲等[14]研究遮荫对黄檗(Phellodendron amurense)幼苗生理特征的影响发现,黄檗雌株和雄株的可溶性糖和淀粉含量均随着遮荫强度的增加先增加后减少。由此可见,根系性状随光照强度的响应在不同种植物和不同根序间变化并不一致,而对于紫椴根系性状随环境变化的研究并不多见。
紫椴(Tilia amurensis)是我国东北地区的珍贵阔叶树种之一,是重要的用材树种、蜜源树种和绿化树种,具有重要的生态和经济价值。紫椴幼苗和幼树对光环境具有较为广泛的适应性,但研究发现全光条件下紫椴人工更新效果并不理想[15],此外,紫椴幼树对不同光照条件下个体差异相对明显[16],这极大限制了紫椴的人工更新进程。针对此更新障碍以往研究多采用人工遮荫处理改变幼树光环境以促进其人工更新[16-18],但人工遮荫方式对光照条件的改变相对单一,且不适宜在造林地内大面积作业,紫椴根系性状特征与其生长发育密切相关。鉴于此,本研究以紫椴幼树人工林为对象,通过设置不同植被控制强度来控制光照强度,以揭示植被控制强度对紫椴幼树生长及细根不同根序形态、化学计量和生理性状的影响。
1 材料与方法
1.1 研究地概况
研究地为黑龙江省伊春市南岔县奋斗经营所(46°36′~47°27′N,128°49′~129°46′E),位于小兴安岭腹地,属温带大陆性季风气候,冬季寒冷干燥,夏季湿凉多雨,年均气温-0.3 ℃,年均最高气温7.5 ℃,年均最低气温-6.6 ℃,年日照时1 850 h,年降水量550~750 mm。
造林地原为红松阔叶混交林,后经历史性采伐形成荒地,2018 年春季采用2 年生紫椴实生苗以株行距1.5 m×1.5 m 人工营建紫椴纯林,紫椴假二叉分枝,造林前不进行整地,使其与灌木杂草共生,以形成林地小气候来保护顶芽。本试验紫椴造林地地势平坦,平均海拔400 m,土壤类型为暗棕壤。造林地内主要灌木有瘤枝卫矛(Euonymus verrucosus)、暴 马 丁 香(Syringa reticulatasubsp.amurensis)、光萼溲疏(Deutzia glabrata)、金花忍冬(Lonicera chrysantha)、毛榛子(Corylus mandshurica)等,主要草本有蚊子草(Filipendula palmata)、狭叶荨麻(Urtica angustifolia)、东北羊角芹(Aegopodium alpestre)、膜叶驴蹄草(Caltha palustrisvar.membranacea)、耳叶蟹甲草(Parasenecio auriculatus)等。
1.2 研究方法
1.2.1 样地设置
2022 年5 月中旬选择长势一致的健康紫椴幼树140 株,进行3 种强度的竞争植被控制处理:以幼树为中心去除半径30 cm 内的(T30)、半径50 cm内的(T50)、半径75 cm 内的(T75)灌草,不进行植被控制为对照组(CK),每个处理各35 株。本研究中,紫椴人工林营建过程中,以初始密度为1.5 m×1.5 m定点挖穴造林,土穴规格为半径30 cm,深30 cm。鉴于此,以T75处理为100%强度。植被控制只对地表上灌草进行清除,不破坏土壤结构与植物根系。
1.2.2 植物和土壤样品的采集与测定
2022年5月中旬,对140株紫椴幼树进行挂牌标记,并使用卷尺和游标卡尺分别测定其树高和地径(见表1)。2022 年8 月中旬,使用照度计测定幼树所处环境的光照强度,在每株幼树树梢高度的东、南、西、北4 个方向分别读取数值,取平均值作为该环境下的光照强度。随机选择每组处理中生长健壮无病虫害和机械损伤的15 株紫椴幼树,在每株紫椴根系生长方向50~100 cm 内,采集多个包含1~5 级根的完整根段,轻轻抖落根系表面黏着的土粒,装进无菌保鲜袋放入便携式恒温冷藏箱,并尽快带回实验室。采集每株幼树根部土壤样品,将每个处理的3株幼树土壤样品充分混合为一个土壤样本,每个处理采集5 个混合土壤样本,共计20个混合土壤样本,土壤样本带回实验室测定土壤理化性质。
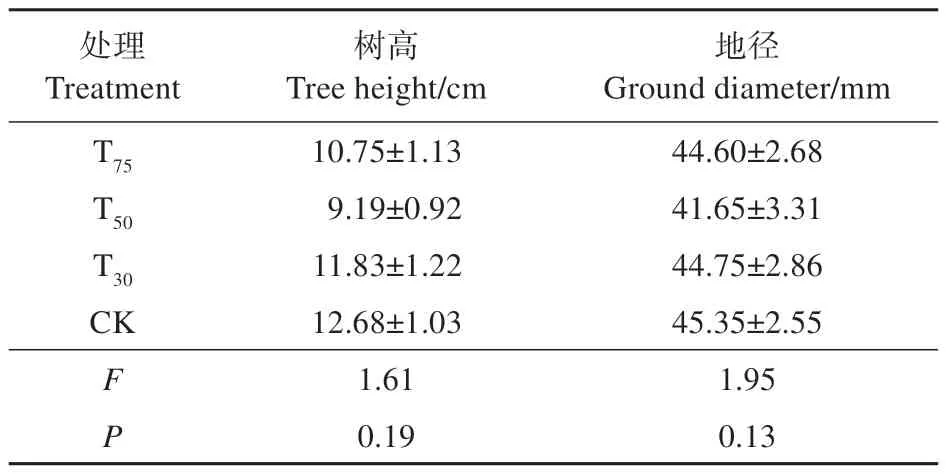
表1 不同处理组紫椴幼树初始树高、地径Table 1 Initial tree height and ground diameter of T.amurensis saplings under different treatments
将采集的紫椴幼树的根系样品根据根序法分别分为吸收根(1~3 级根)和运输根(4~5 级根),使用Epson 数字化扫描仪(Expression 10000XL 1.0,Telford)分别对吸收根和运输根进行扫描,扫描后的图像使用根系形态分析软件(Win RHIZO Pro 2016,Canada)进行形态参数的分析,分析获得根系的平均直径、总根长、总体积等指标,将扫描完的细根置于信封中并做好标记后,放入烘箱中65 ℃烘干至恒质量(精确到0.000 1 g),并计算根系的比表面积(Specific root surface area,SRA)、比根长(Specific root length,SRL)和组织密度(Root tissue density,RTD)。将烘干后的细根先用球磨仪粉碎,过0.149 mm筛后,用元素分析仪测定全碳和全氮含量[19],使用硫酸-过氧化氢消化法测定全磷含量[20],采用改进的蒽酮-硫酸法测定可溶性糖和淀粉含量[21]。
1.3 数据处理和统计分析
数据通过Microsoft Excel 2013软件整理后,使用SPSS 25.0 软件对不同处理组紫椴幼树的光照强度、当年生长量、根系性状等指标进行单因素方差分析(One-way ANOVA)、混合效应方差分析(Mixed-effect ANOVA)、多重比较(Duncan检验法)和相关性分析(Spearman 法),使用R 语言vegan 包对根系性质与土壤因子进行冗余分析,通过Origin Pro 2018软件(v9.5.0,USA)实现数据可视化。
2 结果与分析
2.1 植被控制对光照强度和土壤理化性质的影响
植被控制对紫椴幼树所处环境的光照强度、土壤pH、含水量、全碳、全氮、速效氮和有效磷含量影响显著(P<0.05),对土壤全磷含量影响不显著(见图1)。随着植被控制强度减弱,紫椴幼树所处环境的光照强度呈现显著下降的趋势(见图1A)。土壤pH 在T30处理下显著高于其他3个处理(P<0.05,见图1B)。土壤的含水量在T75处理和CK 组显著高于T50处理(P<0.05,见图1C)。土壤的全碳和全氮在CK 组显著高于其他3 个处理(P<0.05),在T75和T30处理下显著高于T50处理(P<0.05),T75和T30处理的差异不显著(见图1D~E)。土壤的速效氮含量在CK 组显著高于其他3 个处理(P<0.05),在T75处理下显著高于T30处理(P<0.05,见图1G)。土壤的有效磷含量在CK 组显著高于其他3 个处理(P<0.05),但其他3 个处理间差异不显著(见图1H)。
2.2 植被控制对紫椴根系形态特征的影响
混合效应方差分析结果显示,紫椴幼树的根系形态性状在不同植被控制处理与根系种类间存在显著差异(P<0.05)。其中,所有处理组紫椴运输根的根直径均显著大于吸收根(P<0.05),而其比表面积和比根长均显著小于吸收根(P<0.05)。而对于组织密度而言,只有T30处理下运输根的组织密度显著大于吸收根(P<0.05),其他处理组运输根和吸收根之间无显著差异(见图2)。
对于紫椴幼树根系的吸收根(1~3级根)而言,植被控制显著改变了其比表面积、比根长和组织密度(P<0.05,见图2B~D)。吸收根直径在T75处理下最大((0.26±0.03) mm),在CK 组最小((0.22±0.02) mm),但不同处理组间差异不显著(见图2A)。吸收根比表面积随着植被控制强度的减弱而增加,在CK组达到最大((983.35±177.90) m2·g-1),显著高于T75组68.20%(见图2B)。吸收根的比根长随植被控制强度减弱而增加,在CK 组达到最大((145.91±20.34) m·g-1),显著高于T75组81.10%(见图2C)。吸收根组织密度随植被控制强度减弱而降低,在T75组最大((0.29±0.03) g·m-3),在CK组最低((0.20±0.02) g·m-3),两者间差异显著(P<0.05,见图2D)。
对于紫椴幼树根系的运输根(4~5 级根)而言,植被控制对其直径、比根面积和比根长影响显著(P<0.05),运输根直径随植被控制强度减弱而减小,在T75组最大((0.97±0.12) mm),分别高于T30和CK 组44.78%和42.65%,差异显著(P<0.05,见图2A)。运输根比表面积和比根长都随植被控制强度减弱而增加,均在T75组最小((142.83±28.78)m2·g-1)和((5.16±1.35) m·g-1),在T30组达到最大((234.13±17.31) m2·g-1)和(11.34±1.17) m·g-1,见图2B~C)。运输根组织密度在T75处理下最大((0.33±0.04) g·m-3),在T50处理下最小((0.23±0.05) g·m-3),不同处理间差异不显著(见图2D)。
2.3 植被控制对紫椴根系化学计量的影响
混合效应方差分析结果显示,紫椴幼树根系的全碳、全氮、全磷含量和碳氮磷化学计量比在根系种类间均存在显著差异(P<0.05),其中所有处理组紫椴运输根的全碳含量、碳氮比均显著大于吸收根(P<0.05),而全氮含量均显著小于吸收根(P<0.05),此外,吸收根的全磷含量和氮磷比均大于运输根,但两者间差异不显著。T75和CK 组的运输根的碳磷比显著大于吸收根(P<0.05),而T50和T30组中两种根系类型的碳磷比差异不显著(见图3)。植被控制只对所有根系的全碳、全氮含量具有显著影响(P<0.05,见图3A~B)。
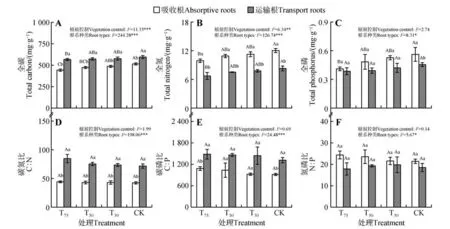
图3 不同植被控制强度对紫椴根系碳氮磷含量和计量比的影响Fig.3 Effects of different treatments on the content and stoichiometric of carbon,nitrogen,and phosphorus in the absorptive roots and transport roots of T. amurensis saplings
对于紫椴幼树吸收根而言,全碳、全氮和全磷含量均随植被控制强度减弱而增加,在T75组最小,在CK 组最大,T75和CK 间差异显著(P<0.05,见图3A~B)。随着植被控制强度减弱,吸收根的碳磷比和氮磷比也逐渐降低,而碳氮比无明显变化,但三者在不同处理间差异均不显著(见图3D~F)。
对于紫椴幼树运输根而言,全碳和全氮含量均随植被控制强度减弱而增加,在T75组最小,在CK组最大,T75和CK间差异显著(P<0.05,见图3A~B)。运输根全磷含量也随植被控制强度减弱而增加,但不同植被控制处理间差异不显著(见图3C)。随着植被控制强度的减弱,运输根碳氮比和碳磷比逐渐降低,而氮磷比则先升高后降低,但碳氮磷化学计量比在不同处理间差异均不显著(见图3D~F)。
2.4 植被控制对紫椴根系非结构性碳含量的影响
混合效应方差分析结果显示,紫椴幼树根系可溶性糖和淀粉含量在不同植被控制处理与根系种类间存在显著差异(P<0.05,见图4)。对于根系可溶性糖含量而言,CK 组中吸收根的可溶性糖含量显著大于运输根(P<0.05),而在T75、T50和T30组中均小于运输根的,且在T75中差异显著(P<0.05,见图4A)。对于根系淀粉含量而言,吸收根的淀粉含量均大于运输根,在T75和T50中差异显著(P<0.05,见图4B)。
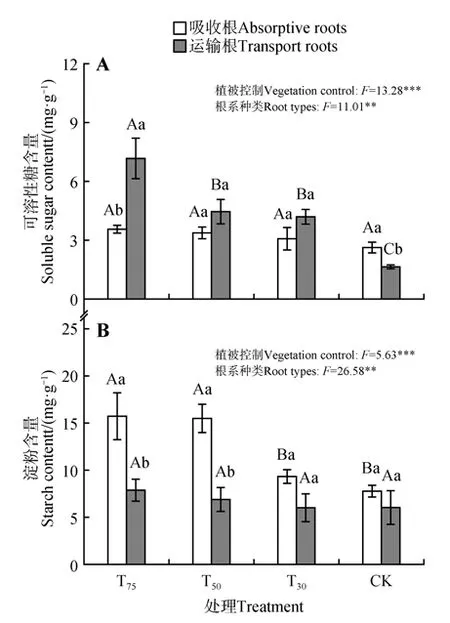
图4 不同植被控制强度对紫椴吸收根和运输根非结构性碳含量的影响Fig.4 Effects of different treatments on the nonstructural carbohydrate content in the absorptive roots and transport roots of T. amurensis saplings
对于紫椴幼树吸收根而言,可溶性糖和淀粉含量均随植被控制强度减弱而减小,均在T75中含量最大,在CK 中含量最小,其中可溶性糖含量在不同处理间差异不显著(见图4A),T75和T50组的淀粉含量显著大于T30和CK组(P<0.05,见图4B)。
对于紫椴幼树运输根而言,可溶性糖和淀粉含量也随植被控制强度减弱而减小,均在T75中含量最大,可溶性糖含量在CK 组最小,淀粉含量在T30组最小,但淀粉含量在不同处理间差异不显著(见图4B),而可溶性糖含量在不同处理间差异显著(P<0.05,见图4A)。
2.5 紫椴根系性状与土壤因子的关系
将紫椴幼树吸收根和运输根的根系性状分别作为响应变量,将土壤因子作为解释变量进行冗余分析显示,对于吸收根而言,前2 个排序轴共解释根系性状总变异的43.2%(见图5A),对于运输根而言,前2 个排序轴共解释根系性状总变异的37.9%(见图5B)。相关性分析显示,紫椴幼树的吸收根和运输根的根系性状与土壤因子的相关性总体上存在异同点:相同点是不管吸收根还是运输根,与根系全碳含量显著相关的土壤因子均较多;不同点是较多土壤因子与吸收根淀粉含量显著相关,而对于运输根来说,与其可溶性糖含量显著相关的土壤因子较多。具体而言,吸收根根直径与土壤速效磷显著负相关,运输根根直径与土壤的pH、全碳、全氮和全磷含量显著负相关(P<0.05,见表2~3)。运输根比表面积和比根长均与土壤的pH、全碳和全氮含量显著正相关(P<0.05)。吸收根和运输根的全碳、全氮含量均与土壤全氮显著正相关(P<0.05)。运输根的磷含量与土壤含水量、土壤全碳显著正相关(P<0.05)。吸收根和运输根的可溶性糖含量均与土壤全氮显著负相关(P<0.05)。吸收根的淀粉含量与土壤的pH、全碳和全氮含量显著负相关,而与土壤全磷含量显著正相关(P<0.05)。

表2 紫椴吸收根性状与土壤因子的相关性Table 1 Correlation analysis of absorptive root characters and soil factors of T. amurensis
3 讨论
植被控制处理显著改变了紫椴幼树所处微环境中的光照条件(见图1A),这可能是影响紫椴幼树根系性状的主要原因。植物光合作用产生的糖类物质是促进根系生长的重要因素,这些糖类物质能够促进植物主根和侧根的生长发育[22]。根系在不同光环境下可以调节自身的形态特征来促进根系的生长、营养元素的吸收及生物量的积累[23]。根系直径是树木根系基础指标之一,植物通过直径大小的调整以适应环境。比根长和比表面积值越大,代表养分利用率越高。组织密度是预测植物对资源利用性的有效指标,根系组织密度与植物生理活动密切相关,根系组织密度越小则意味着根系所处的环境条件资源越丰富,越支持高产,根系生长速率越快[24]。Miotto 等[22]研究不同光环境下蔗糖对水稻(Oryza sativa)根系发育的影响发现,水稻根系性状随光照强度的变化而变化,蔗糖和光照条件对根系生长具有协同促进作用,但无光照条件下,蔗糖无法发挥其对根系生长的促进作用。Vincent等[25]发现增加光照强度可以增加小麦(Triticum aestivum)的根长和根干物质。Page等[26]研究小麦根系发育对光强的响应发现,在强光环境下,侧根数量多,根系更密集。本研究中,光照强度随着植被控制强度增强而增强,紫椴幼树的根系直径随植被控制强度减弱而减小,比表面积和比根长均随植被控制强度减弱而增加,这与以往的研究结果类似。徐立清等[23]研究林缘、林隙和林冠下胡桃楸(Juglans mandshurica)根系的性状变化发现,随光强的增加,比根长减小,光照增强,为根系提供的碳水化合物增加,根系的构建效率降低,进而导致比根长下降。植物细根形态特征的变化可以从一定程度上缓解植物因环境变化而造成的失衡状态[27-28]。
光环境会影响根系的生长发育,碳、氮、磷含量对植物的生长发育具有重要意义,植物会通过适当调节各器官养分的含量,从而使植物对资源的吸收和利用效率最优[29]。光环境对植物营养元素的吸收能力具有重要作用[30]。本研究中,紫椴根系的全碳、全氮和全磷均随植被控制强度的减弱而增加,这与以往的研究结果类似。例如,智西民等[30]研究遮荫处理对青桐(Firmiana platanifolia)幼苗各器官碳、氮、磷含量的影响发现,幼苗根系的碳、氮、磷含量均随着遮荫强度的增加呈现显著上升的趋势,这可能是因为低光环境下,植物的光合作用受到抑制,通过提高根系对营养元素的吸收和利用,从而促进植物的生长发育。植物的化学计量可以反映植物对营养元素的分配,以及养分利用效率[31]。本研究中,紫椴根系的碳氮比和碳磷比均随植被控制强度的减弱而减小,这与以往的研究结果类似。熊静等[32]研究木荷(Schima superba)幼苗各器官化学计量特征的影响发现,根系的碳氮比和氮磷比均在全光照环境下显著高于遮荫环境的。紫椴根系不同根序间养分含量随植被控制强度的变化可能是因为其对资源吸收和利用优先性的保障。
光合产物分为结构性碳和非结构性碳,非结构性碳含量是维持渗透调节功能的重要因素[33]。研究表明,植物倾向于就近分配光合产物,根系距离较远,这可能会造成根部的非结构性碳水化合物含量较低,植物各器官相互协调才能使植物对资源的吸收和利用效率最高[34]。本研究中,紫椴根系的可溶性糖和淀粉含量随植被控制强度的减弱而减小,这与以往的研究结果类似。李晓庆等[35]研究5 个藤本月季品种各器官非结构性碳水化合物含量的差异发现,其根系的非结构性碳水化合物含量随遮荫强度的增加呈现显著下降的趋势。这可能是因为低光环境下,光合作用较弱,形成的光合产物较少;也可能是低光环境下,植物的蒸腾作用较弱,使植物体内的水分状况优越,从而不需要较高的非结构性碳水化合物含量来维持渗透调节功能。
此外,土壤条件的改变是幼树根系性状变异的另一个重要原因[36],植被控制处理对土壤条件的改变主要通过两种途径实现,首先植被控制处理可以改变到达土壤表面的光照和降水[37],进而影响土壤理化性质,其次植被控制处理可以改变草本灌木与土壤间反馈作用[38],从而影响土壤中全量养分和有效养分的含量。本研究还发现,土壤因子对吸收根性状变化的解释程度(43.2%)要大于对运输根性状变化的解释程度(37.9%),这可能是由于相较于运输根,吸收根由生长在根系末端的1~3 级根序的细根组成,其木质化程度较低,具有初生构造和完整的皮层组织,对环境变化敏感,生理功能集中于吸收养分和水分,而运输根为4~5级根序的细根,木质化程度高,皮层组织消失,具有连续的木栓层和次生木质部,生理功能集中于支持、存储和运输作用[39]。细根的形态、生理等指标与根系养分和水分吸收密切相关,低序级根依靠着其对环境变化的高度敏感性,能够对土壤养分和水分的变化做出快速响应,因此细根对土壤条件变化的可塑性响应随根序升高而减弱[40]。吸收根和运输根性状随土壤因子变化的不同响应程度,反映了吸收根和运输根的结构和功能之间的差异,进一步说明细根在土壤养分、水分获取和资源维持方面,吸收根和运输根间存在着特殊的权衡关系,这会影响紫椴幼树不同细根种类在资源获取和分配方面的策略。
4 结论
随植被控制强度的减弱(T75、T50、T30和CK),紫椴根系形态、化学计量和生理特征均发生适应性变化。紫椴在低光环境下,增加根系比表面积、比根长和营养元素的吸收来提高对弱光环境的适应能力。植被控制处理可以改变幼苗生长环境中的光照强度和土壤理化性质,促进幼苗根系生长,提高幼苗根系养分利用效率,进而促进树木幼苗生长。

