一株拟南芥宽叶形突变体atscamp的分离鉴定
郝雪峰 贾晓宇 曹海艳 亢春霞 裴雁曦
(1.太原师范学院,生物科学与技术学院,晋中 030619; 2.山西大学,生命科学学院,特色植物资源研究与利用山西省重点实验室,太原 030006)
随着世界人口的增加,耕地面积的减少,提高农作物产量成为亟待解决的问题之一[1]。植物器官大小直接影响作物的产量和生物量[2]。对植物来说,光合性能是影响农作物产量的一个重要指标。叶片作为光合作用的主要器官,其理想的形态有利于塑造株型并提高光合效率[3]。此外,叶片形态对于植物光合储能、抵御逆境等都有非常重要的意义。叶片是植物最重要的根外营养器官,叶片在吸收水分的同时也能像根一样将养分转运到植物体内[4]。水稻(Oryza sativa)籽粒灌浆所需营养物质的60%~80%来自叶片光合作用[5]。小麦(Triticum sativum)灌浆期籽粒碳水化合物的30%~50%主要来源于旗叶的光合作用[6]。因此,利于提高光合作用的株型、叶形成为重要的产量育种指标。
叶片形态对于实现作物高效光合影响很大,目前,已开展了很多对于叶片形态的相关研究。已有报道表明,植物叶片窄叶性状的发育与生长素的合成和极性运输密切相关,生长素在叶片和维管组织的发育和形态建成上起着重要的作用[7]。在单子叶植物中,一些水稻叶形相关调控基因被报道,水稻叶形调控基因的共同特点是参与激素的合成或运输,其突变性状为叶片窄化且伴随植株矮化[8]。目前,已经报道了定位于水稻不同染色体的nal1~nal7七个窄叶突变体,对部分基因进行了功能验证[9]。NAL1基因编码1 个植物特有的蛋白,它可以调节生长素的极性运输,使得水稻叶片横向生长[10-11];NAL7基因编码1 个YUCCA 家族酶蛋白,参与生长素的合成,并影响叶形发育[12]。双子叶植物中,张海瑞[13]发现yuan1突变体可导致拟南芥(Arabidopsis thaliana)叶片表现出短而圆的表型;AN3/AtGIF1和At-GRF5的功能缺失突变体表现出窄叶表型,该表型由叶片细胞数目变少引起[14-15]。黄淦等[16]发现GRXC9基因过表达株系中叶片细胞体积变小,叶片出现短小的表型。但是叶片宽大性状相关基因的研究还很少。
分泌载体膜蛋白(secretory carrier membrane protein,SCAMP)广泛存在于包括线虫、昆虫、鱼类、两栖动物、哺乳动物等的真核生物中,也存在于单子叶植物和双子叶植物中[17]。SCAMP参与植物细胞内吞作用和信号传导,以及胞吐的调节和多泡内体生物发生[18-19]。植物中SCAMPs是一个基因家族,其家族成员参与调控花粉管发育[20],AtSCAMP在种子萌发阶段及生长发育阶段对盐胁迫较为敏感[21]。在小麦中,TaSCAMP1可以与液泡膜Na+/H+逆向转运蛋白发生互作,推测与植物耐盐性相关[22]。目前,尚未发现该基因与叶形调控相关研究的报道,因此,探索SCAMP 与叶形发育这两者之间的联系是一个十分有意思的研究。
本研究前期发现了1 个宽叶表型的拟南芥突变体,从表型看这一突变体的表现与前述已经报道[8]的突变体有显著不同,一是基因突变表现为叶片加宽,另外该突变体并没有伴随矮化表型。推测该突变位点与已经报道的单子叶植物叶形调节基因不属于同一类型。目前宽叶相关性状研究及基因定位克隆很少。本研究将对这一突变体进行鉴定,以期为研究叶形发育分子调控机理提供新的突破点,也为培育高光合效能作物品种提出全新的研究思路。
1 材料与方法
1.1 植物材料
所用材料为哥伦比亚生态型(Col-0)拟南芥和化学诱导型拟南芥XVE 诱导型激活突变体(中国科学院遗传与发育生物学研究所的左建儒教授提供)。
1.2 培养条件
选择均匀饱满的拟南芥种子,4 ℃春化2~4 d,经70%乙醇和6.5%次氯酸钠消毒后先种植于1/2MS 培养基上生长1 周,然后挑选生长健壮的幼苗定植于V(营养土)∶V(珍珠岩)∶V(蛭石)=1∶1∶1的混合基质中;培养条件均为23 ℃、相对湿度60%、光照强度160 µE·m-2·s-1、光周期为16 h 光照/8 h 黑暗[23]。收集1~5 周龄植株叶片(用于发育时期特异性测定)和第5 周龄植株的根、茎、叶、花(进行组织特异性测定)后,立即置于液氮中,冰箱中-80 ℃存储备用。
1.3 试验方法
1.3.1 突变体的Genotyping 鉴定以及RT-PCR表达分析
取4 周龄的拟南芥野生型(WT)和atscamp突变体植株,用CTAB 法提取叶片总DNA。以DNA为模板,采用三引物法,进行PCR 扩增。引物为AtSCAMP基因特异的引物P1、P2 与T-DNA 上的引物P3,详细引物序列信息见表1。

表1 基因分型及表达量鉴定引物列表Table 1 Primer list for genotyping and expression level analysis
DNA提取、PCR扩增、胶回收,T载体克隆等参考Liu等[24]的方法进行;委托北京华大基因公司测序;序列在NCBI 进行比对分析,用Tail-PCR 技术[24]确定T-DNA 插入位点;RNA 提取、单链cDNA的 合 成 以 及 半 定 量RT-PCR 参 见Dixit 等[25]的方法。
1.3.2 突变体的观察
利用直尺和拍照式叶面积仪(JC-LAM-D,中国),分别对5 周龄植株冠幅及其最大的4~5 片叶进行叶长、叶宽和叶面积的测量。
1.3.3 叶绿素荧光参数、叶绿素含量和叶片气体交换参数的测定
利用植物效率分析仪(Handy PEA,英国)测定叶绿素荧光参数,将叶片表面擦净,植株遮光暗适应30 min 之后测定叶片初始荧光(Fo),用饱和脉冲光照射测量可变荧光(Fv),根据Fo和Fv计算PSⅡ的潜在光化学效率(Fv/Fo),每组处理重复3次,取平均值作为测定数值。
参考李合生[26]的方法,取0.05 g 新鲜叶片,加入1 mL 95%乙醇于研钵中进行匀浆,后将匀浆液转入5 mL 的EP 管,再用2 mL 95%清洗研钵后再次归入EP 管,共3 mL,操作时注意避光,于室温3 000 r·min-1离心3 min 取上清液备用。取200 µL上清液于多功能酶标仪(BioTek,美国)测定665 nm 和649 nm 处的吸光值(即D665,D649)。以95%乙醇为空白,样品和空白均设置3 个重复,记录数值,并按如下公式计算:ρ(Chl a)=13.95×D665-6.88×D649;ρ(Chl b)=24.96×D649-7.32×D665;各叶绿体色素质量分数=(色素质量浓度×提取液体积)/叶片鲜质量。
利用光合作用测定仪(SY-1020,中国)于09:00—11:00 检测植株叶片气体交换参数:净光合速率(Pn)、蒸腾速率(Tr)、胞间二氧化碳摩尔分数(Ci)、气孔导度(Gs)和水分利用率(WUE)。测定时光源充足,CO2流速稳定。
1.3.4 气孔孔径测定
取4 周龄的WT、atscamp植株的叶片,每个样本撕取表皮条3~4个(取材于不同幼苗),置于75%乙醇中固定,在光学显微镜下观察气孔,每个表皮条至少观察5个视野,统计至少90个气孔孔径。
1.4 数据处理
使用Excel 2016 和IBM SPSS Statistics 26 软件对数据进行单因素方差分析,并用平均值±标准差表示,用Duncan’s分析不同处理间的差异显著性,使用SigmaPlot 10.0及Photoshop 2020作图。
2 结果与分析
2.1 突变体的T-DNA插入位点
从化学诱导型拟南芥突变体库(约6 000 株系)中筛选获得1 株叶片性状宽大的突变体(见图1A)。单株收种性状稳定后,Tail-PCR 结果表明T-DNA 插入位点位于AT1G11180(NC_003070.9,Tair Accession 6530298368,2 784 bp)基因第5个外显子(1 190~1 312 bp)中第1 215~1 216 bp(见图1B)。查 询GenBank 数 据 库,AT1G11180编 码SCAMP2家族蛋白,因此将该突变体命名为atscamp。Genotyping 结果表明,atscamp突变体是纯合植株(见图1C)。 RT-PCR 检 测 发 现,AtSCAMP2基 因 在atscamp突变体中转录表达水平极低(见图1D)。SCAMP 家族蛋白一般具有4 个跨膜结构域(TMDs),广泛存在于许多真核生物中,在植物中是植物细胞内吞和分泌途径的有用标记,但是目前功能尚不清楚。
2.2 突变体表型与分析
拟南芥野生型和突变体atscamp播种后28 d,植株抽薹前,对植株冠幅、叶长、叶宽和叶面积进行测量。数据显示,突变体atscamp叶片冠幅、叶片长度与野生型植株相似;但是突变体的叶片宽度和比叶面积均极显著大于野生型植株(见表2)。
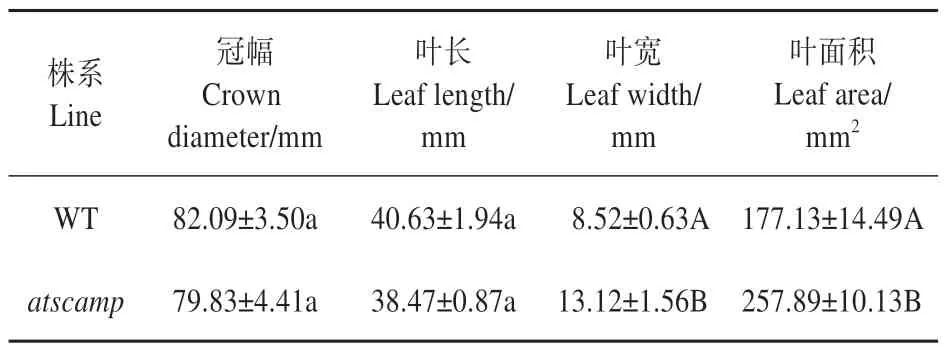
表2 WT和atscamp的形态结构性状Table 2 Morphological structure characteristics of WT and atscamp
另外,与野生型植株相比,该突变体的叶色明显较深。因此对atscamp突变体的叶绿素含量进行测定,结果显示(见表3):与野生型植株相比,atscamp突变体叶绿素b含量虽然未发生显著变化,但是叶片叶绿素a含量显著增加,相应地叶绿素a/b比值也显著增加。
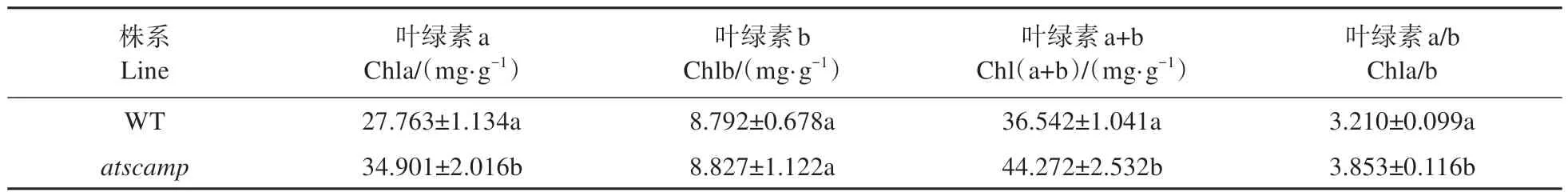
表3 WT和atscamp叶绿素含量的差异Table 3 Differences of chlorophyll content between WT and atscamp
2.3 突变体atscamp叶绿素荧光和光合相关指标
鉴于atscamp突变体中叶绿素含量的变化,暗示该突变体光合性能可能发生变化。因此,进一步对该突变体植株叶绿素荧光和光合相关指标进行分析,结果如表4 所示:atscamp突变体叶片叶绿素初始荧光与野生型植株相比,无显著差异;但是突变体中叶绿素最大荧光(Fm)、PSⅡ最大光化学效率和PSⅡ潜在光化学效率都显著高于野生型植株。
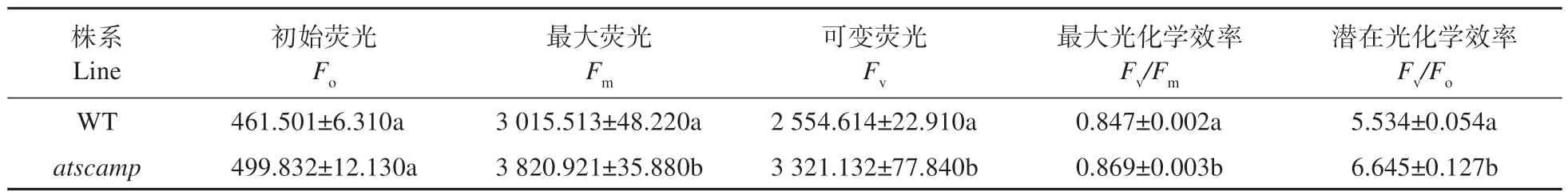
表4 WT和atscamp叶绿素荧光参数的差异Table 4 Differences of chlorophyll fluorescence parameters between WT and atscamp
结果发现,atscamp突变体的净光合速率(Pn)较野生型植物极显著增加;同时该突变体叶片水分利用效率(WUE)和叶片蒸腾系数(Tr)都显著增加;但是该突变体的气孔导度(Gs)和气孔开度(Sa)与野生型植物相比均无显著差异(见表5)。

表5 WT和atscamp叶片光合指标的差异Table 5 Differences of leaf photosynthetic indexes between WT and atscamp
2.4 AtSCAMP基因在植物中的时空性表达特性
关于拟南芥AtSCAMP基因功能的报道非常少,笔者没有获得该基因影响植物叶形的可能调控机制信息。为了进一步了解该基因在植物中的表达特性,利用RT-PCR 方法对拟南芥中AtSCAMP的表达特性进行分析,结果表明:该基因在叶片中高表达,但是在根、茎、花中表达量非常低,表现出明显的组织特异性(见图2A~B)。对1~5周龄不同发育时期叶片中AtSCAMP基因表达量进行分析表明,该基因在1周龄幼苗叶片中几乎检测不到表达,随着植株发育,该基因在叶片中的表达量逐渐增加,到4~5周龄时,表达量达到最高值(见图2C~D)。
3 讨论
植物叶形受基因型控制,也受到激素互作的影响。在单子叶植物尤其是水稻中,越来越多与叶片形态相关的基因被克隆,对叶形形成的分子机制的了解逐步加深[10-12],但是关于双子叶植物这方面的报道非常有限。本研究从拟南芥突变体库中筛选获得1株新型叶片宽大突变体,进一步分析发现突变体植株突变位点发生在AT1G11180,该位点编码蛋白AtSCAMP。Genotyping 技术鉴定获得纯合突变体植株。研究表明atscamp突变体冠幅没有发生改变,但是叶片的宽度和叶面积极显著大于野生型植株,同时叶绿素荧光和光合相关指标显著高于野生型植株,这是极为少见的1个叶形突变体。
叶形性状的概念有两个方面,一类是直接影响作物生产性状的宽窄薄厚等方面的性状差异。它与植物同化能力、环境的适应性和光合作用能力等密切相关[27-28],本研究的突变体应该属于这一类型;第二类叶形性状是异形叶性状,植物叶形会随着环境条件的变化而变化,同一植株在不同环境下产生截然不同的叶形,而不同的叶形具有不同的响应环境变化的能力。异形叶是植物适应环境条件的现象。近年来,一些基因影响叶形态发育的分子机制研究也有重要进展。王利等[29]发现ASL25/LBD28基因的过量表达可导致转基因拟南芥的叶片变得狭长;Adal 等[30]发现在拟南芥植株中过表达AGAMOUS-like和SEPALLATA3-like,拟南芥叶片会出现卷曲现象。边界基因NAM/CUC调节叶缘发育[31],Vlad 等[32]在碎米荠(Cardamine hirsuta)中鉴定到1个影响叶边缘发育的基因RCO;Li等[33]在异叶水蓑衣(Hygrophila difformis)中探明了HdSTM在异形叶发育中的调控作用。AN3/AtGIF1和At-GRF5的功能缺失突变体出现窄叶表型[14-15],本研究中叶片宽大突变体的发现,为研究植物尤其是双子叶植物的叶形发育分子调控机理,提供了重要线索和研究思路,也展现出作物高光效品种创制方面的潜在应用价值。
SCAMP2是一种相对保守的膜蛋白,主要分布在一些膜上,例如某些细胞器的膜、分泌囊泡膜及细胞膜等,它通常在分拣蛋白、囊泡的形成及胞吞胞吐过程中发挥物质运输功能,比如在高尔基体转运途径中协助将物质进行跨细胞膜运输[34-35]。前人研究[21]表明,SCAMP2在叶中表达量高于根,本研究与其结果一致。荧光定量PCR 分析表明,随着植株发育,该基因在叶片中的表达量逐渐增加,到4~5 周龄时,表达量达到最高值;且叶绿素荧光和光合相关指标显著高于野生型植株。
本研究中,获得了1 个完全敲除的拟南芥atscamp突变体,表现出非常显著的叶片宽大表型,以及增强的光合能力。这是该蛋白家族功能研究的一个重要的新线索。在目前突变体线索的基础上,未来需要对该基因的功能进行进一步的验证,并尝试在双子叶植物尤其是在十字花科(Brassicaceae)作物中寻找该基因的同源基因并证实其功能,为高光效作物品种创制方面提供理论支撑。

