鸭坦布苏病毒单克隆抗体的制备和治疗效果分析
王丹娜,乌 兰,李 三
[ 兆丰华生物科技(南京)有限公司北京生物医药科技中心,北京 大兴 102600 ]
鸭坦布苏病毒病是由鸭坦布苏病毒(Duck tembusu virus,DTMUV)引起一种急性、病毒性传染病,发病鸭主要出现角弓反张、站立不稳和瘫痪,而产蛋鸭感染后则出现产蛋率下降、卵泡破裂出血和卵黄性腹膜炎等[1-2]。2010年,我国南方地区鸭群首次发生了鸭坦布苏病毒病,随后,全国各地陆续出现关于该病的相关报道[3-4]。目前,DTMUV已在我国全国范围内广泛流行,严重威胁着养鸭业的健康发展[5-6]。DTMUV属于黄病毒科、黄病毒属的单股正链RNA病毒,其基因组约为11 000 bp,可编码1个大多聚蛋白,在自身和宿主细胞酶的作用下,可分为3种结构蛋白(E、prM和C)和7种非结构蛋白(NS1、NS2a、NS2b、NS3、NS4a、NS4b和NS5)。E蛋白位于DTMUV表面,包括了DTMUV的主要中和表位,可诱导机体产生中和抗体[7]。
由于坦布苏病毒病灭活疫苗或弱毒疫苗的广泛应用,该病已经在我国大部分地区得到有效防控,但在我国部分地区免疫鸭群中仍在流行,主要是由于DTMUV疫苗毒株与新流行毒株交叉保护性较差,保护不够全面[8-10]。因此,迫切需要一种新技术、新思路来弥补疫苗免疫存在的不足。具有中和活性的单克隆抗体[11-14]被认为是一种具有广阔应用前景的治疗鸭坦布苏病毒病的方式。本试验旨在制备和筛选出对DTMUV具有高度中和作用的单克隆抗体,不仅在生产实践中可用于紧急预防和治疗DTMUV感染,还可以用于研制抗独特型抗体疫苗和进行中和表位鉴定,减少甚至阻断DTMUV在国内的传播流行。
1 材料与方法
1.1 主要材料和试剂 pET-30a质粒、大肠杆菌(Escherichia.coli)DH 5α感受态、E.coliBL 21(DE3)感受态和T4连接酶,均购自宝日医生物技术(北京)有限公司;限制性内切酶EcoR I和XhoI,均购自New England Bio Labs公司;质粒小提试剂盒,购自爱思进生物技术(杭州)有限公司;辣根过氧化物酶(Horseradish peroxidase,HRP)标记的山羊抗小鼠IgG,购自KPL公司;蛋白质分子量Marker,购自富酶泰斯生物技术(深圳)有限公司;DAB显色液,购自北京中杉金桥公司;完全弗氏佐剂和不完全弗氏佐剂,均购自Sigma公司;TRIzol、反转录试剂盒和pMD-18T载体,均购自Invitrogen公司;胶回收试剂盒,购自天根生化科技(北京)有限公司;镍柱亲和层析纯化柱,购自南京金斯瑞生物科技有限公司;TrueBlue,购自武汉纯度生物科技有限公司;低熔点琼脂糖,购自Solarbio公司;鸭A型肝炎病毒、呼肠孤病毒、新城疫病毒、细小病毒、H9亚型禽流感病毒和BHK21细胞(乳仓鼠肾细胞),均来自兆丰华生物科技(南京)有限公司北京生物医药科技中心。
1.2 主要仪器和设备 CO2细胞培养箱、Multiskan SkyHigh 酶标仪购和生物安全柜,均购自Thermo Fisher;倒置显微镜,购自日本Olympus;离心机,购自 Eppendorf;蛋白质电泳仪,购自美国伯乐。
1.3 实验动物 SPF级BALB/c小鼠,6周龄,雌性,购自斯贝福(北京)生物技术有限公司,生产许可证号:SCXK(京)2019—0010。
1.4 DTMUVE基因的PCR扩增 本试验所用DTMUV河北株(HB)分离自某发生产蛋下降鸭群的病死鸭。根据GenBank中登录的DTMUVE基因序列,设计并合成1对特异性引物,即PEF:5′-AT-GAATTCTTCAGCTTCTGGGGATGCAG-3′(划线部分为引入EcoR Ⅰ)和PER:5′-ATCTCGAGTAAGGC-ATTGACATTTACTGCC-3′(划线部分为引入XhoⅠ)。RNA的提取参照TRIzol说明书进行,反转录反应总体积为20 μL:RNA 8 μL,dNTP 2 μL,随机引物2 μL,于99 ℃变性5 min,冰中快速冷却,再加入反转录酶AMV 1 μL,5×AMV 缓冲液4 μL,超纯水3 μL,42 ℃ 作用60 min,然后75 ℃ 15 min。以反转录产物cDNA为模板进行PCR扩增。PCR反应体系(100 μL):10×Ex-Taq缓冲液10 μL,2.5 mmol/L dNTP 6 μL,cDNA 2 μL,引物各1 μL,Ex-TaqDNA聚合酶0.5 μL,超纯水79.5 μL。PCR反应条件:94 ℃ 5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1.5 min,32个循环,72 ℃延伸10 min,4 ℃保存。
1.5 E蛋白的表达和纯化 利用胶回收试剂盒纯化与预期大小相符的DTMUVE基因PCR扩增产物,并连接至pMD-18T载体,转化至E.coliDH5α感受态,质粒小提试剂盒提取质粒,限制性内切酶EcoR I和XhoⅠ进行双酶切鉴定,与预期相符的质粒送往生工生物工程(上海)股份有限公司进行核苷酸序列测定,阳性重组质粒命名为“pMD-E”。将重组质粒pMD-E和质粒pET-30a分别经EcoR I和XhoⅠ双酶切,利用胶回收试剂盒分别回收E基因和酶切后的pET-30a。在T4连接酶作用下,将E基因连接至pET-30a载体,连接产物转化E.coliDH5α感受态,质粒小提试剂盒提取质粒,经EcoR I和XhoⅠ双酶切,1%琼脂糖凝胶电泳下观察鉴定结果,鉴定正确的重组质粒命名为“pET30-E”。将重组质粒pET30-E转化E.coliBL21(DE3),37 ℃振荡培养至对数生长期时,加入终浓度为1 mmol/L的异丙基-β-D-硫代半乳糖苷(Isopropyl-β-D-thiogalactoside,IPTG)进行诱导,十二烷基硫酸钠聚丙烯酰胺凝胶电泳(Sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)分析诱导产物。将诱导的蛋白菌体离心,加入8 mol/L尿素溶解沉淀,离心取上清,按照镍柱亲和层析纯化柱说明书进行E蛋白的纯化。
1.6 杂交瘤细胞株的获得 将经纯化的E蛋白与等体积弗氏不完全佐剂混合、乳化,按照E蛋白100 μg/只的剂量腹腔注射6周龄雌性BALB/c小鼠,间隔2周,将E蛋白与弗氏完全佐剂等体积混合、乳化,按照E蛋白100 μg/只的剂量加强免疫,间隔3周,再按照加强免疫剂量免疫1次,间隔2周,尾静脉采血,采用酶联免疫吸附(Enzyme-linked immunosorbent assay,ELISA)测定E蛋白抗体水平。无菌取小鼠的脾脏,分离脾细胞,在聚乙二醇(Polyethylene glycol,PEG)作用下将脾细胞与SP2/0细胞进行融合。利用建立好的ELISA方法检测融合细胞上清中E蛋白抗体,以SP2/0细胞上清作为阴性对照,将抗体阳性的细胞孔及时亚克隆至杂交瘤细胞生长孔,筛选至抗体阳性率达100%为止。
1.7 单克隆抗体的制备和鉴定 将灭菌的石蜡油经腹腔注射小鼠,1周后再注入杂交瘤细胞,生成腹水后抽取腹水。利用Western blot进行腹水中的E蛋白单克隆抗体的鉴定,将表达的DTMUV E蛋白和pET-30a空载体诱导的蛋白(作为空白对照)进行SDS-PAGE,转印至硝酸纤维素膜,以1 000倍稀释的腹水为一抗,5 000倍稀释的HRP标记山羊抗小鼠IgG为二抗。利用间接免疫荧光法对DTMUV、鸭A型肝炎病毒、呼肠孤病毒、新城疫病毒、细小病毒和H9亚型禽流感病毒感染的细胞进行检测。
1.8 蚀斑减少中和试验(Plaque reduction neutralization test,PRNT) 利用Protein G亲和层析柱对单克隆抗体进行纯化。以非中和的同型对照单克隆抗体作为阴性对照。将纯化的单克隆抗体连续10倍倍比稀释加入到约100 PFU的DTMUV中,并在37 ℃孵育1 h,然后将混合物(200 μL/孔)添加到BHK-21单层细胞中,37 ℃孵育1 h。去除上清,然后将300 μL 1%(W/V)低熔点琼脂糖[2%(W/V)低熔点琼脂糖和含4%(V/V)FBS的2×DMEM培养基按照1∶1等体积混合]铺在细胞表面,37 ℃再培养4 d后,用TrueBlue进行染色,记录蚀斑数,使用Reed-muench法计算50%蚀斑减少中和滴度(50% plaque reduction neutralization antibody titer,PRNT50)。
1.9 小鼠保护试验 使用SPF级BALB/c小鼠评估制备的具有中和作用的单克隆抗体对DTMUV感染的保护效果。将105只BALB/c小鼠平均分为7个组,每组15只,第1~5组为治疗组,第6组为攻毒对照组,第7组为空白对照组。第0天(在0 dpi)用100 PFU DTMUV HB株病毒液经脑内感染第1~6组小鼠,第7组注射相同体积的PBS;第1~5组分别于感染后1、2、3、4和5 d,将单克隆抗体按照20 mg/(kg·bw)剂量肌肉注射小鼠,连续观察14 d,记录小鼠的体重变化、临床症状和死亡数量。收集感染小鼠的血清,同1.8操作,在BHK-21细胞中测定DTMUV蚀斑数并分析中和抗体水平。
2 结果
2.1 E蛋白的克隆、表达和纯化 利用引物PEF和PER进行PCR扩增,琼脂糖凝胶电泳观察获得约1 503 bp的特异条带(图1A),与E基因预期片段大小相同。E基因与载体pET-30a连接后制备重组质粒,经EcoR I和XhoⅠ双酶切后,可见约5 700和1 500 bp的目的条带(图1B),与预期结果相符,表明成功获得重组质粒pET30-E。pET30-E经IPTG诱导后的SDS-PAGE电泳结果显示,与空白对照相比较,含重组质粒pET30-E的E.coliBL21(DE3)裂解后沉淀物中出现分子量约65 kDa的蛋白条带(图2A),与预期结果相符。经镍柱亲和层析纯化后,在分子量约为65 kDa处出现唯一条带(图2B),与预期结果相符。

图1 重组质粒pET30-E的鉴定

图2 重组E蛋白的表达和纯化
2.2 单克隆抗体的鉴定 经3次亚克隆,通过ELISA筛选获得可稳定分泌单克隆抗体的杂交瘤细胞株,获得1株单克隆抗体,为4A1。Western blot结果显示,4A1株单克隆抗体能与原核表达的65 kDa大小的E蛋白特异性结合(图3),而与空白对照没有发生反应,说明单克隆抗体针对目的E蛋白,排除了针对His标签的可能性。间接免疫荧光结果显示,4A1株单克隆抗体可以与DTMUV感染36 h后的BHK-21细胞发生免疫反应(图4),而与鸭A型肝炎病毒、呼肠孤病毒、新城疫病毒、细小病毒和H9亚型禽流感病毒感染的BHK-21细胞无交叉反应(图略)。

图3 单克隆抗体的Western blot鉴定

图4 单克隆抗体的间接免疫荧光鉴定(100×)
2.3 单克隆抗体4A1蚀斑减少中和试验 结果显示,PRNT50浓度为(0.32±0.10) μg/mL时,单克隆抗体4A1能有效中和DTMUV。
2.4 单克隆抗体4A1小鼠保护试验 结果显示,第6组小鼠在DTMUV人工感染4 d后开始表现厌食、精神沉郁和后肢瘫痪等典型临床症状,在感染5 d后,小鼠开始出现死亡,总死亡率达60.0%(9/15);第1、2、3组分别在DTMUV感染1、2和3 d后使用单克隆抗体4A1治疗,小鼠未见明显的临床症状,全部存活;第4、5组分别在DTMUV感染4和5 d后使用单克隆抗体4A1治疗,小鼠的死亡率分别为20.0%(3/15)和53.3%(8/15)。
小鼠体重变化方面,第6组小鼠在DTMUV感染后4 d出现体重下降,并持续至感染后10 d,体重从降低原体重的5.42%变化至降低原体重的36.16%;第1~3组小鼠的体重无明显变化,和第7组相比无差异;第4、5组小鼠体重分别减轻了原体重的1.50%~9.78%和2.12%~18.97%(图5)。

图5 各组小鼠体重变化
血清中DTMUV病毒滴度测定结果显示,第6组小鼠在DTMUV感染后4 d血清中病毒滴度最高;第1、2、3组小鼠分别在DTMUV感染后1、2和3 d使用单克隆抗体4A1治疗,小鼠血清中DTMUV滴度逐渐降低(图6)。
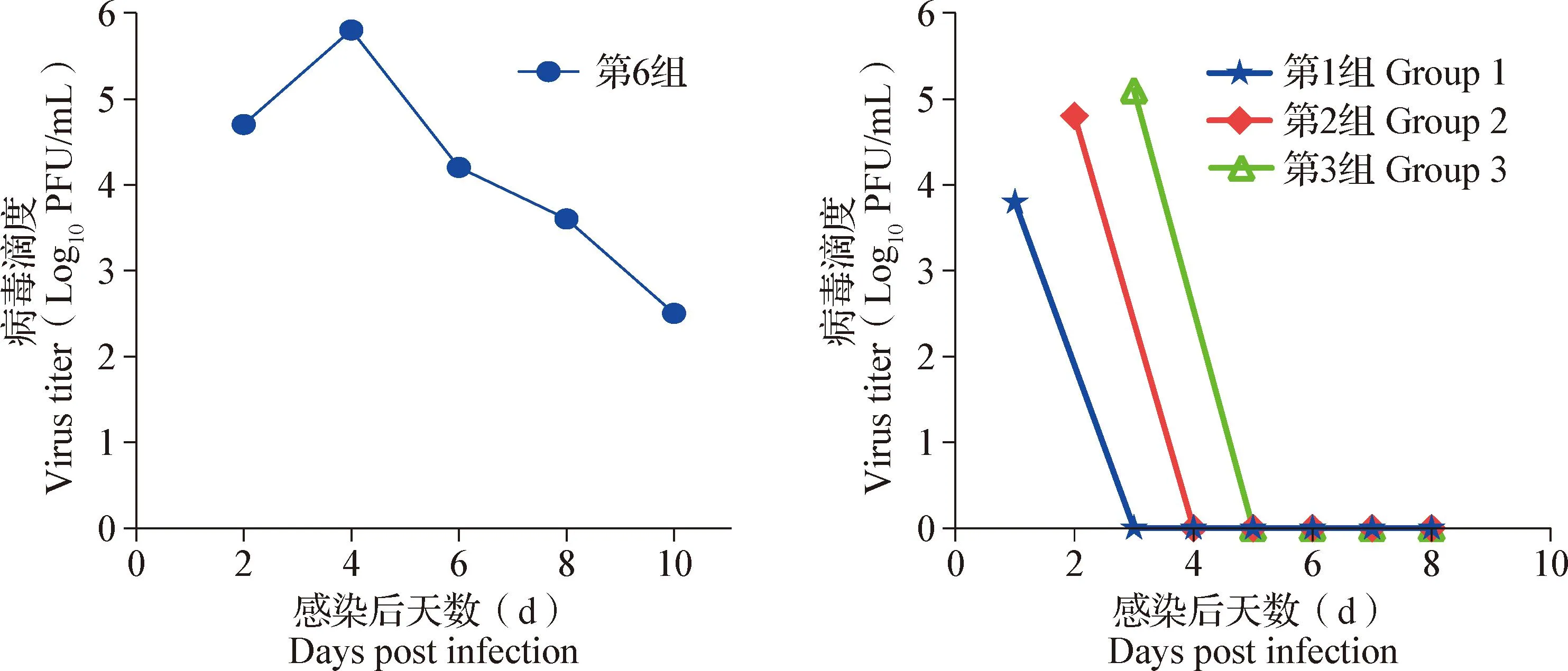
图6 感染小鼠血清中DTMUV滴度
3 讨论
DTMUV与大多数黄病毒属病毒相同,E蛋白被认为是其主要保护性抗原,可诱导机体产生中和抗体。本试验以原核表达的E蛋白作为抗原免疫小鼠,将脾细胞与SP2/0细胞融合后,筛选出特异性强、对DTMUV具有中和作用的单克隆抗体4A1。
抗体在机体内发挥综合作用,表现在通过与病毒结合,进而清除病毒和阻碍病毒扩散。小鼠保护试验结果显示,单克隆抗体4A1能够100%保护DTMUV感染的BALB/c 小鼠,可完全清除小鼠血液中的DTMUV,具有明确的治疗作用。
目前,虽然没有DTMUV引发人类疾病的报道,但最近的调查证实,在鸭养殖场工作人员体内可检测到DTMUV抗体和DTMUV RNA[6,15]。另外,动物模型试验还证明,DTMUV对小鼠具有年龄依赖性的神经侵袭破坏作用[16],DTMUV可介导所有黄病毒所引发的抗体依赖增强(Antibody-dependent enhancement,ADE)感染疾病的严重性[17],对人类存在潜在的生物安全风险。坦布苏病毒病仍然是对鸭养殖业危害最大的传染病之一,不仅给鸭养殖业造成重大经济损失,还可造成鹅和鸡等的感染发病[18-19]。尽管我国广泛使用各种坦布苏病毒病疫苗进行免疫,但仍未完全控制该病的局部发生和流行。与传统疫苗免疫相比,4A1对于DTMUV的特异性更强,能够快速识别DTMUV并与之结合,可在较短的时间内清除体内的DTMUV,能够更好的应对该病流行,对实际生产中DTMUV感染的控制具有积极意义。但该4A1单克隆抗体由于是在小鼠中制备,在鸭群使用过程中可能存在潜在的免疫排斥问题。

