降钙素介导CD36、IL-17的表达对创伤性骨关节炎的影响
曾锦威 黄浩 何元平
创伤性骨关节炎是一种发生于韧带损伤、半月板损伤或骨折后的骨关节炎[1]。关节内骨折、运动性损伤、骨关节炎等疾病的主要病理改变为关节软骨损伤[2]。至今,人们对软骨损伤后的自然演变过程和创伤性骨关节炎的发病机制的了解还不够深入。研究发现,骨关节炎的进展与损伤软骨细胞外基质的酶降解引发的炎症有关[3]。随着软骨下骨在关节疾病中的作用越来越受到专家学者的关注,针对软骨下骨细胞外基质降解的药物越来越多地被应用于创伤性骨关节病的治疗。降钙素是一种有效的破骨细胞骨吸收抑制剂,已广泛应用于骨质疏松症的治疗[4]。柏明晓[5]研究发现,降钙素能促进软骨分泌糖氨多糖和Ⅱ型胶原(typeⅡ collagen,Col Ⅱ),或抑制这2 种物质的分解,并与基质金属蛋白酶3(matrix metalloproteinase 3,MMP3)、基质金属蛋白酶9(matrix metalloproteinase 9,MMP9)、基质金属蛋白酶13(matrix metalloproteinase 13,MMP13)等蛋白的表达水平的增加关系密切。在本研究中,以人软骨细胞为研究对象,通过白介素-1β(interleukin-1β,IL-1β)诱导建立软骨细胞损伤模型,探讨降钙素对软骨细胞损伤的保护作用,并进一步研究其可能的分子机制。此文的研究结果为创伤性骨关节炎后期标准制定提供了借鉴内容,以期为创伤性骨关节炎的深入研究及临床应用提供参考。
1 资料与方法
1.1 一般资料
2022年7月21日—11月10日于广东医瑞贝生物医学科技有限公司进行实验。试验材料及来源:人软骨细胞(Cell Applications 公司,美国),胎牛血清、杜氏改良Eagle培养基(Dulbecco's modified eagle medium,DMEM)培养基(武汉普诺赛生命科技有限公司,中国),青霉素-链霉素、PBS 缓冲液(Hyclone 公司,美国),IL-1β(北京索莱宝科技有限公司,中国),降钙素[华中海威(北京)基因科技有限公司,中国],FITC anti-human CD36 抗体(BioLegend公司, 美国),CCK-8 试剂盒(cell counting kit CCK 8,CCK-8)(上海碧云天生物技术有限公司,中国),丙二醛(malondialdehyde,MDA)试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒(南京建成生物科技有限公司,中国),SYBR Green qPCR SuperMix 试剂盒(Invitrogen 公司,美国),NOD 样受体热蛋白结构域相关蛋白3(NOD-like receptor heat protein domain associated protein 3,NLRP3)一抗(CST 公司,美国),消皮素D(gasdermin-D,GSDMD)一抗、GSDMD-N 一抗(Abcam 公司,美国),蛋白酶抑制剂(Sigma 公司,美国),磷酸酶抑制剂、BCA 法蛋白含量检测试剂盒(江苏凯基生物技术股份有限公司,中国),荧光二抗(Southern biotech,美国)。
1.2 方法
1.2.1 细胞培养
将人软骨细胞用含10%胎牛血清、100 IU/mL 青霉素-链霉素的DMEM 培养基,在37 ℃、5% CO2的湿润环境中培养,选取第3 代细胞进行后续实验。
1.2.2 筛选降钙素最佳浓度
将对数生长期的人软骨细胞以1×105个/cm2的密度接种于不含胎牛血清的DMEM 培养基中饥饿处理24 h,再将人软骨细胞与浓度为10 ng/mL IL-1β 共同孵育30 min 建立创伤性骨关节炎细胞模型。用0.1、0.5、1、5、10、50 nM 5 个浓度的降钙素处理细胞24 h。通过CCK-8 检测与乳酸脱氢酶(lactate dehydrogenase,LDH)细胞毒性测定筛选出降钙素最佳作用浓度进行后续实验,其他不使用降钙素进行治疗的细胞加入等量生理盐水作为对照。
1.2.3 CCK-8 法检测细胞增殖活性
将细胞以1×104个/孔的密度接种于96 孔板,室温下培养过夜。3 组细胞分别经过处理培养0、24、48 和72 h 时,将细胞悬浮于90 µL培养基中,每孔加入10 µL CCK-8溶液,处理继续培养4 h,通过酶联免疫检测仪记录450 nM 光密度下的读数评估细胞增殖能力。
1.2.4 细胞处理
按照处理方式的不同将细胞分为3 组,其中,对照组:人软骨细胞用含10%胎牛血清、100 IU/mL 青霉素-链霉素的DMEM 培养基正常培养。疾病组:人软骨细胞用不含胎牛血清的DMEM 培养基饥饿处理24 h,再与10 ng/mL 浓度的IL-1β 共同孵育30 min。治疗组:人软骨细胞用不含胎牛血清的DMEM 培养基饥饿处理24 h,再与10 ng/mL 浓度的IL-1β 共同孵育30 min,然后用筛选出的最佳作用浓度的降钙素处理24 h。
1.2.5 流式细胞术分析各组CD36 和活性氧簇(reactive oxygen species,ROS)表达
将各组细胞用胰蛋白酶消化并重悬细胞,经PBS 充分洗涤细胞2 次后,用培养基调整细胞浓度为1×107/mL,每管加入100 µL 细胞,再向管中加入5 µL 抗体,室温,避光,反应30 min,用PBS 洗涤2 次,通过流式细胞仪观察荧光强度,分析CD36 和ROS 的表达情况。
1.2.6 酶标法检测各组细胞SOD 和MDA 水平
离心后收集细胞,用含有蛋白酶抑制剂的裂解缓冲液裂解细胞,收集上清液。根据制造商的说明分别采用硫代巴比妥酸法和羟胺法检测各组细胞MDA 和SOD 的含量。
1.2.7 实时荧光定量聚合酶链反应(quantitative realtime polymerase chain reaction,qRT-PCR)检测mRNA 的相对表达量
使用总RNA 提取试剂盒,按说明书要求提取总RNA,再使用逆转录酶试剂盒进行逆转录,通过SYBR Green 实时PCR 对样品进行扩增。以GAPDH 为内参,采用2-ΔΔCt法计算降钙素、白介素-17(interleukin17,IL-17)、MMP13、Col Ⅱ的相对表达量。
1.2.8 蛋白印迹法(Western blot)检测蛋白的相对表达量
收集各组细胞,提取细胞内总蛋白并用蛋白定量试剂盒测定浓度。蛋白通过PAGE 聚丙烯酰氨凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electropheresis,SDSPAGE)电泳分离后转移到聚偏氟乙烯膜上,用5%脱脂奶粉溶液室温封闭2 h,加1 ∶1 000 稀释的NLRP3、GSDMD、GSDMD-N 和GAPDH 一抗。4 ℃过夜后,用含有辣根的过氧化物酶偶联二抗室温孵育2 h,将化学荧光发光底物加到膜的表面,对蛋白条带进行灰度扫描、定量,蛋白表达水平根据GAPDH 进行标化。
1.3 统计学处理
采用SPSS 26.0 统计学软件进行数据分析。计量资料以(±s)表示,组间比较采用独立样本均数t检验,3 组比较使用F检验;基因间相关性研究采用Pearson 分析。检验水准α=0.05。
2 结果
2.1 CCK-8 法筛选降钙素最佳作用浓度结果
采用0.1、0.5、1、5、10、50 nM 5 个浓度的降钙素分别处理人软骨细胞24 h,结果发现随着降钙素浓度的增加,人软骨细胞的活力逐渐升高,这种变化具有浓度依赖性,因此选择50 nM 浓度的降钙素作为治疗组进行后续实验。见图1。
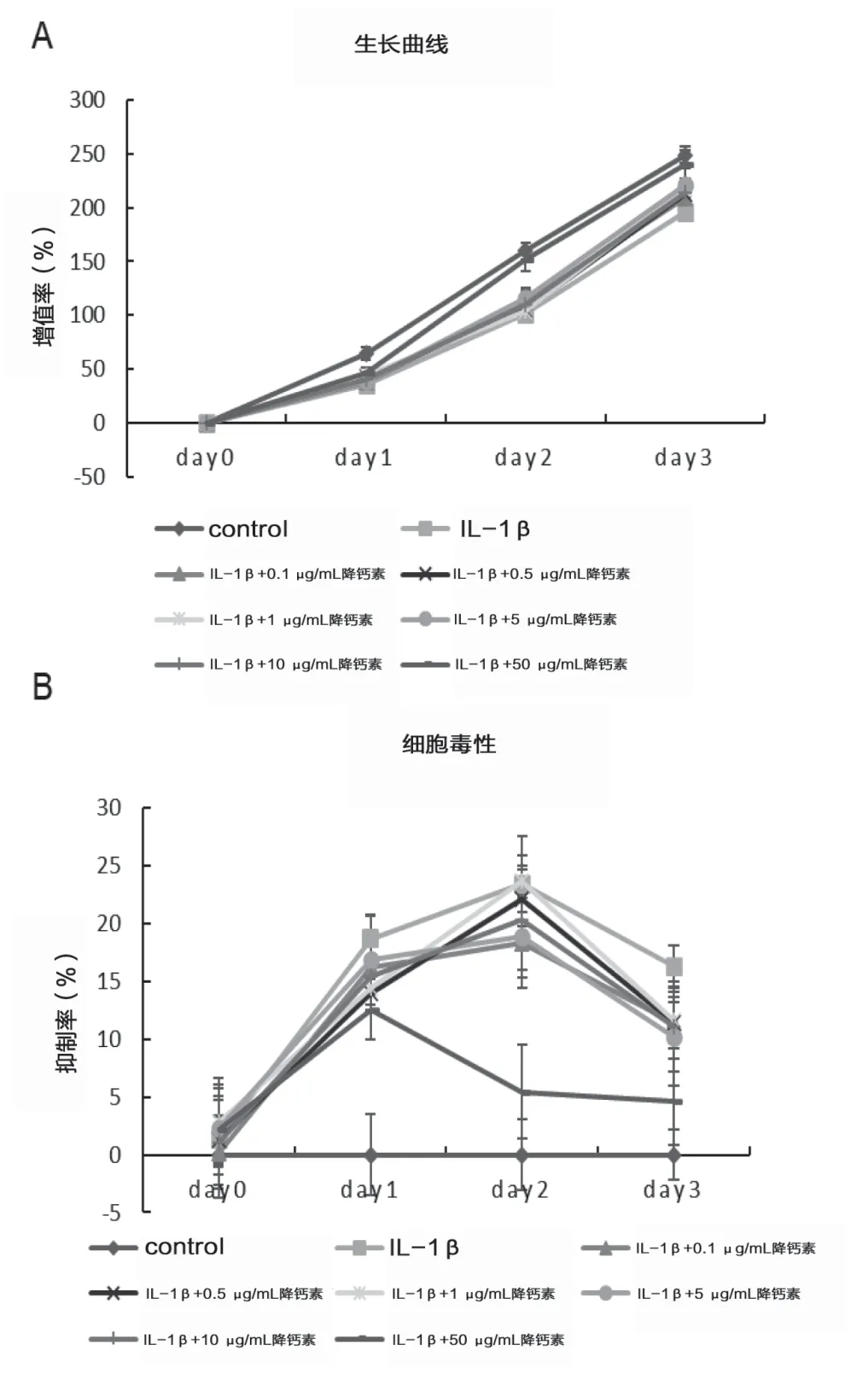
图1 不同浓度降钙素对人软骨细胞增殖活性和细胞毒性的影响。
2.2 降钙素对IL-1β 诱导的人软骨细胞软骨退化相关因子的影响
与对照组比较,疾病组人软骨细胞肥大标志物MMP13的mRNA 相对表达量升高,而软骨形成标志物Col Ⅱ的mRNA 相对表达量降低(P<0.05)。但在降钙素治疗后人软骨细胞软骨退化得到了缓解,与疾病组比较,治疗组人软骨细胞MMP13 的mRNA 表达降低,同时Col Ⅱ的mRNA表达升高(P<0.05)。见表1。
表1 降钙素对IL-1β 诱导的人软骨细胞中MMP13、Col Ⅱ含量的影响(±s)

表1 降钙素对IL-1β 诱导的人软骨细胞中MMP13、Col Ⅱ含量的影响(±s)
注:与对照组比较,①P <0.05;疾病组MMP13 的mRNA 相对表达量、Col Ⅱ的mRNA 相对表达量与对照组比较,t =10.312、8.380,P =0.002、0.001。与疾病组比较,②P <0.05;治疗组MMP13 的mRNA 相对表达量、Col Ⅱ的mRNA 相对表达量与疾病组比较,t =18.730、7.878,P <0.001、P =0.001。
组别MMP13 mRNA(相对表达量)Col Ⅱ mRNA(相对表达量)对照组(n =8)1.00±0.091.00±0.09疾病组(n =8)2.23±0.19①0.47±0.06①治疗组(n =8)0.19±0.03②1.83±0.16②F 值216.800113.700 P 值<0.001<0.001
2.3 降钙素对IL-1β 诱导的人软骨细胞氧化应激水平的影响
与对照组比较,IL-1β 处理使人软骨细胞中的ROS 的平均荧光强度(mean fluorescence intensity,MFI)及MDA含量增加,同时伴随SOD 活力的下降(P<0.05)。然而,与疾病组比较,降钙素处理细胞后,ROS 的MFI 及MDA含量下降,且SOD 活力增强(P<0.05)。见表2。
表2 降钙素对IL-1β 诱导的人软骨细胞中ROS、MDA、SOD 含量的影响(±s)

表2 降钙素对IL-1β 诱导的人软骨细胞中ROS、MDA、SOD 含量的影响(±s)
注:与对照组比较,①P <0.05;疾病组ROS(MFI)、MDA、SOD 与对照组比较,t =46.970、8.049、6.460,P <0.001、P =0.001、P =0.003。与疾病组比较,②P <0.05;治疗组ROS(MFI)、MDA、SOD 与疾病组比较,t =33.623、6.369、4.670,P<0.001、P =0.003、P =0.010。
组别ROS(MFI)MDA(nmol/mL)SOD(U/mL)对照组(n =8)1 192.21±15.105.85±0.56242.33±21.17疾病组(n =8)2 026.45±26.80①13.93±1.64①151.14±12.26①治疗组(n =8)1 404.34±17.58②7.14±0.83②214.23±19.93②F 值1 348.00045.62019.710 P 值<0.001<0.001<0.001
2.4 降钙素对IL-1β 诱导的人软骨细胞炎症反应标志物的影响
与对照组比较,疾病组人软骨细胞中炎症反应标志物NLRP3 和GSDMD 的蛋白表达水平上升,而GSDMD-N 蛋白表达水平下降(P<0.05)。然而,降钙素治疗后,人软骨细胞中NLRP3 和GSDMD 的蛋白表达受到抑制,而GSDMD-N 的蛋白表达则上升(P<0.05)。见图2。
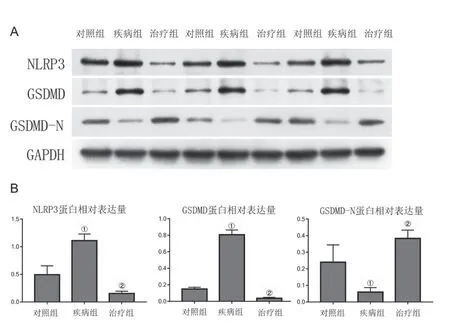
图2 降钙素对IL-1β 诱导的人软骨细胞炎症反应标志物的影响。A:Western blot检测降钙素对IL-1β 诱导的人软骨细胞炎症反应标志物蛋白的影响;B:降钙素对IL-1β 诱导的人软骨细胞炎症反应标志物蛋白影响的量化;与对照组比较,①P <0.05;与疾病组比较,②P <0.05。
2.5 降钙素对IL-1β 诱导的人软骨细胞CD36 与IL-17 表达的影响
与对照组比较,疾病组的CD36 阳性率降低;同时,IL-17 的mRNA 相对表达量升高(P<0.05)。但是,降钙素治疗后可缓解这些改变,与疾病组比较,治疗组细胞中CD36 阳性率升高,而IL-17 的mRNA 相对表达量受到抑制(P<0.05)。见表3。
表3 降钙素对IL-1β 诱导的人软骨细胞CD36 与IL-17 表达的影响(n =8, ±s)

表3 降钙素对IL-1β 诱导的人软骨细胞CD36 与IL-17 表达的影响(n =8, ±s)
注:与对照组比较,①P <0.001;疾病组CD36 阳性率、IL-17 的mRNA 相对表达量与对照组比较,t =13.974、10.700,P <0.001。与疾病组比较,②P <0.001;治疗组CD36 阳性率、IL-17 的mRNA 相对表达量与疾病组比较,t =13.512、16.610,P <0.001。
组别CD36 阳性率(%)IL-17 mRNA(相对表达量)对照组1.50±0.161.00±0.11疾病组0.17±0.02①2.58±0.24①治疗组11.20±1.23②0.34±0.03②F 值210.900180.300 P 值<0.001<0.001
2.6 降钙素与CD36、IL-17 表达的相关性
通过Pearson 分析降钙素与CD36、IL-17 之间的相关性。结果显示,降钙素与CD36 呈正相关(r=0.922,P=0.001),与IL-17 呈负相关(r=-0.881,P=0.002)。另外,同样通过Pearson 分析探讨CD36 与IL-17 的相关性,结果显示两者的表达水平呈负相关(r=-0.650,P=0.023)。
3 讨论
透明软骨、纤维软骨和弹性软骨在人体中发挥多种作用,包括在关节和椎间盘中承受载荷,提供关节润滑,形成外耳和鼻子,支撑气管,并在发育和生长过程中形成长骨[6]。因为软骨的摩擦力比较小,很容易在运动中因为破裂而受伤。作为骨关节炎的常见类型之一,创伤性骨关节炎的主要特征就是软骨损伤,而软骨组织自我修复能力较差,一旦损伤很难自然愈合[1-2]。软骨和关节损伤容易使软骨退化,转变为骨关节炎,严重影响人类的生活和工作,目前尚无治愈方法[7]。研究发现,软骨和关节损伤时伴随多个微环境的变化,包括炎症、骨重塑、血管、神经的出现以及细胞外和细胞周围基质、氧张力、生物力学、关节软骨组织下、pH 值的改变[8]。
目前临床对于创伤性骨关节炎的治疗多以镇静、止痛、抗感染等药物治疗为主,然而这些方法只能短期改善关节功能,停药后易复发,且后期可能会导致软骨退化[7,9]。降钙素是由甲状腺滤泡旁细胞分泌的激素,其能够通过降低血钙水平,抑制破骨细胞介导的骨吸收,从而降低骨折的发生率,刺激成骨细胞的形成并增加其活性[10]。细胞外基质是由软骨细胞合成分泌并起着保护软骨细胞的屏障作用。王康等[11]研究发现,关节软骨细胞外基质合成和失衡是引起创伤性骨关节病的重要原因之一。作为细胞外基质的两大主要成分之一,ColⅡ是关节软骨中的主要结构蛋白,其在维持软骨的生物力学功能方面具有重要的作用[12]。MMP13 是一种依赖于Zn2+的蛋白酶,催化Col Ⅱ的裂解,过多的MMP13活性导致骨关节炎的软骨退化,使这种蛋白酶成为一个有吸引力的治疗靶点[13-14]。本研究发现,降钙素治疗后IL-1β 诱导的软骨细胞的增殖能力升高,MMP13 的mRNA 表达降低,同时Col Ⅱ的mRNA 表达升高。这些结果证实降钙素有助于创伤性骨关节炎软骨细胞活力恢复,抑制软骨细胞退化。
ROS 已被确定为炎症的关键调节因子,控制氧化应激和抗氧化酶活性,从而促进炎症活性的增加[15]。当ROS 的产生速度快于关节软骨清除活性氧的速度时,关节软骨就会受到氧化应激的影响。在创伤性骨关节炎的背景下,软骨中氧化应激水平高,导致慢性炎症,这反过来又可以驱动滑膜炎症、关节内病变形成、软骨细胞合成代谢处理和软骨变性[16]。CD36 其广泛存在于多种组织细胞中,在多个生理过程中参与细胞的清除。同时,CD36 被多种炎症因子抑制其表达,目前已成为间接研究炎症反应的热点[17-18]。IL-17 是T 细胞诱导的炎症反应的早期启动因子,可以通过促进释放前炎症细胞因子来放大炎症反应。冯方等[19]研究发现,膝骨关节炎患者关节滑液中IL-17 的水平高于健康患者,且IL-17 的水平与膝关节VAS 评分呈正相关(r=0.914,P<0.01),即IL-17 可反映膝骨关节炎患者疼痛程度及功能损伤程度,临床通过减少关节滑液中IL-17,可能会减轻膝骨关节炎患者的临床症状。本研究通过检测软骨细胞氧化应激相关因子及炎症反应标志物的变化来探讨降钙素的作用机制。实验发现,人软骨细胞经IL-1β 损伤后CD36 阳性率、SOD 活力及GSDMD-N 蛋白表达降低,同时MMP13 和IL-17 的mRNA 相对表达量、NLRP3 和GSDMD 的蛋白表达水平、ROS 的MFI 及MDA 的含量升高。然而,降钙素治疗能够逆转上述指标的变化。所有结果表明降钙素对软骨细胞的保护机制可能与抑制IL-17 的表达,增强CD36 的表达及缓解软骨细胞的应激炎症反应有关。
综上所述,本研究结果阐明降钙素对IL-1β 诱导的软骨细胞损伤具有保护作用,其有助于创伤性骨关节炎软骨细胞活力恢复,抑制软骨细胞退化,缓解软骨细胞的应激炎症反应,其机制与抑制IL-17 的表达,增强CD36 的表达有关。该研究为软骨损伤的深入研究及降钙素治疗软骨损伤的临床应用提供参考。

