基于网络药理学和分子对接挖掘黑骨藤治疗强直性脊柱炎的作用机制
马熙 李浩 凌益 马武开
【摘 要】目的:運用网络药理学技术研究黑骨藤治疗强直性脊柱炎的作用机制。方法:通过检索文献和TCMSP数据库获取黑骨藤的活性成分信息。疾病靶点基因由DISGENET数据库和GeneCards数据库获得,通过瑞士目标预测数据库预测药物成分靶点,借助cytoscape软件构建“中药-化合物-靶点”网络,使用STRING在线平台下载靶点相互作用数据,构建PPI蛋白相互作用网络,挖掘核心靶点;运用DAVID平台对所预测核心靶点网络中的蛋白进行GO功能富集分析、KEGG通路富集分析。最后将筛选出的主要活性成分与核心靶点在pymol、autotool等软件下完成分子对接。结果:筛选出黑骨藤12个有效成分及422个药物靶点,与强直性脊柱炎交集靶点71个,其主要成分有异丙基二烯酚、汉黄芩素、山奈酚等,核心靶点是STAT3、MAPK1、MAPK14、JAK2、JAK1等。GO功能和KEGG通路分析获得主要通路:参与生长激素信号通路JAK-STAT级联反应、JAK-STAT级联、STAT蛋白的酪氨酸磷酸化、Th17细胞分化、Th1和Th2细胞分化等。分子对接显示,成分与靶点都可有效结合,汉黄芩素与JAK1结构最优。
结论:从网络药理学角度预测了黑骨藤对强直性脊柱炎的治疗作用,主要以汉黄芩素、山奈酚等有效成分,作用于JAK1、JAK2等靶点,通过JAK/STAT、MAPK等信号通路实现,为后续研究奠定了的基础。
【关键词】 强直性脊柱炎;黑骨藤;网络药理学;分子对接;靶点
Exploring the Action Mechanism of Periploca Forrestii in Treating Ankylosing Spondylitis Based on Network Pharmacology and Molecular Docking
MA Xi,LI Hao,LING Yi,MA Wu-kai
【ABSTRACT】Objective:To study the action mechanism of Periploca forrestii in the treatment of ankylosing spondylitis using network pharmacology technology.Methods:The active ingredient information of Periploca forrestii was retrieved through literature search and TCMSP database.The disease target genes were obtained from the DISGENET database and GeneCards database,and drug component targets were predicted using the Swiss target prediction database.A “Chinese medicine-compound-target” network was constructed using cytoscape software,and target interaction data was downloaded using the STRING online platform.A PPI protein interaction network was constructed to explore core targets;the DAVID platform was used to perform GO functional enrichment analysis and KEGG pathway enrichment analysis on proteins in the predicted core target network.Finally,the selected main active ingredients and core targets were subjected to molecular docking using software such as Pymol and Autotool.Results:Twelve effec-
tive ingredients and 422 drug targets were
screened from Periploca forrestii,and 71 targets intersected with ankylosing spondylitis.The main components of Periploca forrestii included isopropyldienol,baicalin,and kaempferol,while the core targets were STAT3,MAPK1,MAPK14,JAK2 and JAK1.GO function and KEGG pathway analysis revealed the main pathways involved in the growth hormone signaling pathway JAK-STAT cascade,JAK-STAT cascade,tyrosine phosphorylation of STAT protein,Th17 cell differentiation,Th1 and Th2 cell differentiation.Molecular docking showed that both components and targets could effectively bind,and the structure of baicalin and JAK1 was optimal.Conclusion:From the perspective of network pharmacology,the therapeutic effect of Periploca forrestii on ankylosing spondylitis was predicted,mainly using effective ingredients such as baicalin and kaempferol,which acted on targets such as JAK1 and JAK2 through signaling pathways such as JAK/STAT and MAPK,laying a certain foundation for subsequent research.
【Keywords】 ankylosing spondylitis;Periploca forrestii;network pharmacology;molecular docking;target points
强直性脊柱炎(ankylosing spondylitis,AS)是一种以侵犯脊柱、骶髂关节为特点的常见风湿病,持续的炎症会导致纤维化和钙化,发展为骨性强直与关节畸形[1]。本病多发于青壮年男性,我国发病率为0.3%[2],49%的AS患者最终可导致脊柱畸形[3],是一种致残率极高的疾病。AS发病主要通过免疫介导,涉及遗传、感染、免疫等多种因素,病理与多种细胞因子及通路相关[4]。黑骨藤为萝藦科(Asclepiadaceae)杠柳属(Periploca Linn.)植物的根或全株,具有祛风除湿、活血消痈功效,是贵州苗族地区治疗跌打损伤、风湿、骨折等的常用药物。黑骨藤多种活性成分,如黄酮类、甾体类、萜类等有抗炎镇痛、抗肿瘤、提高免疫力等作用,对AS等风湿病有明显疗效[5],但黑骨藤作用于AS的
机制并不清楚。本研究通过网络药理学研究黑骨藤治疗AS的作用机制,以期为后续研究提供依据。
1 材料与方法
1.1 黑骨藤化学成分获取及靶点基因转化 从文献和中药系统药理学数据库与分析平台TCMSP数据库(http://www.tcmspw.com/tcmsp.php)中获得黑骨藤主要化合物,在TCMSP数据库对所获化合物进行筛选。所获得有效成分通过PubChem数据库(https://pubchem.ncbi.nlm.nih.gov)获得简化
分子线性输入规范(simplified molecular input line entry specification,SMILES)序列,将SMILES
序列输入瑞士目标预测数据库(http://swisstargetprediction.ch)进行靶点预测。
1.2 AS靶点的筛选 以“ankylosing spondylitis”为关键词,在DISGENET数据库(https://www.disgenet.org)和GeneCards数据库(https://www.genecards.org)搜索,找到与AS相关的靶点基因,筛选与疾病相关度中心值以上靶点进行研究。
1.3 核心靶点图的构建 将筛选后的有效成分与疾病靶点关系进行整理后导入Cytoscape 3.9.1软件构建“药物-活性成分-靶点-疾病”网络图,图中节点分别代表药物、活性成分、共同靶点,边代表节点间的相互作用关系。
1.4 蛋白相互作用网络构建 利用STING功能关联蛋白网络数据库在线平台(https://string-db.org)对疾病-药物交集基因进行相互作用分析,得到核心靶点,构建蛋白相互作用网络图(PPI)。
1.5 GO生物功能及KEGG信号通路富集分析 通过DAVID平台(https://david.ncifcrf.gov)对所获核心靶点进行GO和KEGG分析,以P < 0.05为筛选条件,得到GO和KEGG结果。最后借助微生信平台(https://www.bioinformatics.com.cn)对结果进行可视化分析。
1.6 分子对接 筛选在Degree值前5位活性成分作配体,在TCMSP下载MOL2格式结构。筛选度值前5位靶基因作受体,在PDB数据库(https://www.rcsb.org)下载蛋白三维结构。利用pymol(https://pymol.org/2/)软件将靶点蛋白结构去除水分子、提取配体等,并保存为pdb格式。后面的操作在Autodock(https://autodocksuite.scripps.edu)可视化软件Autodock Tools1.5.7完成,首先将配体MOL2格式、受体pdb格式转换为pdbqt格式文件。运用AutoDock-4软件用“盲对接”,模拟退火算法进行对接。结果保存为pdbqt格式文件。利用Openbabell(https://openbabel.org)软件把pdbqt格式转换为pdb格式,最后将pdb格式文件导入Pymol软件对结合构象进行可视化分析。选择结合能最小的结构为最优结构。
2 结 果
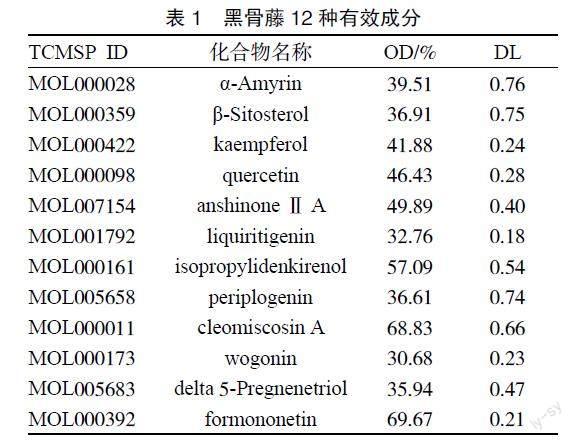
2.1 黑骨藤活性成分及相关靶点 通过文献[5-6]和TCMSP数据库获取黑骨藤活性成分,去重后剩余40个。TCMSP数据库设置过滤条件,筛选具有较高口服生物利用度(OB)≥30%的分子和类药性(DL)≥0.18的分子[7],最终筛选出12个活性成分(见表1)参与本研究。在PubChem数据库输入化合物名称得到12个化合物的SMILES号。通过得到的SMILES号在瑞士目标预测数据库对化合物进行靶点预测。所有化合物靶点基因合并后,删除重复得到靶点基因422个。
2.2 黑骨藤成分治疗AS潜在靶点 预测疾病靶点在DISGENET数据库获得710个,取相关度值中心数以上靶点332个。GeneCards数据库2274个,取相关度值中心数以上靶点684个。删除重复值,最终获得AS疾病靶点800个。与黑骨藤药物成分潜在靶点对比匹配,共获得71个交集靶点,并绘制韦恩图,见图1。
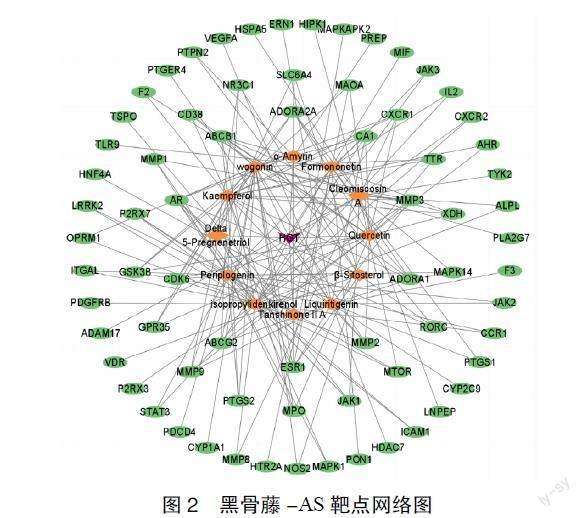
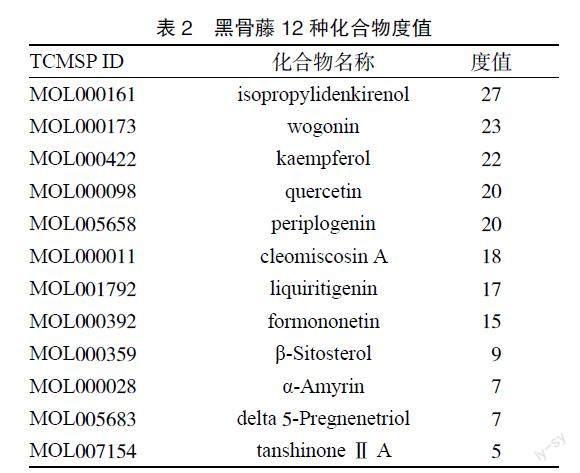
2.3 靶點网络图构建 将活性成分及71个交集靶点数据导入Cytoscape3.9.1软件,构建中药-化合物-靶点-疾病网络图,见图2。图中橙色为黑骨藤的活性成分,绿色为靶点,并对该网络图中的化合物节点的度值进行分析,度值越大,说明该成分在治疗AS的过程中所发挥的作用也越大。化合物度值较大的是异丙基二烯酚(isopropylidenkireno l)、
汉黄芩素(wogonin)、山奈酚(kaempferol)、槲皮素(quercetin)、杠柳苷元(periplogenin)等,见表2。
2.4 PPI网络构建 在STING平台对黑骨藤与AS交集的71个基因进行相互作用分析,生物种类设定为人类(Homo sapiens),置信度 > 0.9,其余参数默认,隐藏无交集靶点,得到边数为92,平均节点度2.59,PPI富集P < 0.01的PPI网络图(见图3)。将PPI网络图导入Cytoscape3.9.1软件进行拓扑分析,通过度值筛选前15位作为核心靶点做进一步分析,包括STAT3、MAPK1、MAPK14、JAK2、JAK1等,见表3,图4。
2.5 KEGG和GO分析 将上述得到的15个核心靶点导入DAVID数据平台进行GO功能富集分析和KEGG通路富集分析。获得GO功能条目153条,其中生物过程(BP)102个、细胞组分(CC)18个、
分子功能(MF)33个;KEGG通路富集分析获得54条通路。以P值为标准,-Log P值越大表明富集程度越大。利用微生信平台,把GO功能富集分析每部分显著性前10条(P < 0.05)绘制条形图(见图5)和显著性前20条(P < 0.05)通路绘制KEGG通路富集分析条形图,见图6。
GO分析结果显示,BP与参与生长激素信号通路JAK-STAT级联反应、JAK-STAT级联、STAT蛋白的酪氨酸磷酸化、细胞因子介导的信号通路、RNA聚合酶Ⅱ启动子转录的正调控等具有相关性;CC与细胞骨架、胞液、细胞质、白细胞介素(IL)-12受体复合物、富含菲可林-1的顆粒腔等相关;MF与生长激素受体结合,细胞因子受体结合、非膜跨越蛋白质酪氨酸激酶活性、RNA聚合酶Ⅱ转录因子活性,配体激活的序列特异性DNA结合、蛋白磷酸酶结合等相关。由此推测,黑骨藤活性成分主要通过以上通路对AS起治疗作用。
KEGG分析结果显示,黑骨藤与AS通路主要富集在Th17细胞分化、癌症的通路、Th1和Th2细胞分化、JAK-STAT信号通路、卡波西肉瘤相关疱疹病毒感染等。除此之外,与PI3K-AKT信号通路、IL-17信号通路、破骨细胞分化等也有较大的相关性。
2.6 分子对接 为了验证成分-靶点相互作用关系,选主要成分前5位异丙基二烯酚、汉黄芩素、山奈酚、槲皮素、杠柳苷元为配体,核心靶点前5位STAT3、MAPK1、MAPK14、JAK2、JAK1为受体进行分子对接。从TCMSP数据库下载得到药物成分MOL2格式结构。从PDB数据库选择人类(Homo sapiens)基因,筛选出蛋白结构,并下载pdb格式文件。利用pymol软件将靶点蛋白结构去除水分子、提取配体等。之后的步骤在AutoDock可视化软件Autodock Tools 1.5.7中完成,对接结果保存为pdbqt格式文件。利用Openbabel软件把pdbqt格式转换为pdb格式,最后将pdb格式文件导入Pymol软件对最优结合构象进行可视化分析。配体与受体的结合能小于-1.19 kcal·mol-1,表明具有一定的结合活性[8],结合能越小说明两者结合越稳定。结果显示,除异丙基二烯酚外,其余4种活性成分与JAK1结合能相对比较低,其中汉黄芩素结合能-6.59 kcal·mol-1为最低,与所有结构对比为最优结构。见表4。
3 讨 论
黑骨藤作为苗药收录于《中华本草苗药卷》《全国中草药汇编》等书籍,其味苦、辛,性温,有小毒,具有通经、活血、解毒、祛风等功效。大量研究发现,黑骨藤含强心苷类、醌类、黄酮类、苯丙素类、萜类、甾体类、挥发油类及神经酰胺类等多种化学成分[5-6],具有较好的抗炎消肿与镇痛作用[9-10],常用于风湿病的治疗,能有效下调胶原诱导关节炎大鼠炎症因子IL-6、肿瘤坏死因子-α(TNF-α)等表达,缓解关节炎症反应,改善软骨退变及骨破坏[11]。张丽等[12]研究显示,运用五藤散(由大血藤、黑骨藤、鸡血藤、桂枝、乳香等组成)督脉灸疗法联合功能锻炼治疗AS患者60例,总有效率达97.0%,患者脊柱活动和功能明显改善,关节功能恢复,并优于柳氮磺吡啶肠溶片观察组。
3.1 黑骨藤主要活性成分 本研究选用黑骨藤12种
活性成分,结果显示,主要发挥药效的可能是汉黄芩素、山奈酚、槲皮素等化合物这些化合物,有很好的抗炎、镇痛、抗氧化、抑菌等活性[13]。汉黄芩素可直接作用于免疫细胞,抑制IL-1β、IL-6、IL-8、TNF-α等炎性细胞因子的产生[14],BAUMANN等[15]研究证实,汉黄芩素可抑制T淋巴细胞的增殖与分化,减少Th17细胞形成,同时能促使活化的T细胞凋亡。并且通过抑制JAK1、JAK2、JAK3、STAT1和STAT3的磷酸化,阻断JAK-STAT信号转导,减少IL-7、IL-6和TNF-α等促炎因子分泌[16-17],在疾病中发挥抗炎、镇痛等作用。
3.2 黑骨藤作用于AS核心靶点 PPI网络显示,黑骨藤作用于AS主要以STAT3、MAPK1、MAPK14、JAK2、JAK1等为核心靶点。STAT3是信号转导和转录激活因子(STAT)家庭成员,被受体相关激酶磷酸化后,易位至细胞核,作为转录激活剂发挥作用,在细胞生长、凋亡、激活和分化中起关键作用,可通过JAK/STAT、MAPK信号通路等参与AS患者成骨细胞分化和骨形成,是AS发病及病程中重要的枢纽基因[18]。MAPK1、MAPK14属于丝裂原活化蛋白激酶(MAPK)家族,是细胞外信号调节蛋白,在多种生理和病理过程发挥作用,如细胞增殖、分化、凋亡、应激、炎症以及免疫反应等。MAPK信号通路被异常激活后可上调STAT3磷酸化水平[19]。Janus激酶(JAK)是一类非受体型酪氨酸蛋白激酶家族,包括JAK1、JAK2、TYK2和JAK3,JAK与STAT结合形成JAK/STAT通路,对调控免疫系统、促进细胞生长、抗凋亡及促进细胞周期等发挥重要作
用[20]。JAK1可直接磷酸化STAT,也通过与信号受体相关的其他JAK激酶的反式激活STAT信号转导[21]。JAK2是一种非受体酪氨酸激酶,在细胞因子和生长因子信号转导中起核心作用,募集并磷酸化STAT蛋白激活剂[22]。靶向JAK1/2治疗被认为是AS的有效治疗方案之一[23]。研究证实,AS患者使用JAK抑制剂治疗后,Th17细胞产生减少,IL-17、IL-22等蛋白表达明显降低,AS病情得到改善[24]。
3.3 黑骨藤治疗AS的主要通路 GO和KEGG分析顯示,黑骨藤作用于AS的核心靶点主要富集在JAK/STAT、Th17细胞分化等信号通路。同时,分子对接验证也显示,化合物与靶点结合都比较稳定,其中汉黄芩素与JAK1结合为最优结构。大量研究证明,JAK/STAT通路的失调与各种癌症和自身免疫性疾病有关[25],也参与了AS发病机制中促炎信号的转导[26]。AS患者外周血单核细胞中JAK/STAT通路被高度活化,活化的STAT促进Th17细胞的增殖与分化[27],进而增加下游炎性因子表达,引起一系列炎性反应[28]。Th17细胞是T淋巴细胞亚群辅助性T细胞(Th),Th细胞包括Th1、Th2、Th17细胞和调节性T淋巴细胞(Treg)等,参与TNF-α、γ干扰素及多种IL,如IL-2、IL-17等分泌[29]。IL-17主要由Th17细胞分泌,Th17/IL-17炎症轴已被确定是影响AS发展的重要因素[30],因此,Th17细胞常作为AS预后的参考[31]。吴冬梅[32]研究证实,AS患者出现外周血Th17细胞异常分化现象,IL-17表达明显升高,通过清热利湿活血法治疗可有效抑制Th17分化偏移,减少IL-17分泌,缓解AS炎症。因此推断黑骨藤对AS的治疗主要通过汉黄芩素、山奈酚、槲皮素等活性成分,作用于STAT3、MAPK1、MAPK14、JAK2、JAK1等靶点,在JAK/STAT、Th17细胞分化等信号通路实现。分子对接显示,汉黄芩素与JAK1结合良好,可能在治疗中发挥关键作用。
综上所述,本研究采用网络药理学方法分析黑骨藤治疗AS的作用机制,预测黑骨藤治疗AS的有效成分及关键靶点、通路,结果显示,其在AS治疗上从多靶点、多通路发挥作用,为该药物治疗AS提供分子理论依据,同时也为后续研究提供新的方向。但是,此次研究侧重于理论探讨,上述结论尚需进一步实验加以验证。
参考文献
[1] ZHU W,HE X,CHENG K,et al.Ankylosing spondylitis:etiology,pathogenesis,and treatments[J].Bone Res,2019,5(7):22-30.
[2] 中华医学会风湿病学分会.强直性脊柱炎诊断及治疗指南[J].中华风湿病学杂志,2010,14(8):557-559.
[3] 李冬.中西医不同疗法治疗强直性脊柱炎的网状Meta分析[D].广州:暨南大学,2020.
[4] SIMONE D,AL MOSSAWI MH,BOWNESS P.Progress in our understanding of the pathogenesis of ankylosing spondylitis[J].Rheumatology(Oxford),2018,57(6):4-9.
[5]朱欣婷.黑骨藤的化学成分研究[D].贵阳:贵州大学,2007.
[6] 赵珊,张宝,熊丹丹,等.苗药黑骨藤的化学成分研究[J].中草药,2017,48(8):1513-1518.
[7] ZONG J,XIAOLING Y,WUKAI MA,et al.Molecular mechanism analysis of Miao medicine Jinwujiangu decoction in treating osteoarthritis based on a network pharmacology approach[J].Tradit Chin Med,2022,42(4):576-585.
[8] YIN B,BI YM,FAN GJ,et al.Molecular mechanism of the effect of Huanglian Jiedu Decoction on Type 2 diabetes mellitus based on network pharmacology and molecular docking[J].J Diabetes Res,2020,19(10):1-24.
[9] 冉启军,赵建峰.贵州苗药黑骨藤总黄酮的抗炎镇痛作用[J].遵义医学院学报,2012,35(4):283-286.
[10] 徐雯娟.天然萜类及甾体的分离鉴定及其体外抗炎和抗肿瘤活性研究[D].泉州:华侨大学,2021.
[11] 刘耀,胡蝶,徐剑,等.苗药黑骨藤对胶原诱导性关节炎大鼠的作用研究[J].亚太传统医药,2021,17(7):27-30.
[12] 张丽,陈声丽,雷艳,等.苗药五藤散督脉灸联合功能锻炼改善强直性脊柱炎患者生活质量的效果分析[J].中西医结合心血管病电子杂志,2019,7(24):157,166.
[13] CHAGAS MDSS,BEHRENS MD,MORAGAS-TELLIS CJ,et al.Flavonols and flavones as potential anti-inflammatory,antioxidant,and antibacterial compounds[J].
Oxid Med Cell Longev,2022,6(9):1-21.
[14] SHAO W,ZHANG C,LI K,et al.Wogonin inhibits inflammation and apoptosis through STAT3 signal pathway to promote the recovery of spinal cord injury[J].Brain Res,2022,21(5):147843-147859.
[15] BAUMANN S,FAS SC,GIAISI M,et al.Wogonin preferentially kills malignant lymphocytes and suppresses T-cell tumor growth by inducing PLC gamma1-and Ca2+-dependent apoptosis[J].Blood,2008,111(4):2354-2363.
[16] KHAN NM,AHMAD I,ANSARI MY,et al.Wogonin,a natural flavonoid, intercalates with genomic DNA and exhibits protective effects in IL-1β stimulated osteoar-
(下轉第23页)
(上接第13页)
thritis chondrocytes[J].Chem Biol Interact,2017,274(25):13-23.
[17] LIAO HF,YE J,GAO LL,et al.The main bioactive compounds of Scutellaria baicalensis Georgi.for alleviation of inflammatory cytokines:a comprehensive review[J].Biomed Pharmacother,2021,133(17):110917-110929.
[18] LIANG T,CHEN J,XU G,et al.STAT3 and SPI1, may lead to the immune system dysregulation and heterotopic ossification in ankylosing spondylitis[J].BMC Immunol,2022,23(1):3-9.
[19] 刘凤杰,栗玉珍.MAPK信号通路及STAT3、STAT5A/B在银屑病皮损中表达增高[J].实用医学杂志,2018,34(18):3020-3023.
[20] PAROLI M,CACCAVALE R,PAROLI MP,et al.Janus kinase inhibitors:a new tool for the treatment of axial spondyloarthritis[J].Int J Mol Sci,2023, 24(2):1027-1041.
[21] D?SIR?E VAN DER HEIJDE,BARALIAKOS X,
GENSLER LS,et al.Efficacy and safety of filgotinib,a selective Janus kinase 1 inhibitor,in patients with active ankylosing spondylitis(TORTUGA):results from a randomised,placebo-controlled,phase 2 trial[J]. Lancet ,2018,392(10162):2378-2387.
[22] PERNER F,PERNER C,ERNST T,et al.Roles of JAK2 in aging,inflammation, hematopoiesis and malignant transformation[J].Cells,2019,8(8):854-862.
[23] 姜平,魏凯,金晔华,等.浅谈强直性脊柱炎相关生物制剂治疗进展[J].风湿病与关节炎,2021,10(7):60-64,69.
[24] HAMMITZSCH A,CHEN L,DE WIT J,et al.Inhibiting ex-vivo Th17 responses in ankylosing spondylitis by targeting Janus kinases[J].Sci Rep,2018,8(1):15645-15652.
[25] HU X,LI J,FU M,et al.The JAK/STAT signaling pathway:from bench to clinic[J].Signal Transduct Target Ther,2021,6(1):402-434.
[26] 肖凡妮,青玉凤,张全波.JAK/STAT信号通路在风湿免疫性疾病中作用的研究进展[J].中国全科医学,2022,25(17):2159-2164.
[27] 宋俊垚.从JAK/STAT信号通路调控Th17分化探索补肾、清热、活血法干预强直性脊柱炎炎症分子机制[D].北京:北京中医药大学,2016.
[28] 葛改,杨智雅,张祥宇,等.SOCS通过调控JAK/STAT通路影响Th细胞分化在感染性疾病中的作用研究进展[J].中国真菌学杂志,2021,16(1):51-55.
[29] NANDAN A,SHARMA V,BANERJEE P,et al.Deciphering the mechanism of Tinospora cordifolia extract on Th17 cells through in-depth transcriptomic profiling and in silico analysis[J].Front Pharmacol, 2023, 13(9):1-18.
[30] 赵先,何敏华.IL-17在强直性脊柱炎发病机制中作用的研究进展[J].现代免疫学,2019,39(3):241-244.
[31] 方乐,董少梅,张祖雯,等.强直性脊柱炎患者外周血免疫细胞Th17水平与预后的相关性分析[J].临床医学研究与实践,2021,6(1):11-14.
[32] 吴冬梅.从Hippo信号通路调控TAZ探索强直性脊柱炎Th17分化偏移及中药干预机制[D].北京:中国中医科学院,2020.
收稿日期:2023-08-27;修回日期:2023-10-11