重组人血管内皮抑制素联合顺铂心包灌注治疗非小细胞肺癌恶性心包积液疗效观察
刘世伟 杨璞 李反念 豆瑞刚 曹万乐 李玉坤 王建勋 朱梓铭 刘扬 高计林 刘月焜
恶性心包积液是晚期肺癌患者最常见的并发症之一,常出现如胸闷、气短、呼吸困难等症状,可能会可危及患者生命[1-2]。目前,对于症状明显、中等量以上的心包积液,通常采用心包腔内中心静脉导管引流,但是不能解决根本问题。心包注入顺铂是临床常用方法,但是不良反应明显,随着研究的深入,抗血管生成药物的出现可能成为恶性心包积液的治疗新的思路[3-4]。文献报道应用重组人血管内皮抑制素及顺铂对非小细胞肺癌引起的恶性心包积液的治疗具有特定的疗效[5-6];因此为探寻恶性心包积液治疗的最佳方法,我们将住院的非小细胞肺癌引起的恶性心包积液患者进行对比观察,报道如下。
1 资料与方法
1.1 一般资料 选择邢台医学高等专科学校第一附属医院2018年1月至2021年9月非小细胞肺癌伴恶性心包积液患者77例,其中:男45例,女32例;年龄41 ~ 82岁,平均(61. 31 ± 4. 75) 岁;体重48~ 83 kg,平均(63.5 ± 6.4) kg;腺癌42例,鳞癌23例,腺鳞癌5例,心包积液找到癌细胞(考虑为非小细胞肺癌)但未能明确分型7例;合并脑转移2例,肝转移3例,骨转移4例,肺内转移11例均为治疗后处在稳定期时入组;合并糖尿病4例,合并高血压病6例。随机分为重组人血管内皮抑制素(恩度)组(n=26)、顺铂组(n=24)、恩度+顺铂组(n=27)。3组患者的性别比、年龄、 病理类型、分期、KPS评分、体重指数及合并内科疾病等一般资料比较,差异无统计学意义 (P>0.05)。见表1。
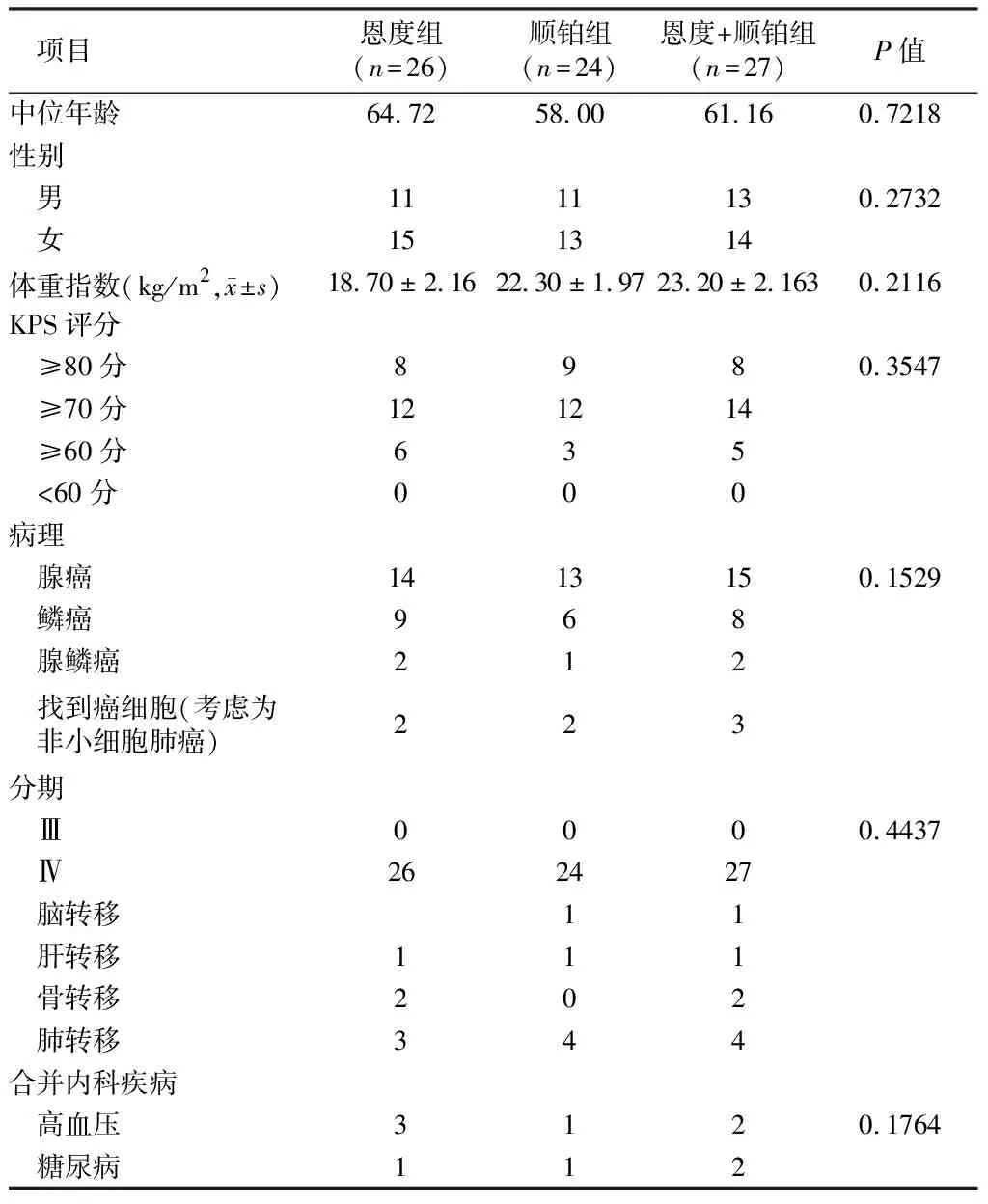
表1 2组患者一般资料比较 例
1.2 纳入与排除标准
1.2.1 纳入标准:①有病理诊断为非小细胞肺癌;②首次发生心包积液;③心包积液中查见恶性肿瘤细胞;④CT影像学+超声确认心包积液≥中等量;⑤(KPS评分)≥60分,预计生存期≥6个月,随访观察6个月以上;⑥血常规、凝血功能、肝肾功能、心肌酶及心电图检查,无穿刺置管及用顺铂和重组人血管内皮抑制素(恩度)的禁忌;⑦患者及家属签署知情同意书。
1.2.2 排除标准: ①对生物制剂过敏的患者;②患者或家属不同意参与此次研究的; ③近1个月内心包腔内接受过相关抗肿瘤药物注入的患者;④有凝血功能异常或者血小板较低等伴有穿刺禁忌的患者;⑤3周内接受过静脉化疗的患者,⑥合并有冠心病、心律失常及心包疾病患者。
1.3 治疗方法 (1)入选病例治疗前后均行胸部CT平扫(依据CT变化对比疗效);入选患者在超声引导下行心包穿刺置管,现行B超定位,取距体表皮肤最近处做穿刺点,应用中心静脉导管引流心包积液,行间断分次引流(每日总引流量约300 mL),待心包内积液充分引流后再行心包腔内注药,注药后监测心电4 h。应用药物为:重组人血管内皮抑制素注射液(山东先生生物制药有限公司,国药准字S20050088)、顺铂(齐鲁制药有限公司,国药准字H20073652)。利多卡因(湖南科伦制药有限公司,国药准字H20057816)、地塞米松(辰欣药业股份有限公司,国药准字H37021969)、0.9%氯化钠溶液(石家庄四药有限公司,国药准字H13023201)。(2)77例患者随机分为3组,分别给予心包灌注:①恩度组:先行心包灌注利多卡因5 mL+地塞米松5 mg,5 min后再行心包灌注恩度30 mg+0.9%氯化钠溶液20 mL,d1、d5;②顺铂组:先行心包灌注利多卡因5 mL+地塞米松5 mg,5 min后再行心包灌注顺铂40 mg+0.9%氯化钠溶液20 mL,d1、d5;②恩度+顺铂组:先行心包灌注利多卡因5 mL+地塞米松5 mg,5 min后再行心包灌注恩度30 mg+0.9%氯化钠溶液20 mL,d1、d5;同时次日行心包灌注利多卡因5 mL+地塞米松5 mg,5 min后再行心包注入给予顺铂20 mg+0.9%氯化钠溶液20 mL,d2、d6。每例患者给药2~3次,3周后评估。患者在注药后平躺15 min,然后左右侧躺各15 min,最后俯卧位15 min为1周期。注药后使患者变换不同体位2~3周期,以便药物在心包腔内均匀分布,使药物与心包膜充分接触。
1.4 肿瘤标志物指标 比较3组治疗前后肿瘤标志物水平,每周期治疗前采集3组患者清晨空腹状态下外周静脉血5 mL,采用酶联免疫吸附法(ELISA)测定肿瘤标志物水平,评估指标主要包括血清癌胚抗原(carcinoembryonic antigen,CEA)、血清癌抗原125(carbohydrate antigen 125,CA125)、细胞角蛋白 19 片段抗原(cytokeratin fragment 19,CYFRA21-1)及神经烯醇化酶(neuron-specific enolase,NSE)。
1.5 疗效评定 心包积液疗效评估,依据世界卫生组织制定的浆膜腔积液疗效评价标准(RECIST)1.1版非靶病灶评价标准[7-8]。完全缓解(CR):心包积液完全消失,至少维持4周;部分缓解(PR),心包积液量减少≥50%,至少维持4周;无效(NR),心包积液无变化,或积液量减少<50%。心包灌注2周后复查胸部CT和心脏彩超,与治疗前进行对比评价疗效。4周后再次复查确认疗效。有效率(RR)=(CR+PR)/总例数×100%。

2 结果
2.1 3组疗效比较 恩度组总有效率低于顺铂组,顺铂组总有效率低于恩度+顺铂组,恩度组总有效床低于恩度+顺铂组,差异均有统计学意义(χ2值分别为0.0326、0.438、0.0305,P<0.05)。见表2。
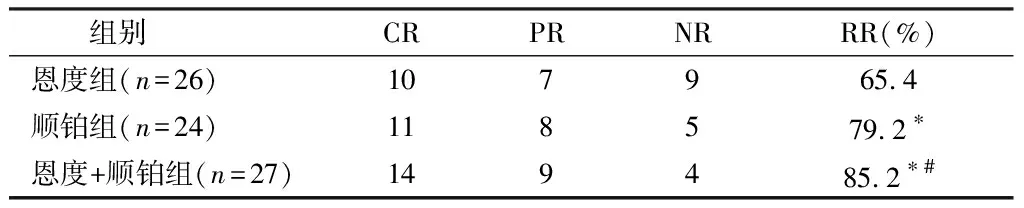
表2 3组疗效比较 例
2.2 3组患者治疗前后肿瘤标志物水平比较 经过治疗后恩度组、顺铂组、恩度+顺铂组患者血清中肿瘤标志物CEA、CA125、CYFBA21-1、NSE水平均较前明显下降,差异有统计学意义(P<0.05)。见表3。

表3 3组治疗前后肿瘤标志物水平比较
2.3 3组不良反应发生率比较 心包灌注恩度组,无胸痛、寒战、发热、皮疹等明显不适,偶有皮疹、瘙痒、心悸等不适,均为Ⅰ、Ⅱ级不良反应,多数可自行缓解,患者耐受较好。心包灌注顺铂单药患者消化道反应明显,或者出现心律失常等不良反应,有1例心电图改变(房室传导阻滞);有个别不良反应明显,出现Ⅲ级以上不良反应,患者耐受较差;恩度+顺铂组不良反应多为Ⅰ、Ⅱ级不良反应,多数患者可耐受。3组不良反应发生率、总不良反应发生率比较,差异均无统计学意义(P>0.05)。见表4。
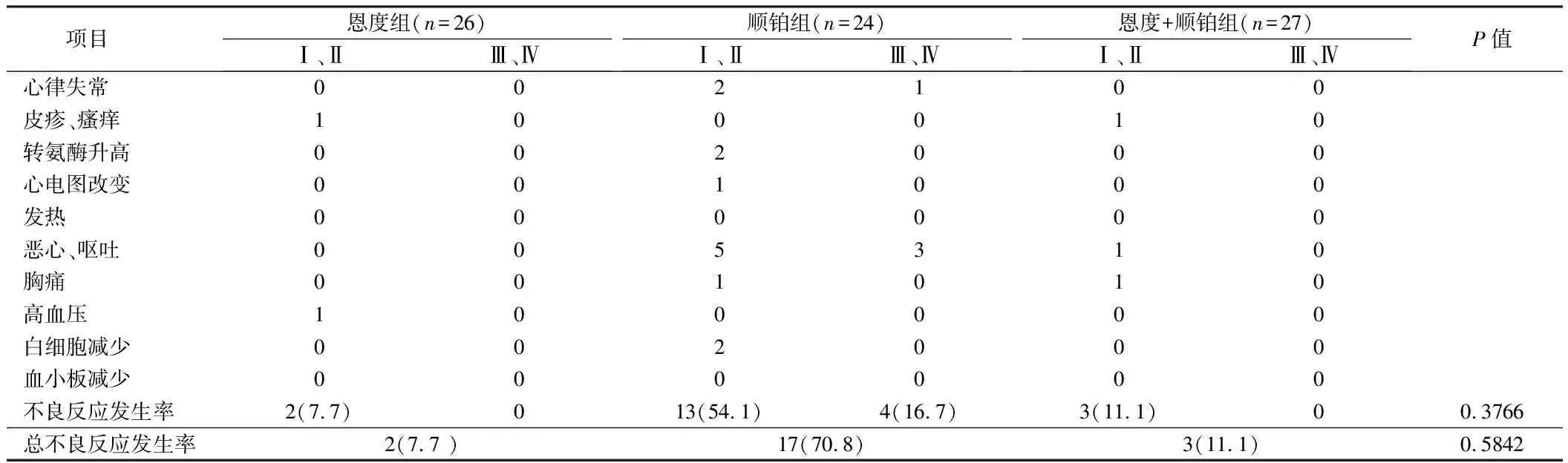
表4 3组不良反应发生率比较
3 讨论
从解剖层次来说,心包是由脏层膜和壁层膜组成,两层之间形成腔隙为心包腔,正常情况下心包腔内有少量积液(15~ 35 mL) ,在心脏运动减少摩擦起润滑作用[9-10]。如果心包内液体达到>50 mL,即称为心包积液。心包积液患者通常以胸闷、气短、心慌、呼吸困难等为首发症状,胸闷、气短和端坐呼吸也很常见。恶性心包积液的产生是由于恶性肿瘤细胞转移到心包腔内膜的表面,随着肿瘤细胞的增殖、侵袭,导致心包血管和淋巴管的阻塞,同时促进血管的通透性增加,进而破坏了心包对积液的分泌和重吸收能力造成的。恶性心包积液形成的病理机制比较复杂,目前已知研究还不能详细阐明其形成原因[11]。新近研究发现,血管内皮生长因子(vascular endothelial growth factor,VEGF)、促血管生长因子(TAF)和基质金属蛋白酶(matrix metalloproteinases,MMPs)等在恶性心包积液的形成、发展过程中起到了重要作用。VEGF是一种高度特异性的促血管内皮细胞生长因子,具有促进血管内皮细胞的增值、迁移,促进新的血管形成等作用,同时也有增加血管通透性作用。目前多项研究表明,肿瘤细胞的浸润或转移至心包腔后,引起局部VEGF水平升高,促使肿瘤新生血管生成和血管通透性增加,造成红细胞和大分子量蛋白容易从血管内渗出,产生心包积液[12-13]。MMPs是一种蛋白水解酶,促进细胞外基质的降解,减少肿瘤间的黏附,进而引起肿瘤的侵袭、转移和新生血管生成,同时还提高血管的通透性,促进积液的形成。因此,VEGF和MMPs参与了恶性心包积液形成的发病机制,并且在恶性心包积液的发生发展中起到了重要的作用。
血管生成是恶性肿瘤生长的关键因素,通过对恶性心包积液产生机制的深入研究发现,VEGF/MMPs是血管形成的重要通路。因此针对以 VEGF 和 MMPs 等作为靶点的抗血管靶向治疗,成为治疗恶性心包积液的新思路。我国自主研发的抗血管生成药物重组人血管内皮抑制素(恩度),是一种泛靶点、可以抑制多个细胞信号通路的药物。通过抑制VEGF的表达来抑制血管内皮细胞的增殖、分化、迁移等作用,同时提高血管内皮激活的下游效应,通过多靶点对抗VEGF抑制血管形成和增加血管通透性的作用[14-15],阻断了肿瘤细胞的营养供给,从而达到抑制肿瘤细胞的增殖或转移的目的。临床应用发现,重组人血管内皮抑制素既有抑制肿瘤增长,又具有毒性较低、易于耐受等特点,已经获得大家的认可[16-17]。
顺铂是一种细胞周期非特异性抗肿瘤药物,是一种广谱抗肿瘤药物,其通过与癌细胞的DNA交叉连接,破坏DNA的功能,并能抑制细胞的有丝分裂,从而达到抗肿瘤作用[18]。临床上顺铂经常被用于癌性胸腹水的治疗,其疗效得到广泛的认可,所以是恶性浆膜腔积液治疗的常用药物。顺铂除有恶心、呕吐等消化道不良反应外,对局部组织也有一定刺激。心脏是人体重要器官之一,心包腔隙容量较小,如果应用顺铂药物行高浓度心包灌注,可能会刺激心脏,引起心脏严重不良反应。顺铂的不良反应限制其应用的剂量,也限制其疗效;顺铂联合重组人血管内皮抑制素(恩度)治疗恶性心包积液,可以降低患者的不良反应,增加患者的耐受性,提高疗效。
本研究结果发现,总有效率是重组人血管内皮抑制素(恩度)组为65.4 %、顺铂组为79.2%、重组人血管内皮抑制素(恩度)+顺铂组为85.2%。分析重组人血管内皮抑制素(恩度)单药治疗非小细胞肺癌引起恶性心包积液,疗效肯定,稍弱于另外2组,但是不良反应轻微3.8 %(1/26),患者耐受性较好,对比另外2组,恩度单用应用使得高龄体弱者获益更多。单独应用顺铂疗效较好,但是不良反应较重 ,总的不良反应为70.8%(17/24),部分患者无法耐受(Ⅲ、Ⅳ不良反应为16.7%(4/24)),顺铂的不良反应的局限性,使患者对其应用产生了一定的抵触。重组人血管内皮抑制素(恩度)+顺铂联合治疗非小细胞肺癌恶性心包积液,总体疗效较好,有效率为85.2%;联合治疗组中降低了顺铂的应用量,减轻了药物的不良反应3/27(11.1%),未出现Ⅲ、Ⅳ级不良反应,形成了最佳治疗组合。
合并有恶性心包积液的NSCLC病情较晚,体内瘤负荷较大,所以患者的血清肿瘤标志物较高。通过对比患者肺肿瘤标志物变化是肿瘤疗效判定和预后评估的重要参考指标。所以检测血清肿瘤标志物对临床工作中 NSCLC 的辅助诊断、抗肿瘤疗效评价以及预后等各方面有重要参考作用,因此可作为晚期NSCLC 患者治疗后近期疗效评价的重要指标。 所以本研究显示3组患者经治疗后血清肿瘤标志物水平较治疗前明显下降(P<0.05),进一步验证了心包灌注药物可以控制心包积液,同时抑制肿瘤,降低患者瘤负荷,进而体现在血清肿瘤标志物的降低。
本研究结果显示,3组间疗效比较均有明显统计学意义。进一步印证了重组人血管内皮抑制素(恩度)联合顺铂在治疗非小细胞肺癌引起的恶性心包积液中,起到了相互协同增效作用;重组人血管内皮抑制素既抑制新生血管形成,也可以促进血管内皮激活的下游效应来增强血管通透性,提高顺铂对组织间的渗透,增加顺铂的血药浓度增强顺铂对癌细胞的破坏DNA的功能,进而提高控制恶性心包积液的疗效;由于使局部血药浓度的提升同时可以减少顺铂的用量,进一步可降低顺铂引起的不良反应。该治疗方法既可以提高疗效,有降低不良反应,提高了患者耐受性及依从性,进而提高患者预后。
总之,本研究中重组人血管内皮抑制素(恩度)+顺铂联合应用治疗非小细胞肺癌引起的恶性心包积液比单药恩度的疗效好,较单药顺铂的不良反应小,值得临床参考借鉴。

