基于QbD理念的经典名方研究:真武汤的提取工艺优化研究
李明慧,张钰明,卢新颖,李花花,彭紫薇,宋扬,翟晓峰,顾妍,热西旦木·马木江,白洁,杜守颖(北京中医药大学中药学院,北京 102488)
真武汤为第一批经典名方目录中的第八方,此方首载于张仲景编著的《伤寒论》,由茯苓、芍药、生姜、白术和附子5味药组成,具有温阳利水的功效,主治阳虚水泛证[1]。现代临床多用于慢性肾炎、肾病综合征、尿毒症、糖尿病肾病、心律失常等阳虚水饮内停者。将其开发为颗粒剂,可更好地满足临床顺应性的要求。
根据经典名方研究的相关文件,颗粒剂的关键质量属性(CQAs)应与基准样品保持一致,以确保其质量符合标准,CQAs包括指纹图谱相似度、指标性成分含量以及出膏率。经典名方颗粒剂的工艺研究的重点并非追求CQAs的最高水平,而是确保CQAs与基准样品的质量标准范围保持较高的一致性。质量源于设计(quality by design,QbD)理念注重全面了解和把握整个制药过程,注重对生产工艺的理解,以及生产过程中的产品质量的监管和控制,从而指导整体理论[2-5]。
在QbD理念下优化经典名方真武汤的提取工艺,能够有效地控制颗粒剂制备工艺过程,从而获得与基准样品一致的重要特性。提取工艺对颗粒剂的最终质量有直接影响,是整个制备工艺中质量传递的关键环节。中药提取的结果受到人为操作、环境条件、药材本身、使用的仪器设备以及提取过程中的条件等因素的影响。其中,提取条件是关键因素。采用Box-Behnken设计-响应面法优化提取工艺,有效地控制提取条件,才能确保CQAs与基准样品一致。
课题组前期成功制备了15批真武汤基准样品[6],并最终确定了以指纹图谱相似度、芍药苷和6-姜辣素的含量以及出膏率作为CQAs并确定其范围。本研究以QbD理念为基础,以指标性成分的含量和出膏率为衡量标准,在单因素筛选的基础上,利用响应面法进行提取工艺的优化,构建一个提取工艺的设计空间,以筛选出最佳的提取条件,从而确保制剂中间体和基准样品在CQAs方面保持一致,为后续颗粒剂的制备工艺奠定基础。
1 仪器与试药
1.1 仪器
赛多利斯BSA 224S电子分析天平(赛多利斯科学仪器有限公司);JM-B10002电子天平(余姚市纪铭称重校验设备有限公司);HH-6型电热恒温水浴锅(北京科伟永兴仪器有限公司);DHG-9140A型电热恒温鼓风干燥器(上海一恒科技有限公司);DZF-6051型真空干燥器(北京利康达圣科技有限公司);DZTW 1000 mL电子调温电热套、DZTW 250 mL电子调温电热套(北京中仪泓瑞科技发展有限公司);KQ5200DA型数控超声波清洗器(昆山市超声仪器有限公司);SHB-Ⅲ型循环水式多用真空泵(郑州长城科工贸有限公司);Thermo Fisher U3000高效液相色谱仪[DAD检测器,CM 7.2色谱工作站,赛默飞世尔科技(中国)有限公司]。
1.2 试药
芍药苷对照品(批号:110736-201842,纯度:97.48%)、6-姜辣素对照品(批号:111833-201705,纯度:96.8%)(中国食品药品检定研究院);乙腈、甲醇、磷酸(Fisher公司,色谱级);纯净水(杭州娃哈哈集团有限公司);甲醇(分析纯)。
茯苓饮片(批号:20200901,产地:安徽岳西);白芍饮片(批号:20200801,产地:浙江磐安);白术饮片(批号:20200801,产地:浙江磐安);生姜饮片(批号:GX1,产地:广西百色);附子饮片(批号:SCJ20200701,产地:四川江油)。
2 方法与结果
2.1 真武汤基准样品对应实物的制备[6]
称取茯苓、白芍、生姜饮片各41.4 g,白术饮片27.6 g、附子饮片15 g于陶瓷砂锅内,加入1600 mL水,武火(1600 W)煮至沸腾,后用文火(800 W)继续煎煮约70 min,用一层300目尼龙筛网趁热(约80℃)过滤,滤液放凉后加水调整体积至600 mL。精密移取一定量的水煎液于25 mL西林瓶中,于冰箱冷冻层预冻12 h后,转移至-80℃的真空冷冻干燥机中(真空度为4~5 Pa),冷冻3 d,得基准样品对应实物。
2.2 CQAs和关键工艺参数(CPPs)的确定
2.2.1 CPPs的筛选及风险评估 采用鱼骨图作为风险辨识工具,按照“仪、环、人、药、法”梳理挖掘质量风险相关工艺参数,初步确定潜在的CPPs(见图1)。根据前期研究经验[6],选择提取次数、提取时间、提取加水倍量为真武汤提取工艺的关键考察因素。
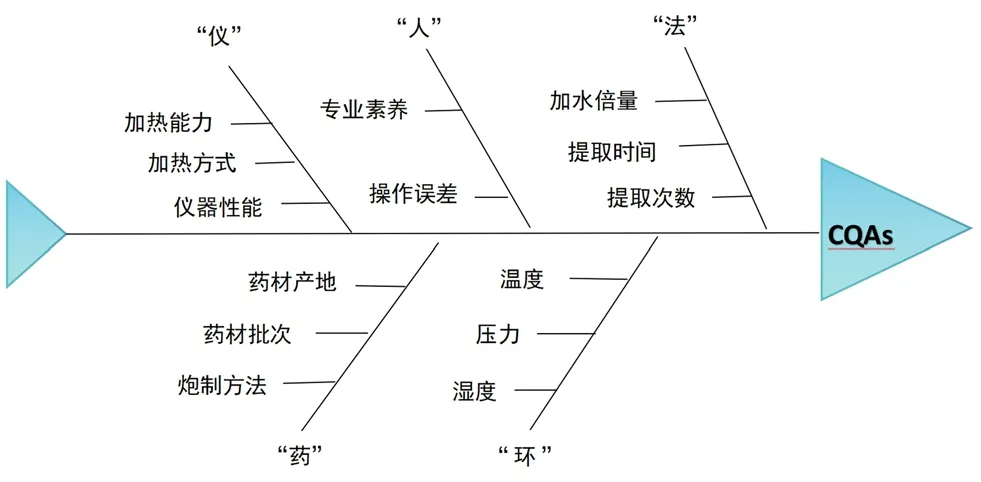
图1 真武汤提取工艺参数风险辨识鱼骨图Fig 1 Risk identification of the extraction parameters of Zhenwu decoction
2.2.2 CQAs的确定 依据前期确定的基准样品标准[6]选取芍药苷、6-姜辣素含量以及出膏率为CQAs。
2.3 指标性成分含量测定方法的建立
2.3.1 色谱条件 芍药苷测定的色谱柱:Thermo Acclaim 120-C18(4.6 mm×250 mm,5 μm);流动相:乙腈-0.1%磷酸溶液(14∶86);检测波长:230 nm;柱温:30℃;流速:1.0 mL·min-1;对照品与供试品进样体积:10 μL。
6-姜辣素测定的色谱柱:Thermo Acclaim 120-C18(4.6 mm×250 mm,5 μm);流动相:乙腈-甲醇-水(40∶5∶55);检测波长:280 nm;柱温:30℃;流速:1.0 mL·min-1;对照品进样体积:8 μL;供试品进样体积:20 μL。
2.3.2 对照品溶液的制备 精密称取芍药苷,加甲醇将其定容至10 mL量瓶中,最后配制成213 μg·mL-1的芍药苷对照品溶液。精密称取6-姜辣素,加纯甲醇定容至10 mL量瓶,最后配制成21.325 μg·mL-1的6-姜辣素对照品溶液。
2.3.3 供试品溶液的制备
① 基准样品供试品溶液的制备:精密称取0.1 g冻干粉于10 mL量瓶中,加10 mL 25%甲醇溶液超声30 min(250 W,40 kHz),放冷后,用25%甲醇溶液补足并定容,振匀后,静置,取上清液,过0.45 μm微孔滤膜,即得。
② 提取液供试品溶液的制备:取1个处方量的饮片,置于圆底烧瓶中,加适量水,回流70 min,300目尼龙筛网趁热过滤,补足体积,精密移取1 mL提取液用水稀释相应倍数后离心,过滤,即得。
③ 阴性样品溶液:逐个去除处方中缺味药饮片,分别制备不含白芍和生姜的阴性样品,制备阴性基准样品,按照①项下方法制备阴性样品溶液。
2.3.4 线性关系考察 按“2.3.2”项下方法制备998.4 μg·mL-1芍药苷对照品溶液和230.2 μg·mL-16-姜辣素对照品溶液,逐级稀释成系列浓度的对照品溶液,按“2.3.1”项下色谱条件测定,分别对芍药苷、6-姜辣素质量浓度进行线性回归,得回归方程芍药苷:A=0.2104C-0.9087,R2=0.9999,线性范围为19.97~998.4 μg·mL-1;6-姜辣素:A=0.0733C+0.0059,R2=0.9998,线性范围为2.302~230.2 μg·mL-1。
2.3.5 精密度考察 取供试品溶液1份,按“2.3.1”项下色谱条件连续进样6次,计算得芍药苷、6-姜辣素的峰面积的RSD值分别为 0.76%、1.2%,表明仪器精密度良好。
2.3.6 稳定性试验 取供试品溶液于0、3、6、9、12、24 h进样,测定芍药苷、6-姜辣素的峰面积,计算RSD。由结果可知,芍药苷和6-姜辣素的峰面积的RSD值分别为1.3%、0.37%,表明供试品溶液在24 h内稳定性良好。
2.3.7 重复性试验 按照供试品溶液的制备方法制备6个样品,测得芍药苷、6-姜辣素的峰面积及RSD值分别为2.3%、1.6%,说明方法重复性良好。
2.3.8 加样回收试验 取基准样品6份,每份0.05 g,分别精密加入1.3052 mg·mL-1的芍药苷对照品溶液1 mL,0.0483 mg·mL-1的6-姜辣素对照品溶液1 mL,按“2.3.3”项下方法操作得到加样供试品溶液,按“2.3.1”项下色谱条件进样测定,计算得芍药苷、6-姜辣素的平均加样回收率分别为101.98%、97.78%,RSD值分别为3.0%、2.1%。
2.3.9 专属性试验 按照“2.3.3”项下方法分别制备阴性样品溶液和全方供试品溶液,进样测定,结果见图2与图3。在此色谱条件下,可准确测定全方中芍药苷和6-姜辣素的含量而无干扰。

图2 真武汤中白芍成分的HPLC图Fig 2 HPLC of paeonia lactiflora in Zhenwu decoction

图3 真武汤中生姜成分的HPLC图Fig 3 HPLC of ginger components in Zhenwu decoction
2.4 出膏率测定
2.4.1 基准样品出膏率的测定 根据前期研究[6]称取处方量饮片于陶瓷砂锅内,加水1600 mL,煎煮约70 min后,用一层300目尼龙筛网趁热(约80℃)过滤,滤液放凉后加水调整体积至600 mL。分取一半的水煎液(300 mL)以600 W浓缩至合适程度时,于水浴锅浓缩成稠膏状后,置于真空干燥箱,60℃干燥,称重,计算出膏率。
出膏率(%)=干膏质量/生药质量×100%。
2.4.2 提取液出膏率的测定 将提取液于水浴锅浓缩至稠膏状后,置于60℃真空干燥箱中,3 d后取出,称重,折算,按上述公式计算出膏率。
2.5 单因素试验
以芍药苷、6-姜辣素含量及出膏率为考察指标,固定提取次数1次,提取时间为1.5 h,加水倍量分别为8、10、15倍进行加水倍量单因素试验考察;固定提取次数为1次,提取加水倍量为10倍,提取时间为 1、1.5、2 h 进行提取时间单因素试验考察;固定提取加水倍量为10倍,提取时间为1.5 h,进行提取1、2、3次单因素考察,结果见图4。

图4 不同加水倍量、提取时间以及提取次数下芍药苷、6-姜辣素含量及出膏率柱状图Fig 4 Histograms of paeoniflorin and 6-gingerol content and paste yield at different times of water addition,extraction time and number of extractions
由图4可知,随着加水倍量的增加,提取液中芍药苷的含量先增加后降低,6-姜辣素含量与出膏率增加渐缓,所以将响应面加水倍量的高水平设定为15倍。随着提取时间从1 h增加到2 h,芍药苷含量先增加后减少,6-姜辣素含量与出膏率增加趋势逐渐变小,所以将提取时间的高水平设定为2 h。随着提取次数的增加,芍药苷含量逐渐降低到基本不变,6-姜辣素含量与出膏率增加趋势较缓,最后基本不变。所以将提取次数高水平设定为3次。
2.6 Box-Behnken设计-响应面法优化真武汤提取工艺
2.6.1 因素水平设计 基于以上分析,选取提取时间A(X1),加水倍量B(X2),提取次数 C(X3)三因素进行响应面试验设计。以两个指标成分含量(Y1:芍药苷含量;Y2:6-姜辣素含量)和出膏率(Y3)为CQAs,采用 Design Expert 13.0 软件进行响应面设计和数据分析,筛选出最佳提取工艺。最后,选择三个试验点,进行已建立模型的验证。
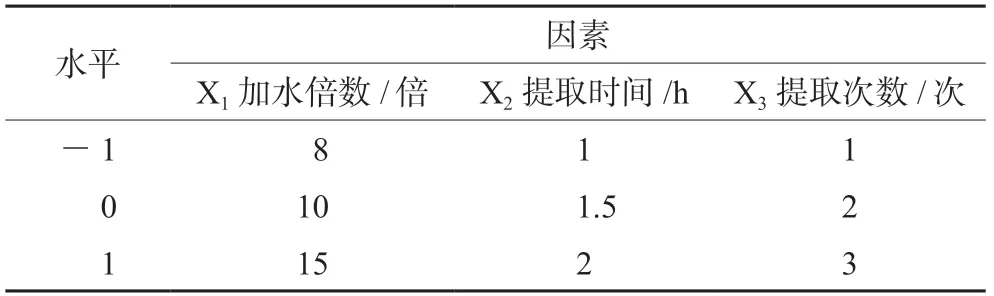
表1 响应面设计因素水平Tab 1 Factor and level of Box-Behnken design
2.6.2 试验结果 17组试验提取液中指标性成分含量和出膏率结果见表2。

表2 17组试验提取液中指标性成分含量和出膏率结果Tab 2 Content of index components and paste yield in 17 groups of test extracts
2.6.3 模型建立与评价 根据表2结果,采用多项式及一项式回归模型对芍药苷含量、6-姜辣素含量、出膏率及对应的因素(提取加水倍量、提取时间、提取次数)分别进行拟合,回归方程如下:Y1(芍药苷)=0.73-0.063X1+0.0965X2+0.098X3+0.045X1X2-0.10X1X3-0.077X2X3+0.091X12+0.16X22+0.019X32-0.047X12X2-0.16X12X3-0.24X1X22;
Y2(6-姜辣素)=0.082+0.006X1+0.004X2+0.013X3;
Y3(出膏率)=19.93+0.1675X1+1.32X2+4.23X3-0.55X1X2-2.42X1X3-0.75X2X3-0.2817X12+0.4158X22-0.9268X32-0.1850X12X2-2.69X12X3+0.1725X1X22。
分别应用不同的回归类型对响应面试验结果进行方差分析,结果见表3~5,芍药苷含量和出膏率的回归总模型的方差显著(P<0.05),6-姜辣素的一项式回归总模型的方差显著(P<0.05);所建三个模型均有统计学意义。Y1(芍药苷含量)和Y3(出膏率)二方程的R2分别为0.9849、0.9902,Y2(6-姜辣素含量)的R2=0.6102,因此三个回归方程均可用于后期的试验。

表3 芍药苷含量的方差分析Tab 3 Variance analysis of paeoniflorin content

表4 6-姜辣素含量的方差分析Tab 4 Variance analysis of 6-gingerol content
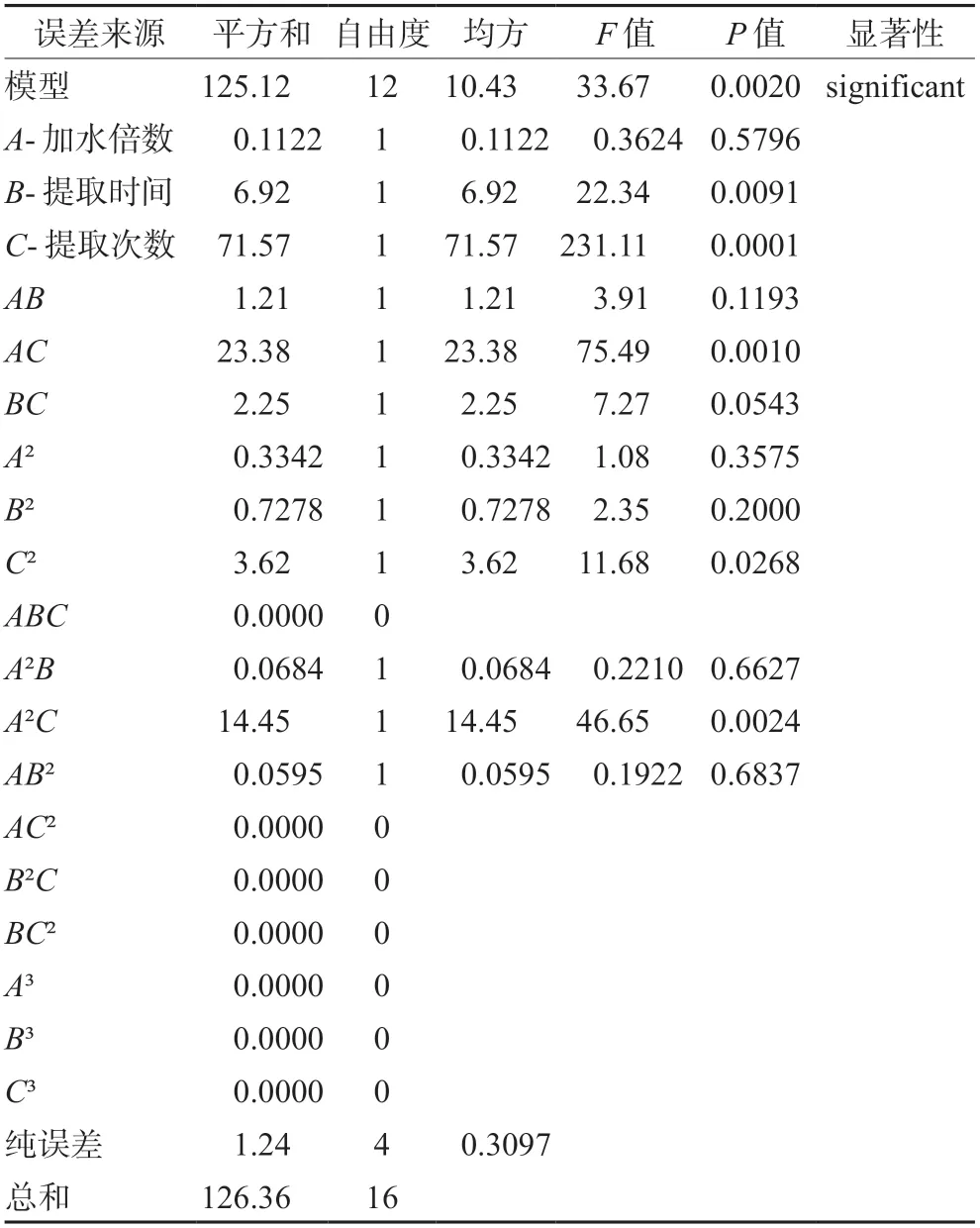
表5 出膏率的方差分析Tab 5 Variance analysis of paste yield
2.6.4 芍药苷含量的响应面分析 芍药苷含量的等高线和3D图如图5所示,在图5A中,当提取时间为1.5 h时,提取次数的等高线密度超过了加水倍量,说明提取次数对芍药苷含量的影响更大。在图5B中,当提取次数固定为2次时,提取时间的等高线密度高于加水倍量,因此可以得出提取时间对于芍药苷的含量影响较大。图5C描述了当提取加水倍量为11.5倍时,提取次数的等高线密度高于提取时间,因此可以得出提取次数对芍药苷含量的影响更大。在给定的变量范围内,芍药苷含量受到三个因素的影响程度,其中提取次数对其影响最大,其次是提取时间,而加水倍量对其影响较小,这一结论与方差分析的结果一致。

图5 各因素交互作用对芍药苷含量影响的响应面及等高线图Fig 5 Response surface and contour plot of the effect of factor interaction on the content of paeoniflorin
2.6.5 6-姜辣素含量的响应面分析 6-姜辣素含量的等高线和3D图分析见图6,在给定的变量范围内,6-姜辣素含量受到三个因素的影响程度,其中提取次数对其影响最大,其次是提取加水倍量,而提取时间对其影响较小,与方差结果基本一致。在图6A中,当提取时间为1 h时,提取次数的等高线密度大于提取加水倍量,从而,提取次数对6-姜辣素的含量影响有很大的影响;在图6B中,当提取次数固定在2次时,提取加水倍量的等高线密度比提取时间要大,所以,提取加水倍量对于6-姜辣素的含量影响较大。
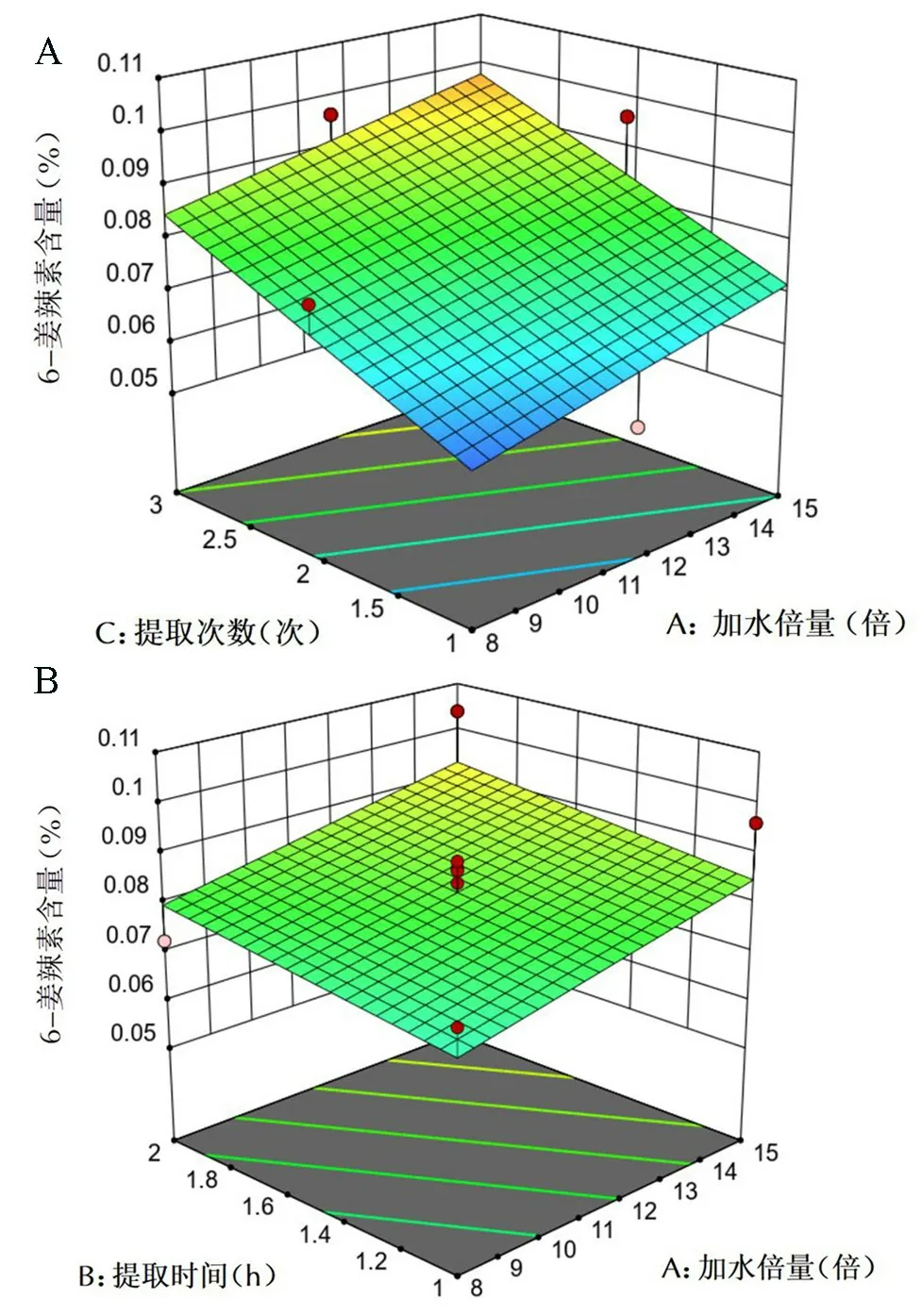
图6 各因素交互作用对6-姜辣素含量的影响的响应面及等高线图Fig 6 Response surface and contour plot of the effect of factor interaction on the content of 6-gingerol
2.6.6 出膏率的响应面分析 出膏率的响应面及等高线分析见图7,在指定变量范围内,三个变量对出膏率的影响中,提取次数最大,其次是提取时间,提取加水倍量影响最小,与方差结果分析基本一致。如图7A所示,当提取时间固定为1.5 h时,提取次数等高线密度大于提取加水倍量,因此,提取次数对于出膏率的影响更大;在图7B中,当提取次数固定为2次时,提取时间的等高线密度高于提取加水倍量,因此可以得出提取时间对出膏率影响更大。在图7C中,当提取加水倍量固定为11.5倍时,提取次数等高线密度要比提取时间更高,所以,提取次数对出膏率影响更大。

图7 各因素交互作用对出膏率影响的响应面及等高线图Fig 7 Response surface and contour plot of the effect of factor interaction on the paste yield
2.7 设计空间的建立及验证
2.7.1 设计空间的建立 前期研究表明基准样品标准中芍药苷的含量在0.5150%~ 0.8811%,6-姜辣素的含量在0.0198%~ 0.0337%,研究设定优化目标为该标准范围再分别加上前期预试验浓缩干燥过程芍药苷和6-姜辣素的损失率,因此最终设定优化目标为芍药苷含量为0.7357%~1.2587%;6-姜辣素含量为0.0396%~0.0674%;出膏率为10.00%~14.85%。在优化的工艺参数空间内搜集所有符合设定目标的参数,构建出设计空间并用Overlay Plot进行展示,结果如图8所示。黄色部分即为提取工艺的可优化控制空间。因此将真武汤的提取工艺范围定为:提取加水量8~10.39倍;提取时间60~100 min;提取次数固定为1次。

图8 真武汤提取工艺的设计空间Fig 8 Design space of Zhenwu decoction extraction process
2.7.2 验证试验 为验证响应面结果的可靠性,在设定的优化工艺参数空间内搜集符合目标的组别,选取设计空间内的三个点进行验证,根据实际情况对组别中的提取工艺参数调整如表6所示,按照调整后的提取参数进行验证试验,每组平行3份,验证结果见表7。按照提取工艺进行提取后,其结果均能达到预测值,表明在优化工艺参数空间内验证的这几组均能达到提取工艺的预期目标。考虑到实际生产问题及便于操作,因此后期采用第三组的工艺参数进行提取:提取加水倍量10倍,提取时间60 min,提取次数1次。

表6 响应面设计空间试验点的选取Tab 6 Selection of spatial test points for response surface design
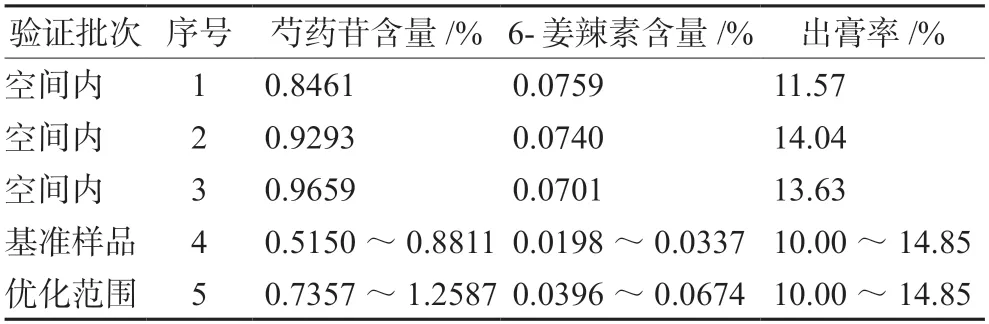
表7 响应面试验验证结果Tab 7 Verification test of response surface
3 讨论
按照《古代经典名方中药复方制剂及其物质基准的申报资料要求(征求意见稿)》,绘制特征图谱并对指标性成分含量和浸出物进行检测应作为CQAs来检验基准样品和颗粒剂间的量值传递关系[7],前期研究显示,基准样品指纹图谱相似度均在0.9以上,相似度良好[6],因此不再以此作为评价指标,芍药苷为白芍的主要成分,6-姜辣素为生姜的主要成分,出膏率对提取液亦有显著影响,故选取芍药苷、6-姜辣素和出膏率作为评价标准。
在由传统砂锅煎煮向现代提取工艺转化过程中,改变工艺参数常导致指标性成分含量大幅改变。所以对制备工艺特别是提取工艺进行研究,是经典名方研制过程中至关重要的环节。在QbD理念下,认识原料、工艺与产品质量多维组合及相互作用,从而可以达到对产品CQAs的预测[2],QbD理念应用的一个关键是设计空间的构建[8]。在单因素试验的基础上选择三因素三水平并使用响应面法,采用多元回归方程拟合各因素与效应值的函数,并以最佳工艺水平为目标,对工艺参数进行预测与优选[9-13],将芍药苷与6-姜辣素的含量及出膏率均设置在一定的范围之内,对设计空间进行筛选,可有效地对试验条件进行优化,并为后续真武汤颗粒剂的工业化生产提供了可控范围。
前期考察发现在提取-浓缩-干燥过程中,芍药苷和6-姜辣素均具有较高的损失率,可能是高温影响芍药苷稳定性的原因[14]。6-姜辣素在高温条件下会转化为醛类物质,并且还会受到合剂水溶液环境的影响[15]。因此在考察提取时间时充分考虑了指标性成分损失率高的实际情况,选取2 h为高水平。并且添加到设计空间优化的目标条件中,以便使该制剂间体与基准样品质量属性接近。
4 结论
本研究基于QbD理念,通过失效模式及效应分析(FMEA)进行风险评估,结合经验筛选工艺参数,进一步采用Box-Behnken优化真武汤提取工艺,建立其设计空间,最终确定的提取工艺为:提取加水倍量10倍、提取时间60 min、提取次数1次。验证试验证明,该工艺参数正在确立中的设计空间发生了变化,产品仍然可以实现预期目标,为后续颗粒剂的干燥、浓缩、成型工艺奠定基础。

