白藜芦醇纳米结构脂质载体的制备与体外释放研究
崔欣冉,张程皓,唐景玲(哈尔滨医科大学药学院,哈尔滨 150086)
白藜芦醇(Res)是一种天然多酚化合物[1],主要分布在药用植物和食物中,包括虎杖、决明、花生以及葡萄等。它是植物体在逆境或遇到病原侵袭时分泌的一种天然植保素,具有毒副作用小的特点,同时又具有抗炎、抗氧化、抗菌、抗肺纤维化[2]以及心血管保护等多种药理效应,潜在的应用前景备受关注。然而,Res难溶于水、稳定性较差且代谢迅速,亟须寻找适宜的载体对其进行改善。
纳米结构脂质载体(NLCs)目前已经作为通用载体出现,它是由固体脂质纳米粒(SLNs)发展而来的一种新型药物递送平台[3-4],通过在固体脂质中引入一定比例的液体脂质并将两者混合制备而成。液体脂质的加入能够破坏SLNs有序的晶体结构,使NLCs增加更多空间,并可有效防止药物的泄漏,从而增强载药能力[5]。相较于其他载体(胶束、纳米乳、脂质体),NLCs不仅具备高生物相容性、高稳定性以及高生物利用度等优势,还能通过调控不同比例的固液脂质比形成稳定的固体骨架结构从而实现更好的药物控释[6-8]。因此本研究将Res制备成纳米结构脂质载体,旨在提高Res溶解度,增加其稳定性,提高生物利用度,并对白藜芦醇纳米结构脂质载体(Res-NLCs)的体外释放进行评价,以期为Res的新剂型研究提供理论基础。
1 材料
1.1 仪器
BSA124S-CW 电子天平(赛多利斯科学仪器北京有限公司);1260 Infinity 高效液相色谱仪(美国 Agilent 公司);NanoZS90 光散射粒径分析仪(英国 Malven 公司);SZCL-4 数显智能恒温磁力搅拌器(上海卓康生物科技有限公司);Nano微射流均质机(上海诺泽流体科技有限公司);5430R 低温超速离心机(德国 Eppendorf 公司);HZQ-C 空气浴振荡器(哈尔滨市东联电子技术开发有限公司)。
1.2 试药
白藜芦醇(含量>99%,批号:B1807119,上海阿拉丁生化科技股份有限公司);大豆磷脂(LEC)(批号:SY-SO-200801,上海艾伟拓医药科技有限公司);吐温80(Tween-80)(批号:SYSO-200801,天津市富宇精细化工有限公司);双硬脂酸甘油酯(GD)(批号:H14M10Z82904,嘉法狮上海贸易有限公司);辛酸癸酸聚乙二醇甘油酯(Lab)(批号:F2102301,上海阿拉丁生化科技股份有限公司);无水乙醇(天津市天力化学试剂有限公司);甲醇(山东禹王实业有限公司);乙腈(天津市科密欧化学试剂有限公司)。
2 方法与结果
2.1 Res-NLCs的制备
本实验选择毒性低,具有良好乳化能力的GD和LEC作为固体脂质;并对Res在不同液体脂质中的饱和溶解度进行测定,选择溶解度最高的Lab作为液体脂质,同时以Tween-80作为乳化剂,通过乳化蒸发-高压均质法制备Res-NLCs。称取处方量的Res、LEC置于EP管中加入3 mL无水乙醇超声溶解后待用,将GD、Lab加热至75℃溶解,然后将脂质与药物乙醇溶液混合均一使成油相;称取适量Tween-80置于烧杯中,加入20 mL纯化水搅拌均匀使成水相;将油、水两相同时加热到75℃后,使油相缓缓滴进保持搅拌的水相中后继续搅拌,直至有机试剂挥干得初乳;使用均质机,对初乳均质3次循环(6000 psi),完成后冷冻固化得Res-NLCs。
2.2 超滤离心法测定Res-NLCs的包封率和载药量
2.2.1 超滤离心法药物回收率 取 400 μL Res 溶液于超滤离心管内管中,13 500 r·min-1低温离心 30 min,将外管中溶液采用流动相分别稀释至16、20、24 μg·mL-1,进样分析,计算Res的回收率。3种不同浓度的Res回收率均在98.48%~101.68%,RSD值均在0.13%~0.29%,符合方法学要求。
2.2.2 Res-NLCs的包封率及载药量的测定 采用超滤法[9],取定量Res-NLCs溶液,置于截留分子量为100 kD的超滤离心管内管,并将内外管进行组装,放入低温超速离心机离心30 min(13 500 r·min-1、4℃),取外管中分离下来的游离药物溶液进行稀释,采用HPLC分析,测得游离Res含量(W1);同时取Res-NLCs溶液,加入乙腈稀释同等倍数,超声15 min进行破乳,通过HPLC分析,即得Res总含量(W2)。
按照下式计算Res-NLCs包封率(EE)及载药量(DL):包封率(%)=[(W2-W1)/W2]×100%;载药量(%)=(W3/W4)×100%。其中,W1代表NLCs未包封的药物含量,W2代表Res的总含量,W3代表NLCs中包封Res的总含量,W4代表Res-NLCs的总重量。
2.3 正交试验优化Res-NLCs的处方
基于前期单因素筛查所得结果,选择固液脂质比(A)、Tween-80质量浓度(B)、均质压力(C)、均质次数(D)4个因素,每个因素设置3个水平,以包封率作为优化指标,设计正交试验,优化Res-NLCs的处方。设计表见表1。

表1 正交设计因素水平Tab 1 Factor and level of orthogonal experiment
每个因素对指标(EE)的影响程度见表2,由极差(Rj)可知因素影响大小次序为:C>A>B>D,由均值大小可判断最佳处方为A3B3C2D2。方差分析结果(见表 3)显示,在以D(均质次数)为误差项的前提下,因素A(固液脂质比)、B(Tween-80质量浓度)、C(均质压力)对包封率具有显著性影响(P<0.05)。优化后得到的最优处方为:GD用量为0.0356 g,LEC用量为0.3918 g,Tween-80的质量浓度为4.25%,Lab用量为0.0475 g;最佳制备工艺为:均质压力6000 psi,均质次数30次。按照最优处方平行制备3批Res-NLCs,测得包封率和载药量的平均值分别为(98.43±0.07)% 和(11.04±0.14)%。
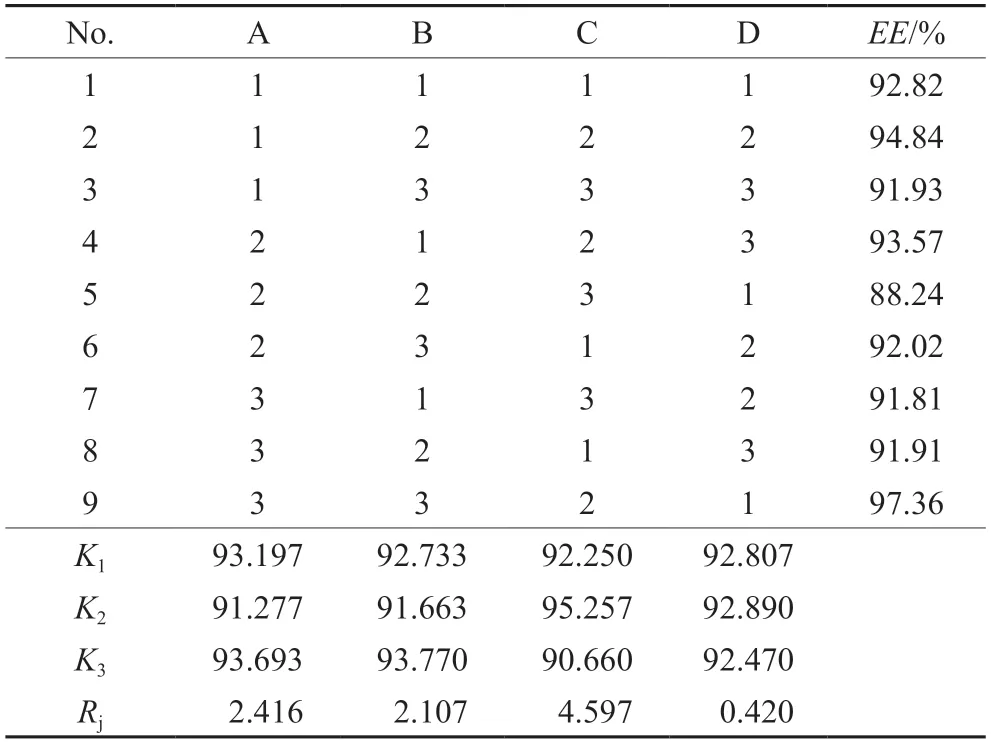
表2 正交试验结果Tab 2 Orthogonal experiment

表3 方差分析Tab 3 Analysis of variance
2.4 Res-NLCs的外观形态
将适量新鲜制备的Res-NLCs用纯化水稀释至适当浓度后,取一滴置于覆有支撑膜的铜网上,静置待其自然干燥,然后用透射电子显微镜观察样品形貌。Res-NLCs的外观图如图1所示,制剂澄清透明,具有淡蓝色乳光。Res-NLCs的透射电镜结果如图 2 所示,Res-NLCs呈规则圆球状,大小均一,无粘连,粒径较小且分散性良好。

图1 Res-NLCs的外观图Fig 1 Appearance of Res-NLCs

图2 Res-NLCs的透射电镜图Fig 2 Transmission electron microscopy of Res-NLCs
2.5 Res-NLCs粒径及Zeta电位的测定
采用光散射粒径分析仪测定Res-NLCs的粒径及Zeta电位,精密吸取10 μL新制备的最优处方的Res-NLCs,用纯化水稀释至1 mL,混合均匀后,放入仪器测定粒径及多分散系数(PDI)。结果如图3 A所示,Res-NLCs的粒径为(81.87±0.14)nm,PDI为(0.099±0.02)。另取适量Res-NLCs放入样品池,测定其Zeta电位。结果如图3B所示,Res-NLCs的Zeta电位为(-8.09±0.75)mV。
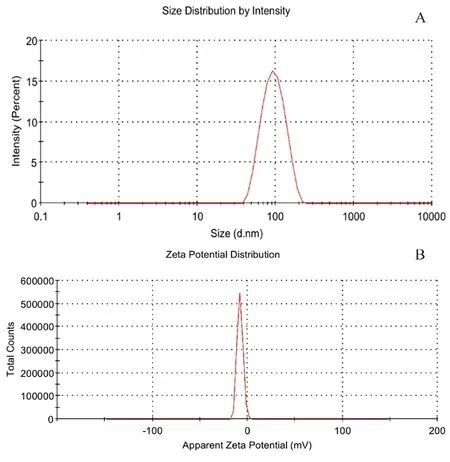
图3 Res-NLCs的粒径(A)和Zeta电位(B)Fig 3 Particle size(A)and Zeta potential(B)of Res-NLCs
2.6 Res-NLCs的稳定性考察
按照最优处方平行制备3份Res-NLCs,放置于 4℃ 冷藏柜,避光储存,并分别于 0、1、7、21、30 d测定其包封率和粒径以考察Res-NLCs的稳定性。结果如图4所示,在4℃条件下,Res-NLCs的包封率在第21日有所下降,30 d内降至88.52%,粒径略有上升,表明 Res-NLCs 在此条件下避光储存21 d基本稳定。
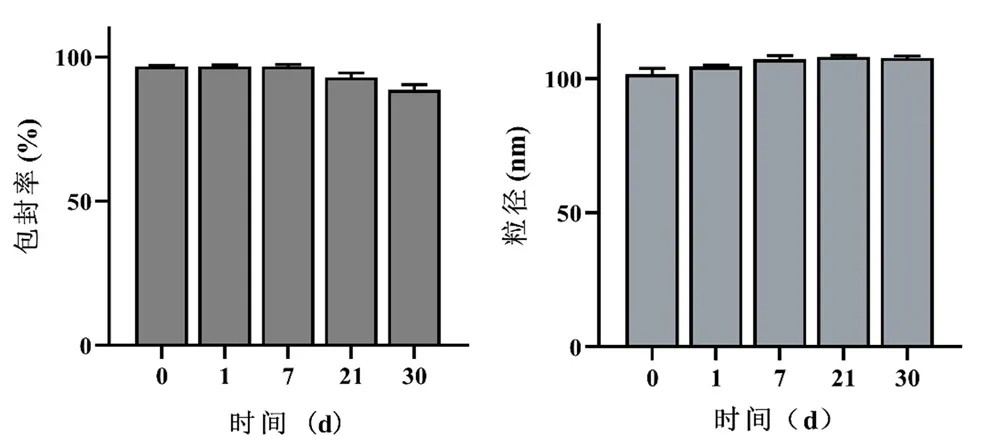
图4 不同储存时间对Res-NLCs 包封率和粒径的影响Fig 4 Effect of different storage time on the EE and DL of Res-NLCs
图5 白藜芦醇色谱图Fig 5 Chromatogram of resveratrol
2.7 Res-NLCs的体外释药行为研究
2.7.1 色谱条件 色谱柱:Diamonsil C18柱(4.6 mm×250 mm,5 μm);流动相:乙腈-水(含0.05%磷酸)(68∶32);柱温:30℃;检测波长:305 nm;进样量:10 μL;流速:1.0 mL·min-1。
2.7.2 溶液的配制
① 空白溶液:配制pH为7.4的含0.3%(w/V)Tween-80的PBS溶液,作为释放介质。
② 对照品溶液:精密称取Res对照品10 mg,用释放介质溶解并定容至50 mL,即得200 μg·mL-1Res的药物母液。
③ 供试品溶液:移取1 mL Res-NLCs,用释放介质定容至10 mL,即得。
2.7.3 专属性试验 取“2.7.2”项下的空白溶液、对照品溶液、供试品溶液,稀释至一定浓度后,过滤,进样,考察NLCs成分以及释放介质是否干扰药物含量测定。结果如图 5所示,Res峰形良好且未见杂峰,表明释放介质对Res的含量测定无干扰,该方法专属性符合要求。
2.7.4 线性关系考察 取“2.7.2”项下的对照品溶液,用释放介质稀释成0.1、0.5、1.0、5.0、10.0、15.0和20.0 μg·mL-1系列对照溶液,进样测定并记录峰面积(A)。绘制标准曲线,得回归方程为:A=57.778C-3.7319,r=0.9998。结果表明Res在0.1~20.0 μg·mL-1与峰面积线性关系良好。
2.7.5 精密度考察 分别配制低(0.5 μg·mL-1)、中(5.0 μg·mL-1)和高(15.0 μg·mL-1)质量浓度的Res溶液,于1 d内连续5次进样分析,得日内精密度;5 d内同法进样,得日间精密度。结果RSD值均在0.30%~1.7%,表明方法的精密度符合要求。
2.7.6 回收试验考察 取适量Res对照品溶液加入释放介质中,分别配制成质量浓度为低(7.5 μg·mL-1)、中(12.0 μg·mL-1)和高(15.0 μg·mL-1)的Res溶液,进样测定,计算回收率。3种不同浓度的Res回收率在98.88%~101.82%,RSD值均在0.26%~0.72%,表明该方法准确度良好。
2.7.7 稳定性考察 将供试品溶液放置于室温,于24 h内每隔2 h进样一次,计算出各时间点药物浓度的RSD。结果得出RSD为0.46%,表明Res供试品溶液放置24 h内稳定性良好。
2.8 Res-NLCs中Res的体外释药行为研究
采用正向动态膜透析法[10]考察Res-NLCs的体外释药行为,使用0.3%(w/V)Tween-80的PBS(pH 7.4)作为释放介质。将1 mL Res-NLCs和1 mL Res溶液(溶剂为PEG 400)分别放入透析袋(截留分子量:8~14 kD),将透析袋两端固定好后放入烧杯中,加入200 mL释放介质,并保证将透析袋浸没于液面下,使烧杯保持在恒温振荡器内(37℃、100 r·min-1),分别于0.25、0.5、1、2、4、6、8、10、24、36和48 h 吸取1 mL释放液,并补加同体积的等温释放介质,以保证释放介质体积一致。样品经微孔滤膜过滤后,按“2.7.1”项下色谱条件进行含量测定(n=3),代入以下公式,得Res释放含量,绘制释放曲线(见图6)。
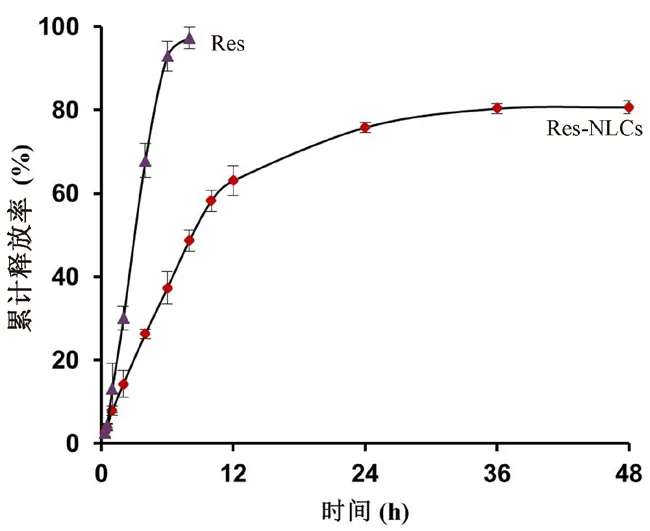
图6 Res-NLCs及Res溶液中Res的释放曲线(±s,n=3)Fig 6 In vitro release curve of Res in Res-NLCs and resveratrol solution(±s,n=3)
其中Cn为Res在t时刻测得的浓度,Ci为Res在t时刻之前测定的浓度,V0为接收池中加入的溶液体积,V为取样体积,Q0为起始时Res总量。Res-NLCs和Res溶液在48 h内的释放曲线如图6所示,Res溶液释放相对快速,8 h 内累计释放97.31%;Res-NLCs在48 h内持续释放,累计释放80.69%;Res-NLCs与Res溶液相比明显释放缓慢,延长了释放时间。
同时,还引入 4 种释放模型对 Res-NLCs的释放曲线进行模型拟合。结果如表4所示,释放数据拟合到Makoid-Banakar 模型时R2=0.9924,表明 Res从 NLCs中的释放最适合Makoid-Banakar释放模型,并且相关系数r为0.87,在0.45~0.89,说明 Res 的释放机制属于溶蚀与扩散相结合。

表4 Res-NLCs释放曲线的数学模型拟合Tab 4 Model fitting of release curves of Res-NLCs
3 讨论
本试验采用乳化蒸发-高压均质法制备Res-NLCs[11],粒径较小且分布均匀,同时液体脂质的加入使其具有较高的包封率及载药量。在Res-NLCs的制备过程中发现,随着固体脂质比例的增加,包封率逐渐增大,这可能和固体脂质与药物具有较好的相容性有关;较小剂量液体脂质的加入可以破坏其内部的晶格结构,增加其包封率,但过多液体脂质的加入,可能会降低药物与脂质之间的相容度,反而导致包封率下降。
在体外释放试验中,由于Res水溶性较差,因此需要加入适宜的表面活性剂来改善溶解性。预试验分别考察了Res在含0.1%~1.0%(w/V)Tween-80的PBS溶液中的饱和溶解度,最终选择符合漏槽条件的含0.3%(w/V)Tween-80的PBS(pH 7.4)溶液作为释放介质,当然,这种介质并不能完全代替体内的释放条件,体内会存在各种代谢酶且具备更复杂的机体机能,可能最终会导致Res-NLCs中药物的完全释放。释放曲线的研究结果表明,Res-NLCs前期释放相对快速可能归因于有部分Res吸附在NLCs表面,导致快速渗透;而NLCs中包裹的Res可能以无定形状态存在于有缺陷的晶格空间或固、液脂质层中,导致释放相对困难,扩散缓慢[12],因此Res-NLCs可以显著延长释放的时间,展现出良好的缓释效果,有望改善Res在体内代谢快,吸收差的缺点。本试验制备的Res-NLCs达到预期提高Res生物利用度的目的,后期将继续对Res-NLCs体内药代动力学、体内外药效学继续进行研究,以从多方面深入探讨Res-NLCs的剂型优势。

