平衡透析结合LC-MS/MS法测定大鼠血浆中游离SN-38浓度及其药代动力学应用
罗珍华,宋成慧,李小川,张枢,张维维,李玉杰,段小群,徐笑天*(.桂林医学院 药学院,广西 桂林 5499;.苏州旭辉检测有限公司,江苏 苏州 56;.桂林医学院 生物医药产业学院,广西 桂林 5499)
7-乙基-10-羟基喜树碱(SN-38)是一种高效的选择性拓扑异构酶Ⅰ抑制剂[1],由伊立替康在体内经过羧酸酯酶转化的代谢产物,其活性较伊立替康强100~1000倍,是结直肠癌的一线化疗药物[2]。然而,SN-38的疏水性和不稳定性限制了其临床应用[3]。研究表明SN-38在大鼠体内的生物利用度较低[4],这与其在体内跟血浆蛋白的结合有关。
药物的血浆蛋白结合率是药代动力学的重要参数,是药物临床评价的必要指标。常用的测定方法有平衡透析法、凝胶过滤法和离心超滤法等[5-6]。在前期试验过程中发现采用离心超滤法预处理,对SN-38吸附性较强,凝胶过滤法操作较为烦琐,且对于样本量较大时不适用,而平衡透析法的主要优点是可测定处于平衡状态下的游离型药物的浓度,可以最大限度反映药物在体内的情况,操作方便快捷,抗吸附能力较强,温度易于控制,设备成本低廉,实验原理简单。研究表明SN-38与血浆中的蛋白结合率在90%以上[7-8],实际上能真正发挥药理作用的是不与血浆蛋白结合的游离药物。目前,国内多项研究采用LCMS/MS法测定SN-38的血药浓度[9-10],这些研究多是测定血浆中SN-38的总浓度,并不能准确反映发挥药理作用部分的游离SN-38浓度。本实验以[2H5]SN-38为内标,优化了实验条件,采用平衡透析法分离出游离SN-38,建立平衡透析结合LC-MS/MS的检测方法,用蛋白沉淀法预处理透析液侧(F侧)、透析后血浆侧(T侧)和血浆样品检测其SN-38 的浓度;根据公式计算得到大鼠体内游离SN-38的浓度。该方法灵敏度高、简单快速,可为开展临床研究提供方法学的支持。
1 材料
1.1 仪器
LC-20AD高效液相色谱仪(日本岛津);API 4000、QTRAP 6500型质谱(AB SCIEX.PTE.LTD.,其中API 4000型质谱用于总SN-38浓度及T侧SN-38浓度的测定,QTRAP 6500型质谱用于F侧SN-38浓度测定);96孔平衡透析装置(HTD 96 b-Complete Unit)、平衡透析膜(HTD 96 b-Adhesive Sealing Film)(HTDialysis);高速冷冻离心机(5810R,Eppendorf);精密电子天平(Secura 225D-1CN,Sartorius)。
1.2 试药
盐酸伊立替康对照品(批号:100767-202004,纯度:86.6%,中国食品药品检定研究院);SN-38对照品(批号:C020GWS22001,纯度:95.3%,四川协力制药股份有限公司);[2H5]SN-38内标对照品(批号:1J165-X1,纯度:97.74%,ISOREAG);磷酸盐(PBS)片剂(批号:1227H0310,Solarbio);乙腈(批号:205906)、甲酸(批号:C13594075)(Thermo Fisher);纯水为实验室自制超纯水。
1.3 生物基质
1.3.1 大鼠空白血浆 采用腹主动脉采血的方式采集大鼠血液,血液置于肝素钠管中轻轻摇8次,3500 r·min-1离心10 min,取上层血浆于-80℃冰箱冷冻备用。用于血浆样品及T侧样品的标准曲线和质控样品的配制。
1.3.2 空白生物基质 采用96孔平衡透析装置,将50 μL空白大鼠血浆样品加入到每个透析孔的给药端,在透析孔对应的接收端中加入100 μL 0.01 mol·L-1PBS缓冲液,将透析板置于医用冷藏箱中,在4℃下孵育24 h。经过平衡透析后得到的PBS缓冲液与空白大鼠血浆混合后的生物基质作为空白生物基质(2∶1),用于配制F侧样品的标准曲线和质控样品。
2 方法与结果
2.1 标准溶液配制
精密称取适量SN-38对照品10 mg,置棕色瓶中,经质量校正后以二甲基亚砜溶解[11]至1 mg·mL-1,得SN-38储备液。取适量SN-38储备液用50%乙腈配制系列浓度Ⅰ(分别为10、100、200、1000、2000、4000、10 000、20 000 ng·mL-1)和系列浓度Ⅱ(分别0.8、4、8、20、80、200、800、1600 ng·mL-1)溶液。精密称取适量[2H5]SN-38对照品10 mg,置棕色瓶中,以二甲基亚砜溶解至1 mg·mL-1,得[2H5]SN-38内标储备液。取一定量的[2H5]SN-38内标储备液,经质量校正后以0.1%甲酸乙腈为溶剂,分别将[2H5]SN-38内标储备液稀释至浓度为20 ng·mL-1的内标溶液A和1 ng·mL-1的内标溶液B。以上所有溶液于-20℃储存,临用前用50%乙腈稀释到所需浓度。
2.2 PBS缓冲液配制
取PBS片剂1片,溶于100 mL纯水中,得到浓度为0.01 mol·L-1,pH为7.2~7.4的PBS缓冲液,4℃储存备用。
2.3 分析条件
2.3.1 血浆样品及T侧样品的分析条件
① 色谱条件:色谱柱为Agilent ZORBAX Eclipse Plus C18色谱柱(2.1 mm×50 mm,3.5 μm);流动相为0.1%甲酸水溶液(A)-0.5%甲酸乙腈(B),梯度洗脱(0~0.6 min,20%B;1.6~2.20 min,95%B;2.21~3 min,20%B;3 min停止);流速0.60 mL·min-1,进样量2.00 μL;柱温40℃。
② 质谱条件:采用电喷雾离子源(ESI),离子源温度550℃,离子喷雾电压5500 V,辅助加热气压力55 psi,雾化气压力55 psi,气帘气压力20 psi,碰撞气12 psi,去簇电压90 V,碰撞电压39 V;检测方式为多反应监测(MRM)正离子模式;用于定量分析的离子对分别为:m/z393.1→349.1(SN-38)、m/z398.3→354.3([2H5]SN-38)。
2.3.2 F侧样品的分析条件
① 色谱条件:色谱柱及流动相同“2.3.1”项下;梯度洗脱(0~0.8 min,10%B,1.6~2.20 min,90%B;2.21~3 min,10%B;3 min停止);流速0.50 mL·min-1,进样量2.00 μL;柱温40℃。
② 质谱条件:采用ESI,离子源温度550℃,离子喷雾电压5500 V,辅助加热气压力55 psi,雾化气压力55 psi,气帘气压力40 psi,碰撞气9 psi,去簇电压158 V,碰撞电压35 V。检测方式及定量分析的离子对同“2.3.1”项下。
2.4 平衡透析方法[12-13]
实验前先将透析膜用重蒸馏水淋洗两遍,装好透析装置,将100 μL血浆样品加入到每个透析孔的给药端,在透析孔对应的接收端中加入200 μL 0.01 mol·L-1的PBS缓冲液。将透析板置于4℃下平衡24 h完成透析平衡。
2.5 样品预处理
2.5.1 血浆样品及T侧样品处理 取血浆样品60 μL或T侧样品60 μL,分别加入540 μL内标溶液A,涡旋约1 min,15 400 g,4℃,离心10 min,取上清液进行LC-MS/MS分析。
2.5.2 F侧样品处理 透析完成后,防止透析液侧SN-38被吸附,取F侧溶液40 μL分别加入20 μL按照“1.3.2”项下制备的大鼠空白血浆配制成F侧样品,涡旋混匀后加入180 μL内标溶液B,涡旋约1 min,15 400 g 4℃离心10 min,取上清液进行LC-MS/MS分析。
2.6 方法学验证
2.6.1 血浆样品专属性 精密吸取大鼠空白血浆95 μL,分别加入SN-38储备液及内标储备液[2H5]SN-38;按照“2.5.1”项下方法处理后进行LC-MS/MS分析。结果表明,大鼠空白血浆中的内源性物质不干扰SN-38的测定,[2H5]SN-38与SN-38之间也互不干扰(见图1),说明该方法的专属性好。
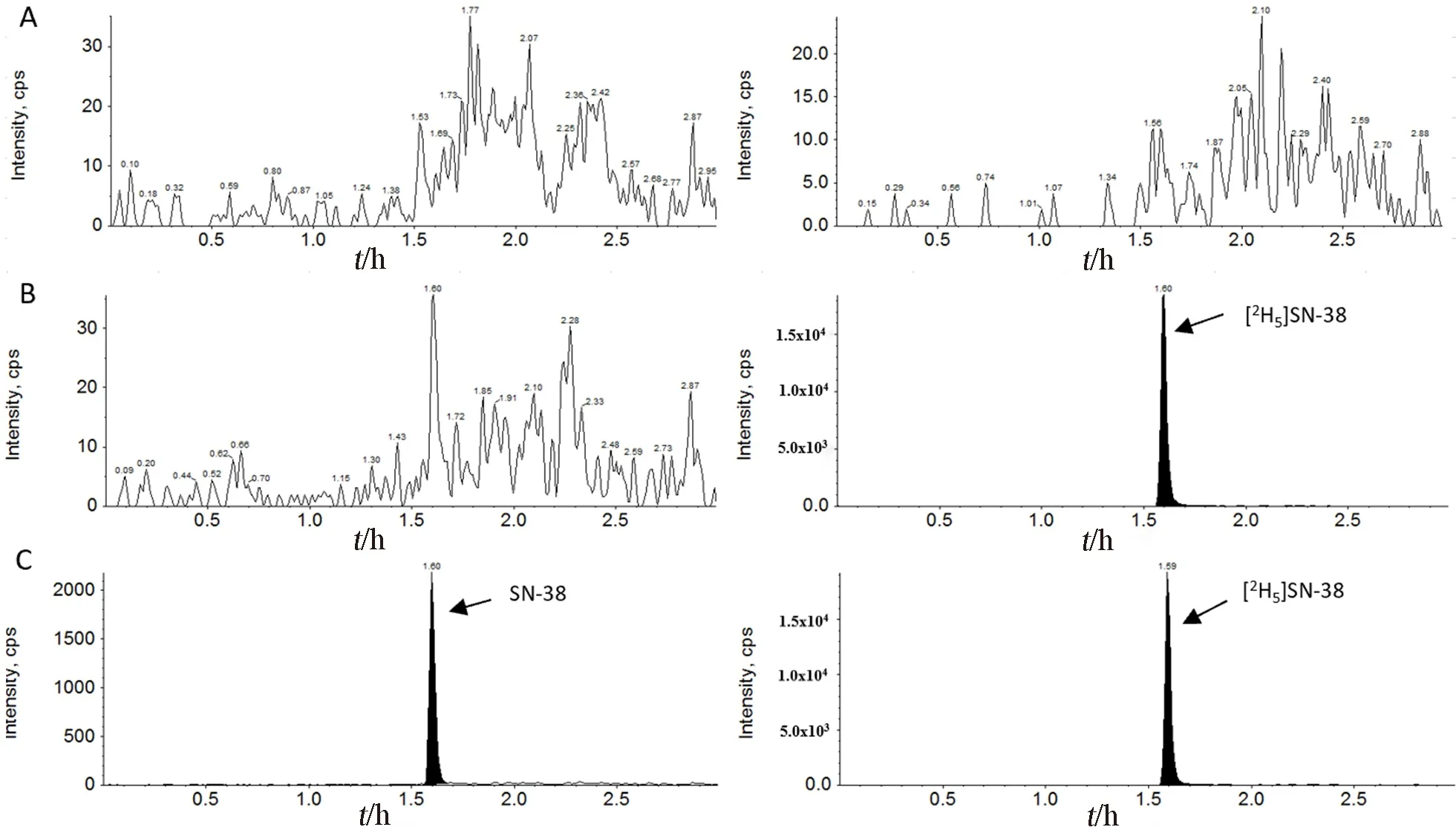
图1 血浆样品专属性Fig 1 Specificity of plasma samples
2.6.2 F侧样品专属性 精密吸取空白生物基质95 μL,分别加入SN-38储备液及内标储备液[2H5]SN-38;按照“2.5.2”项下方法处理后进行LC-MS/MS分析。结果表明,空白生物基质中的内源性物质不干扰SN-38的测定,[2H5]SN-38与SN-38之间也互不干扰(见图2),说明该方法的专属性好。

图2 F侧样品专属性Fig 2 Specificity of samples on the F side
2.6.3 线性关系考察 取大鼠空白血浆95 μL,分别加入SN-38系列浓度Ⅰ溶液各5 μL,得到含SN-38质量浓度分别为0.5、5、10、50、100、200、500、1000 ng·mL-1的血浆标准样品。按照“2.5.1”项下方法对样品进行处理。取上清液进行LC-MS/MS分析,以对照品峰面积与内标峰面积之比为纵坐标(Y),以待测物浓度与内标(内标浓度归一化)之比为横坐标(X),线性拟合成标准曲线,权重系数为1/χ2,得到血浆样品中SN-38的回归方程为y=0.0107x+0.000 924(r=0.9990),这说明血浆样品中SN-38在0.5~1000 ng·mL-1与峰面积线性关系良好,定量下限为0.5 ng·mL-1。
取“1.3.2”项下空白生物基质95 μL,分别加入SN-38系列浓度Ⅱ溶液各5 μL,得到含SN-38质量浓度分别为0.04、0.2、0.4、1、4、10、40、80 ng·mL-1的F侧标准样品。按照“2.5.2”项下方法对样品进行处理。取上清液进行LC-MS/MS分析,以对照品峰面积与内标峰面积之比为纵坐标(Y),以待测物浓度与内标(内标浓度归一化)之比为横坐标(X),线性拟合成标准曲线,权重系数为1/χ2,得到F侧样品中SN-38的回归方程为y=0.294x-0.00128(r=0.9969),说明F侧样品中SN-38在0.04~80 ng·mL-1与峰面积线性关系良好,定量下限为0.04 ng·mL-1。
2.6.4 精密度与准确度 按照“2.1”项下方法配制制备SN-38质量浓度为1、20、400、800 ng·mL-1的血浆质控样品。按照“2.5.1”项下方法对样品进行处理,每个浓度重复6次,与标准曲线同批测定,连续测定3 d。计算血浆SN-38的精密度(RSD)与准确度(RE),结果见表1。
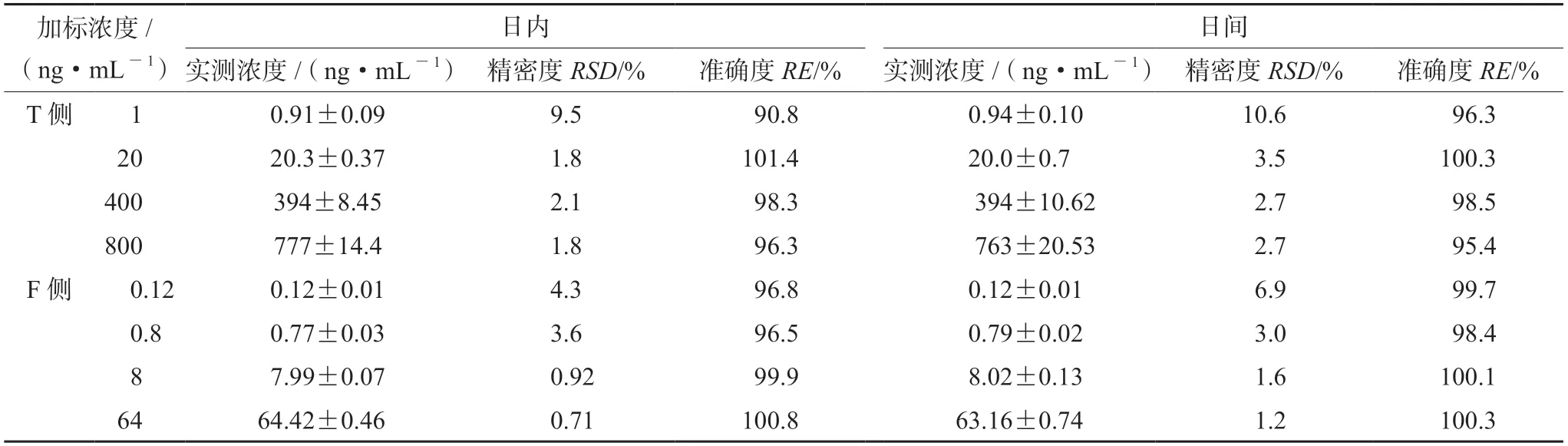
表1 SN-38在T侧和F侧样品中的日内及日间精密度和准确度(Mean±SD,n=6)Tab 1 Intra-day and inter-day precision and accuracy of SN-38 in the plasma of T side and F side (Mean±SD,n=6)
按照“2.1”项下配制F侧样品标准曲线的方法,同法制备SN-38质量浓度为0.12、0.8、8、64 ng·mL-1的F侧质控样品。按照“2.5.2”项下方法处理,每个浓度重复6次,与标准曲线同批测定,连续测定3 d。计算F侧SN-38的精密度(RSD)与准确度(RE),结果见表1。
2.6.5 提取回收率 取大鼠空白血浆样品配制20、400、800 ng·mL-1的血浆样品,用得到的峰面积与用空白血浆样品离心后的上清液作为生物基质,按照“2.1”项下方法配制血浆样品标准曲线,并按照“2.5.1”项下方法对样品进行处理的未提取浓度样品的峰面积进行比较。每个浓度6份样本分析,考察血浆样品的提取回收率。大鼠空白血浆中SN-38的提取回收率在97.3%~99.5%,表明该方法回收率稳定,结果见表2。
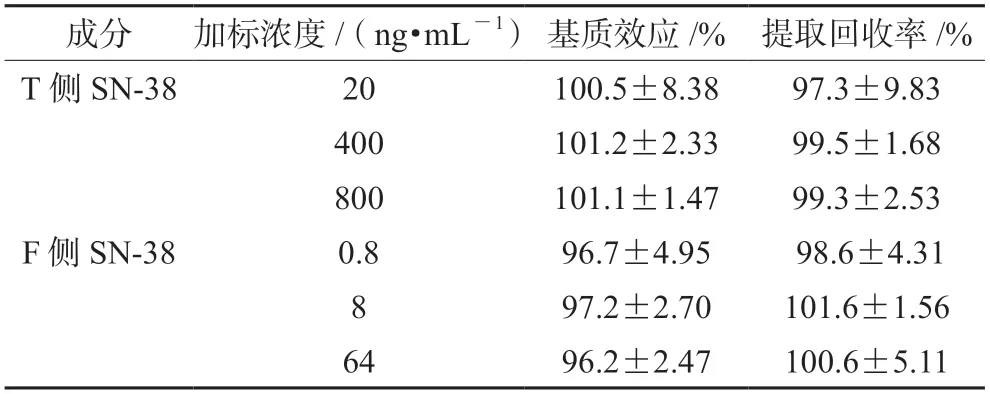
表2 SN-38在T侧和F侧样品中的提取回收率和基质效应(Mean±SD,n=6)Tab 2 Matrix effect and extraction recovery of SN-38 and [2H5] SN-38 in T side and F side (Mean±SD,n=6)
取空白生物基质配制0.8、8、64 ng·mL-1的样品,用得到的峰面积与用空白血浆样品离心后的上清液作为生物基质,按照“2.1”项下方法配制F侧样品标准曲线,并按照“2.5.2”项下对样品进行处理的未提取浓度样品的峰面积进行比较。每个浓度6份样本分析,考察F侧样品的提取回收率。空白生物基质中SN-38的提取回收率在98.6%~101.6%,表明该方法回收率稳定,结果见表2。
2.6.6 基质效应 以大鼠空白血浆配制20、400、800 ng·mL-1的提取后血浆样品,与以溶剂配制的同浓度样品进行峰面积比较。每个浓度6份样本,考察血浆样品的基质效应,结果见表2。
取透析后空白生物基质配制0.8、8、64 ng·mL-1的提取后基质样品,与以溶剂配制的同浓度的样品进行峰面积比较。每个浓度6份样本,考察F侧样品的基质效应,结果见表2。
2.6.7 稳定性 配制质量浓度分别为20、800 ng·mL-1的血浆质控样品,每个浓度6份样本,分别考察血浆样品在室温放置24 h、-20℃冷冻7 d、反复冻融3次,按照“2.5.1”项下方法对样品进行处理。配制质量浓度分别为0.8、64 ng·mL-1的F侧质控样品,每个浓度6份样本,分别在室温放置24 h、-20℃冷冻7 d、反复冻融3次后,按照“2.5.2”项下方法对样品进行处理。血浆样品或F侧样品中各两个质量浓度的质控样品在上述条件下的RSD均<10%,样品稳定性良好。结果分别见表3和表4。

表3 不同条件下T侧SN-38稳定性结果Tab 3 Stability of SN-38 in the plasma of T side at different conditions
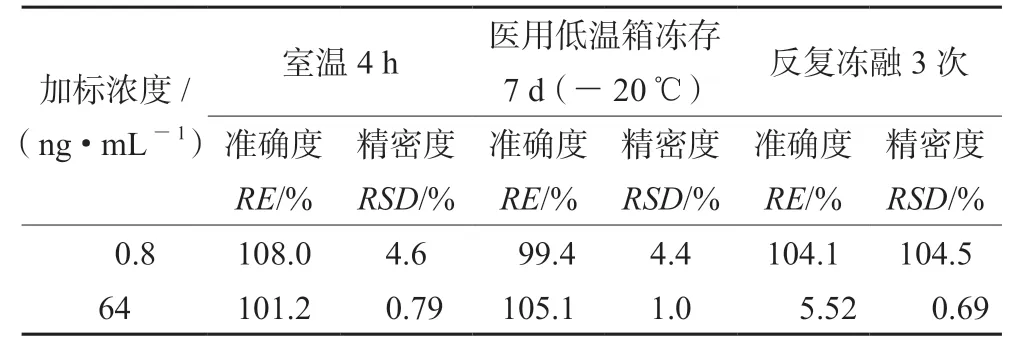
表4 不同条件下F侧SN-38稳定性结果Tab 4 Stability of SN-38 in the plasma of F side at different conditions
2.6.8 透析平衡时间的考察 取含800 ng·mL-1SN-38的血浆样品,平衡时间分别为12、24、36 h,将透析板置于4℃下,测定透析后T侧及F侧药物浓度。T侧按照“2.5.1”项下方法、F侧按照“2.5.2”项下方法对样品进行处理。由表5可知,当平衡时间为24、36 h时,测得的血浆蛋白结合率比较接近,且差异无统计学意义(P>0.05)。因此确定平衡时间为24 h,平衡温度为4℃。

表5 不同透析平衡时间的浓度的测定结果(Mean±SD,n=3)Tab 5 Concentration under different balance time (Mean±SD,n=3)
2.7 方法学应用
SD大鼠,雌雄各半,220~250 g [湖南斯莱克景达实验动物有限公司],实验禁食不禁水12 h。取大鼠3只,按照单剂量(5 mg·kg-1)尾静脉注射盐酸伊立替康注射液。于给药前0 h和给药后0.08、3、0.25、0.5、1、2、4、8、12、24 h从颌下静脉取血约0.5 mL置肝素钠抗凝试管中,3500 r·min-1离心10 min分离血浆,于-80℃冰箱中保存待测。
取血浆60 μL按“2.5.1”项下方法处理样品,再按“2.3.1”项下方法测定总SN-38浓度。剩余血浆取100 μL经96孔平衡透析装置透析后,取T侧样品60 μL按“2.5.1”项下方法处理样品,再按“2.3.1”项下分析方法测定T侧SN-38浓度;取F侧样品40 μL按“2.5.2”项下方法处理,再按“2.3.2”项下方法测定F侧SN-38浓度。以随行标准曲线得到各时间点的血药浓度,按照计算公式计算:Cf=Ct×(CF/CT);其中Ct是SN-38总浓度;Cf是SN-38游离浓度;CT是透析24 h后T侧SN-38浓度;CF是透析24 h后F侧SN-38浓度,结果见表6及图3。
表6 大鼠血浆中总SN-38及游离SN-38的平均血药浓度(±s,n=3)Tab 6 Mean plasma concentrations of total SN-38 and free SN-38 in rats (±s,n=3)

表6 大鼠血浆中总SN-38及游离SN-38的平均血药浓度(±s,n=3)Tab 6 Mean plasma concentrations of total SN-38 and free SN-38 in rats (±s,n=3)
时间/h总SN-38/(ng·mL-1)游离SN-38/(ng·mL-1)0 0 0 0 0 T侧/(ng·mL-1)F侧/(ng·mL-1)0.083534.33±75.05 503.33±83.6847.3±3.450.30±1.81 0.25226.67±21.94200.67±6.35 17.5±1.2519.73±1.85 0.5149.33±24.50 132.00±17.0612.03±1.5313.62±2.23 1114.87±16.31100.70±8.92 9.24±2.1610.54±2.77 2 76.27±11.71 69.37±9.10 6.11±1.05 6.76±1.30 431.37±6.42 28.10±7.772.36±0.6 2.64±0.47 8 4.51±1.43 3.97±1.38 0.4±0.15 0.45±0.15 12 1.62±0.49 1.28±0.34 0.16±0.05 0.20±0.08 240000
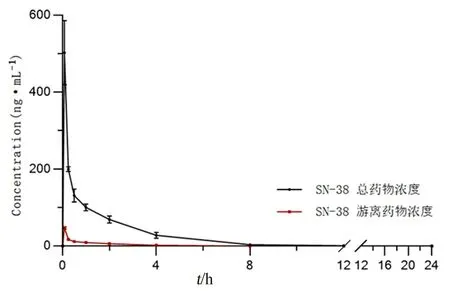
图3 大鼠血浆中总SN-38和游离SN-38浓度的平均药物浓度-时间曲线(n=3)Fig 3 Mean drug time concentration curve of total and free SN-38 concentrations in the rat plasma(n=3)
3 讨论
药物在吸收入血后以游离态和结合态两种形式存在,其中血浆蛋白结合率表示吸收进入人体后的药物与血浆蛋白结合形成的结合型药物,占全部药物总量的比例[14]。游离药物假说认为只有游离态的药物才能透过生物膜扩散到靶部位发挥药效[15];另外游离药物的比例还会显著影响药物分布、代谢和排泄的过程[16],血浆蛋白结合率与药物的诸多药理性质均有关。因此,近些年来游离药物浓度的血药浓度测定越来越受到国内外研究者的关注和重视[17-18]。
目前,由于方法技术的限制,游离药物浓度的测定在临床前药代动力学研究中的应用并不广泛[19]。本文采用的平衡透析法[20],具有操作简单、分析成本低、待测物在透析装置上吸附少等特点[21]。与已报道的文献研究相比[9,22],本文所建立的分析方法定量下限低,线性范围宽,提取回收率高,因此测定游离SN-38浓度更有优势。难溶性药物通过注射方式给药一直是药剂学研究中的难点,然而白蛋白作为难溶性药物的新型载体,使得越来越多的难溶性药物应用到临床中,本文所建立的分析方法已应用到体内研究,随着后期的深入研究,该方法将应用到更多的白蛋白类制剂检测中。在实验过程中发现,采用平衡透析法时,一般可选择37℃或4℃作为平衡温度。由于SN-38在37℃下平衡透析时不稳定,故选择4℃为平衡温度[23];另外分别考察了平衡透析时间12、24、36 h,结果发现SN-38在透析12 h后透析不完全,药物浓度并未达到分布平衡,而透析24 h后透析完全。故选择4℃下透析24 h作为最终平衡透析条件。
SN-38是一种高强度的蛋白结合药物,且恒定的血浆蛋白结合率会使发挥药效的游离型药物浓度相对稳定,当游离型药物浓度因为组织分布而下降时,结合型药物会与血浆蛋白解离并补充到组织中,使其与游离型药物保持动态平衡,从而保证药效能持续发挥作用[24-25]。本实验采用LC-MS/MS法及平衡透析结合LC-MS/MS法分别测定大鼠血浆中总SN-38和T侧、F侧SN-38的浓度,根据计算可知SN-38的血浆蛋白结合率大于90%,该结果与其他文献报道的结果吻合[7];同时绘制了SN-38总药物浓度和游离药物浓度的药物浓度-时间曲线,比仅测定总SN-38血药浓度具有更重要的意义。该方法为药物游离浓度的测定提供了一种可能性,后期可协助临床进行个体化给药,为提高疗效和减少药物不良反应提供可靠的参考[26]。

