聚苯乙烯微塑料及噻虫胺胁迫对玉米种子萌发影响
张铮钰, 周 杨, 包菲菲, 张红艳
(中国农业大学 理学院 北京 100193)
塑料制品具有耐磨、耐腐蚀、绝缘及价格低廉等优点,在包装、农牧、化工、交通等领域得到广泛应用[1-3]。截至2020 年,全球每年生产的塑料约有3.5 亿吨,其中约80%最终被填埋或遗弃在自然环境中,导致塑料在自然界中大量积累[3]。经过一系列物理、化学和生物过程,如机械碰撞、太阳辐射、微生物降解等,塑料可被分解为微塑料 (microplastics, MPs) 或纳米塑料 (nanoplastics,NPs)[4-6]。微塑料通常指粒径小于5 mm 的塑料颗粒[7]。在农业生产过程,微塑料能够通过污泥回田、有机肥使用、农膜残留、大气沉降等多种途径进入农业中,从而对土壤-植物系统产生负面影响[8-10]。
目前,有关微塑料对植物生理影响的研究主要集中于水生植物,如微藻Chlamydomonas reinhardtii、小球藻Chlorella vulgaris以及紫萍Lemna minor等[11-13]。
已有研究者报道了微塑料对陆地植物生长的影响[14]。Bosker 等研究发现,微塑料能够在陆生维管植物独行菜Lepidium sativum吸胀阶段积累在种皮薄膜处,并随发芽过程转移至胚根以及胚芽上,同时微塑料可在种皮气孔中形成物理屏障,阻碍种子发芽[15]。此外,已有研究表明,聚苯乙烯微塑料 (polystyrene microplastics, PS-MPs) 可诱导洋葱Allium cepa、蚕豆Vicia faba、番茄Lycopersicon esculentumL.和玉米Zea maysL.的细胞毒性、遗传毒性和氧化损伤,不利于植物生长[16-18]。
前人研究发现,微塑料对作物的生长产生的负面影响,可能是通过干扰土壤水分状况、造成种子物理堵塞以及干扰种子萌发关键酶的活性等方式实现的,并且微塑料粒径、形状、种类的变化均会影响种子萌发[19-21]。
微塑料因具有体积小、比表面积大、疏水性强等特点,还可作为载体吸附/解吸附土壤中的农药,增加其在环境中的迁移能力和相应的环境风险。已有研究证明,微塑料可以吸附多种有机污染物 (如多氯联苯、抗生素、毒氟磷等),导致土壤中的脲酶活性降低、微生物种类减少,并使有机污染物在蚯蚓等非靶标生物体内富集[22-25]。但目前的研究主要集中在微塑料和农药、抗生素等有机污染物的联合暴露对藻类、浮萍等水生植物的影响,关于其对于高等植物的影响尚不明确[26-28]。
噻虫胺 (clothianidin,CLO) 是目前使用最广泛的新烟碱类杀虫剂——噻虫嗪的代谢物,也是常用的杀虫剂之一。噻虫胺可加工成种子处理剂、颗粒剂和悬浮剂等多种剂型,用于玉米、水稻、甘蔗等多种作物上蓟马、稻飞虱、蚜虫、蛴螬和蓟马等多种地上、地下害虫的防治[29-32]。
鉴于噻虫胺常用作玉米种子处理剂,而塑料制品往往通过填埋手段进行处理,在土壤中难以降解,因此研究噻虫胺和微塑料对于玉米种子萌发的影响具有重要意义[9,33]。本研究选择玉米作为供试植物,以噻虫胺和PS-MPs 为研究对象,探究了噻虫胺和PS-MPs 单一及联合暴露对玉米种子萌发的生态毒理效应。
1 材料与方法
1.1 试验材料与仪器
玉米种子,由中国农业大学国家玉米改良中心提供;98.5%噻虫胺 (clothianidin) 原药;PS-MPs悬浮液 (粒径0.5、5 和50 μm,江苏智川科技公司)。SHIMADZU LC-MS/MS 8045 高效液相色谱-三重四极杆串联质谱联用仪,配电喷雾 (ESI) 离子源(日本岛津有限公司);QL-861 型涡旋仪 (江苏海门其林贝尔仪器制造有限公司);RJ-TDL-40B 低速台式大容量离心机 (无锡市瑞江分析仪器有限公司);AL204 型万分之一天平 (上海梅特勒-托利多仪器有限公司); JY2002 型天平 (上海精密科学仪器有限公司);0.22 µm 聚四氟乙烯 (PTFE) 有机滤膜 (北京锐锋同创分析仪器有限公司)。
1.2 试验方法
选取大小均一、颗粒饱满完整的玉米种子,在体积分数为0.5% 的过氧化氢溶液中浸泡清洗15 min,用去离子水反复冲洗3 次,备用。
1.2.1 单一PS-MPs 暴露 选用3 种粒径 (0.5 、5 和50 μm) 的PS-MPs 供试,质量浓度分别设置为10 和100 mg/L,以模拟在环境中PS-MPs低水平和高水平暴露对玉米种子的急性毒性[17,34];同时设置不添加PS-MPs 的纯净水作为对照组 (CK)。均重复5 次。
1.2.2 单一噻虫胺暴露 噻虫胺作为玉米种子处理剂时,其有效成分剂量可达1000~2000 mg/kg种子。本研究使用的种子约20 g/100 粒,每只烧杯用水量15 mL,使用20 粒种子进行试验,因此选择10、100 和200 mg/L 的噻虫胺进行试验,以模拟种子发芽时暴露在环境中的低水平和高水平噻虫胺的质量浓度[35]。以纯净水溶解噻虫胺原药,配制成质量浓度为10、100 和200 mg/L 的处理液,同时设置不添加噻虫胺的纯净水作为对照,均重复5 次。
1.2.3 联合暴露 根据单一暴露试验结果,选取粒径50 μm、质量浓度100 mg/L 的PS-MPs 与200 mg/L 噻虫胺的混合溶液进行联合暴露,同时设置对应的单一PS-MPs 暴露、单一噻虫胺暴露以及纯净水作为对照组,均重复5 次。
1.3 理化指标测定
选用500 mL 烧杯为培养器皿,每只烧杯中加入15 mL 处理液,放置20 粒玉米种子,并用铝箔纸覆盖烧杯口以减缓水分蒸发。将烧杯置于温室中培养,进行为期4 d 的萌发试验。温室的条件为恒温25 ℃、光照16 h/黑暗8 h。从第2 天开始记录种子萌发率,培养4 d 后测定根长、芽长等理化指标。
根据公式 (1)~(4) 分别计算萌发率 (germination rate, GR)、发芽势 (germination energy, GE)、发芽指数 (germination index, GI) 以及活力指数(vigor index, VI)。
式中:a表示发芽试验结束时发芽种子的数量,n表示供测种子总数,G3表示在3 d 时的萌发率,Gt表示在td 时的萌发率,Dt表示相对应的萌发天数,S为发芽种子芽长,cm;R为发芽种子根长,cm。
1.4 联合暴露后玉米种子中噻虫胺浓度测定
联合暴露4 d 后,使用纯净水将玉米种子清洗3 次,以去除其表面残留的噻虫胺,之后将种子匀浆。称取0.5 g 匀浆后的样品,加入5 mL 提取液 (V(甲醇) :V(0.1%甲酸水溶液) = 80 : 20) 振荡涡旋提取5 min,于3800 r/min 下离心5 min,取上清液过0.22 μm 有机滤膜,待测。
液相色谱条件:Athena C18-WP 液相色谱柱(2.1 mm × 50 mm,3.0 µm);进样量1 µL;流速0.3 mL/min;流动相为V(甲醇) :V(0.1%甲酸水溶液) = 80 : 20 混合溶液;运行时间 2 min;柱温 40 ℃。
质谱条件:电喷雾离子源;正离子扫描模式;离子源温度 300 ℃;干燥气流速 10 L/min;雾化气压力241 kPa;多反应监测模式 (MRM)。噻虫胺的质谱检测参数见表1。
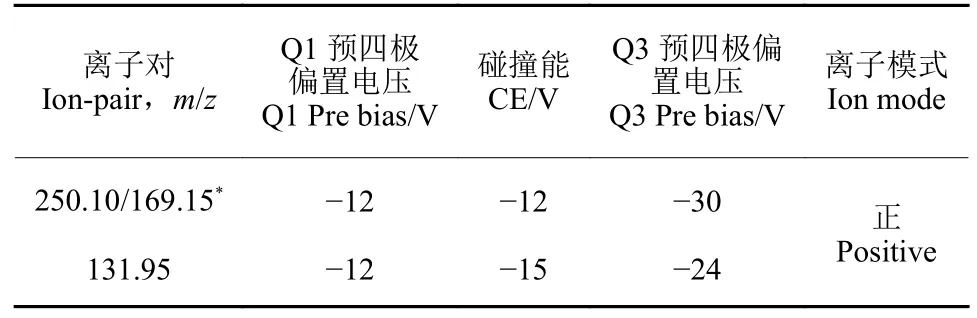
表1 噻虫胺的质谱检测参数Table 1 MS parameters for clothianidin analysis
1.5 数据统计与分析
采用Origin 2022 软件进行结果的处理分析、图表绘制以及显著性差异分析 (Tukey 检验, 统计显著性为p< 0.05)。根长及芽长数据以平均值 ±标准差 (SD) 值呈现。
2 结果与分析
2.1 单一暴露及联合暴露对玉米种子萌发的影响
萌发率是衡量不同环境中种子发芽能力的主要指标;发芽势表明种子萌发速率快慢;发芽指数是对种子萌发率指标的细化和深化,突出种子的活力特征;活力指数是种子发芽速率和生长量的综合反映,反映种子活力的指标。本研究从种子萌发率、发芽势、发芽指数和活力指数4 个指标分析了单一PS-MPs 暴露、单一噻虫胺暴露以及二者联合暴露对玉米种子萌发特性的影响。
2.1.1 单一PS-MPs 暴露对玉米种子萌发的影响
使用粒径分别为0.5、5 和50 μm 的PS-MPs 在低浓度 (10 mg/L) 和高浓度 (100 mg/L) 水平下对玉米种子进行96 h 暴露后,其对玉米种子萌发特性的影响见图1。从萌发率 (图1a) 看,对照组(CK 处理组) 的平均萌发率最高 (94%),而暴露于100 mg/L、粒径为50 μm 的PS-MPs 的种子萌发率最低,仅为72%,这表明PS-MPs 对玉米种子的萌发具有明显的抑制作用。此外,随着PS-MPs粒径的增大,暴露于高浓度PS-MPs 的玉米种子萌发率呈逐渐下降的趋势。进一步观察发芽势发现,CK 组的种子发芽势最大 (43%),而暴露于PS-MPs 的玉米种子发芽势较小 (图1b)。统计结果表明,在PS-MPs 不同粒径和浓度水平下,PS-MPs暴露与对照组之间存在显著差异 (p< 0.05),说明PS-MPs 对玉米种子的萌发速率产生了一定的影响。然而,PS-MPs 粒径和浓度的变化对玉米种子的发芽势影响并不显著。从玉米种子发芽指数和活力指数看,暴露于高浓度 (100 mg/L)、大粒径(50 μm) PS-MPs 的玉米种子发芽指数 (5.03) 和活力指数 (7.10) 最低 (图1c 和图1d)。这表明PSMPs 对玉米种子的活力产生了显著的抑制作用。此外,随着PS-MPs 粒径的增大,玉米种子的活力指数呈逐渐降低的趋势,尤其是在高浓度PSMPs 处理下,PS-MPs 对玉米种子活力的抑制作用更为强烈。

图1 聚苯乙烯微塑料 (PS-MPs) 对玉米种子萌发的影响 (96 h)Fig.1 Effect of PS-MPs on the seed germination of maize (96 h)
综上所述,PS-MPs 暴露可显著降低玉米种子的萌发率、发芽势和活力指数。此外,PS-MPs 的粒径和浓度变化也可对这些萌发特性产生一定的影响。
2.1.2 单一噻虫胺暴露对玉米种子萌发的影响 测定结果 (图2) 表明,经过10、100 和200 mg/L 噻虫胺暴露后,玉米种子的萌发率均有所降低,其中暴露于100 和200 mg/L 噻虫胺的玉米种子萌发率最低 (74%),而低浓度 (10 mg/L) 噻虫胺对玉米种子萌发率无较大影响 (图2a)。在发芽势方面,低浓度噻虫胺处理对发芽势影响不显著,而高浓度噻虫胺则明显抑制种子发芽势 (图2b)。进一步观察种子活力发现,高浓度噻虫胺会降低玉米种子的活力。在暴露于200 mg/L 噻虫胺时,种子发芽指数和活力指数最小,分别为6.83 和8.92,而对照组的种子发芽指数最大,为10.10 和23.27 (图2c和图2d),这表明高浓度噻虫胺对玉米种子的活力有显著的抑制作用。在3 种浓度水平下,低浓度噻虫胺对玉米种子活力无显著影响,高浓度噻虫胺会导致种子活力降低。100 和200 mg/L 噻虫胺对种子活力的抑制作用差异较小。
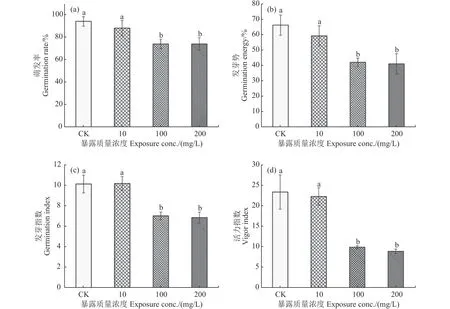
图2 噻虫胺对玉米种子萌发的影响Fig.2 Effect of clothianidin on the seed germination of maize
综上所述,不同浓度的噻虫胺处理对玉米种子的萌发率、发芽势、发芽指数和活力指数均产生了影响。低浓度噻虫胺对种子萌发率和发芽势的影响相对较小,但高浓度噻虫胺处理导致了显著的抑制效果。这些结果表明高浓度噻虫胺对玉米种子生长和发育的不利影响。
2.1.3 噻虫胺及PS-MPs 联合暴露对玉米种子萌发的影响 经过粒径50 μm、质量浓度100 mg/L PS-MPs 暴露,200 mg/L 噻虫胺暴露以及粒径50 μm、浓度100 mg/L PS-MPs 和 200 mg/L 噻虫胺联合暴露后,本研究对暴露后玉米种子的萌发特征进行分析。
由图3a 看出:处理96 h 后,对照组 (CK) 的平均萌发率最高,达到98%;而暴露于200 mg/L噻虫胺的种子萌发率最低,仅为70%。单一高浓度PS-MPs (100 mg/L) 和噻虫胺 (200 mg/L)以及联合暴露,对种子的萌发均具有显著抑制作用。此外,相较于单一噻虫胺,噻虫胺与PS-MPs 联合暴露显著降低了噻虫胺对种子萌发的抑制效果,表明PS-MPs 可能缓解了噻虫胺对种子萌发的抑制作用。
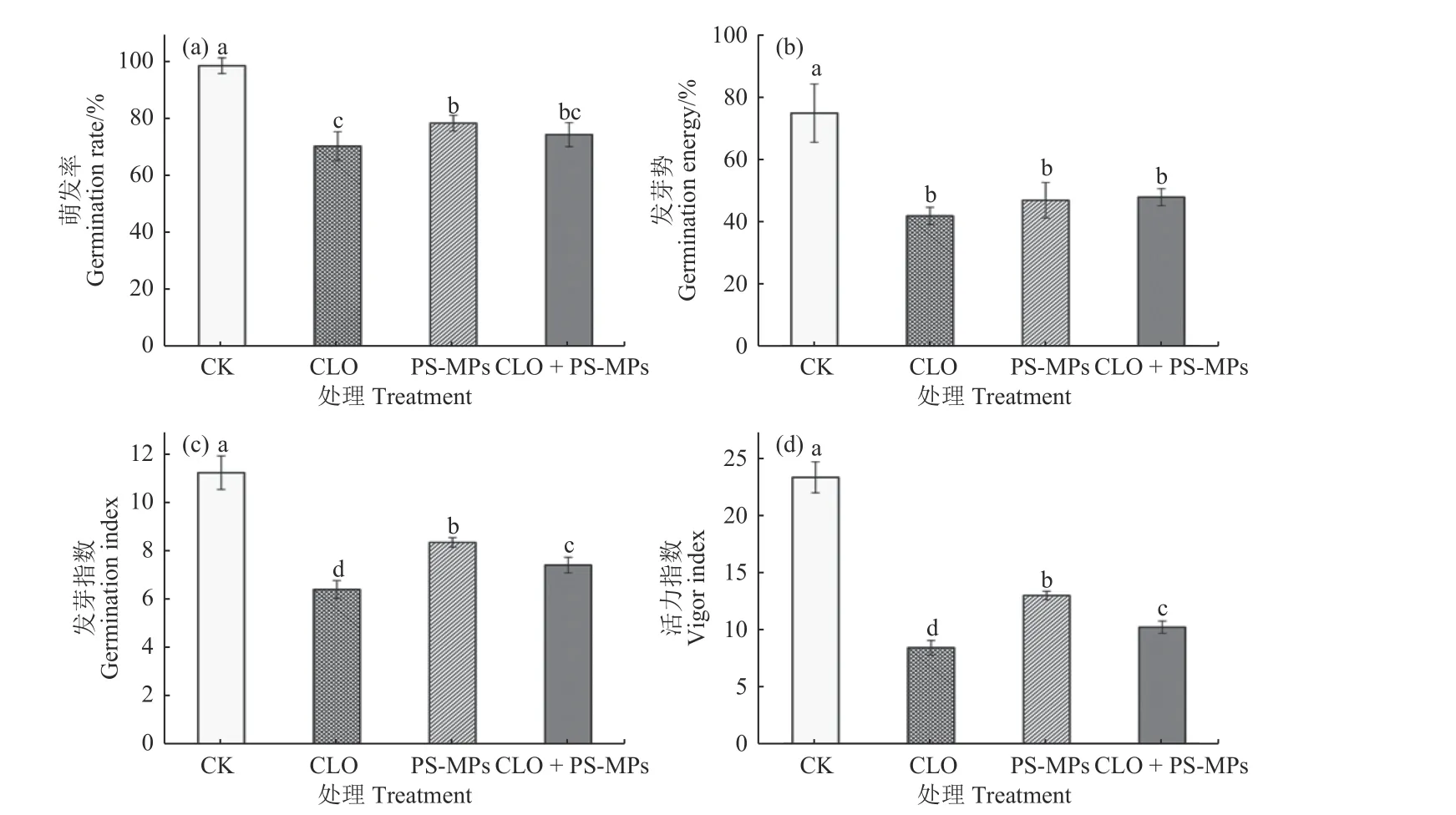
图3 噻虫胺及聚苯乙烯微塑料联合处理对玉米种子萌发的影响 (96 h)Fig.3 Effect of the combined treatment of clothianidin and PS-MPs on the seed germination of maize (96 h)
由图3b 看出:对照组的发芽势最大(75%)。与对照组相比,无论是噻虫胺单一暴露还是噻虫胺与PS-MPs 联合暴露,发芽势均显著降低,表明3 种处理对玉米种子的萌发速率均存在显著抑制作用。然而,各处理组之间的发芽势并无显著差异。
进一步观察种子活力发现,对照组的种子发芽指数和活力指数最大,分别为11.20 和23.35 (图3c和图3d)。无论是噻虫胺与PS-MPs 单一暴露还是联合暴露,其对种子活力均存在显著抑制作用。其中,暴露于200 mg/L 噻虫胺的种子发芽指数和活力指数最小,为6.40 和8.45,说明噻虫胺单一暴露对种子活力的抑制作用最强。相较于PS-MPs单一暴露,噻虫胺与PS-MPs 联合暴露组的种子发芽指数和活力指数降低。而相较于噻虫胺单一暴露,PS-MPs 联合暴露缓解了噻虫胺对种子活力的影响。
综上所述,PS-MPs 和高浓度噻虫胺对玉米种子的萌发特性均具有显著抑制作用,高浓度噻虫胺与PS-MPs 联合暴露对种子萌发和活力的抑制效果略有减弱,表明PS-MPs 可能在缓解噻虫胺对种子萌发特性的抑制过程中发挥了一定的作用。
2.2 单一处理及联合处理对玉米萌发种子的根长及芽长影响
2.2.1 单一PS-MPs 暴露对萌发种子根长及芽长影响 测定结果 (图4,表2) 表明:对照组的种子根长和芽长最大,分别为2.23 和1.24 cm;与对照组相比,暴露于PS-MPs 的玉米种子的根长和芽长均有所下降,说明PS-MPs 显著抑制了种子根和芽的生长。在3 种粒径水平下,较低浓度PSMPs、高浓度PS-MPs 对种子胚根生长表现出更强的抑制作用。然而,对于胚芽而言,在3 种粒径水平和两种浓度水平下,PS-MPs 的粒径和浓度变化对玉米种子胚芽的影响较小。

图4 聚苯乙烯微塑料 (PS-MPs) 对玉米根长及芽长的影响 (96 h)Fig.4 Effects of PS-MPs on root and sprout length of maize (96 h)
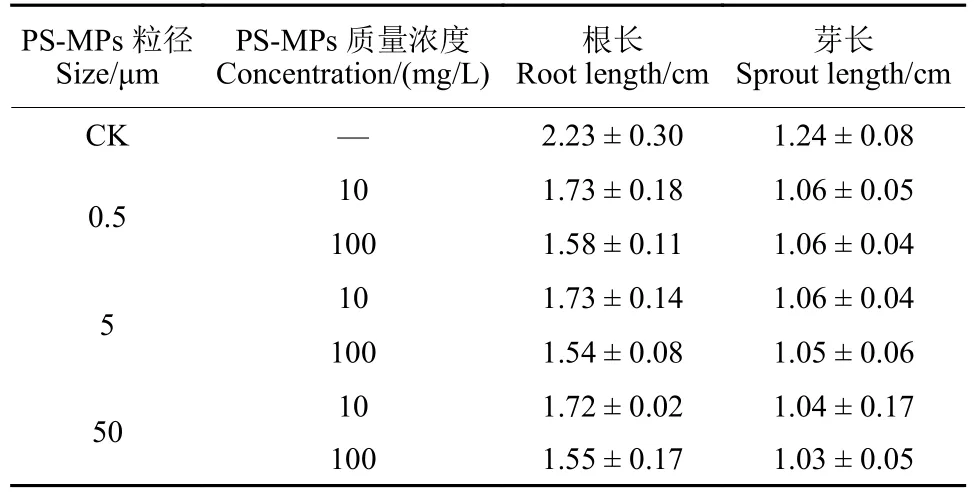
表2 暴露于聚苯乙烯微塑料 (PS-MPs) 的玉米种子根长及芽长 (96 h)Table 2 Root length and sprout length of maize seeds exposed to PS-MPs (96 h)
综上所述,单一PS-MPs 暴露对玉米种子的根长和芽长产生了抑制效应。PS-MPs 显著降低了种子的根长和芽长,尤其是高浓度PS-MPs 对种子根系的生长抑制效果更强。然而,在胚芽的生长方面,PS-MPs 的粒径和浓度变化对其影响较小。
2.2.2 单一噻虫胺暴露对萌发种子根长及芽长影响 结果 (图5,表3)表明:对照组种子根长及芽长最大,分别为2.21 和1.31 cm。在3 种浓度水平下,暴露于高浓度噻虫胺的种子根长和芽长显著降低,但100 和200 mg/L 处理间对种子胚根和胚芽的抑制作用差异较小。

图5 噻虫胺对玉米根长及芽长的影响 (96 h)Fig.5 Effects of clothianidin on root and sprout length of maize (96 h)
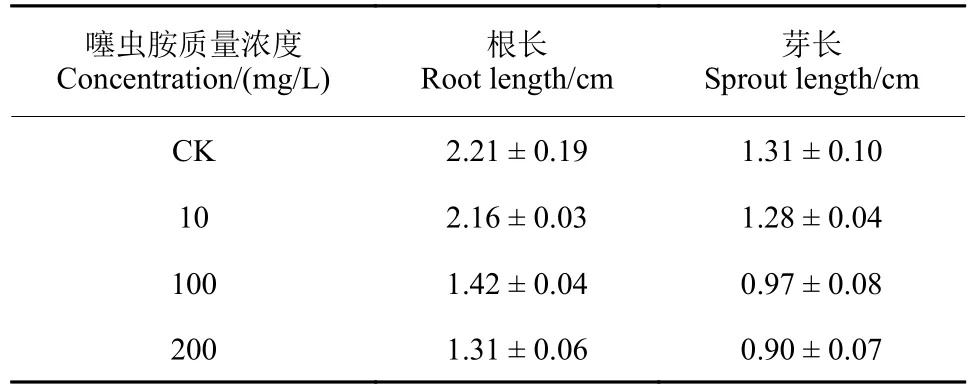
表3 暴露于噻虫胺的玉米种子根长及芽长 (96 h)Table 3 Root length and sprout length of maize seeds exposed to clothianidin (96 h)
2.2.3 噻虫胺及PS-MPs 联合暴露对萌发种子根长及芽长影响 结果 (图6, 表4)表明:对照组种子根长及芽长最大。与对照组相比,单一PS-MPs、单一噻虫胺和噻虫胺 + PS-MPs 联合暴露均表现出对萌发种子生长的抑制作用。相较于单一PS-MPs,噻虫胺 + PS-MPs 联合暴露对玉米种子的胚根和胚芽生长的抑制作用更为显著。此外,与噻虫胺单一暴露组相比,噻虫胺 + PS-MPs 联合暴露组的萌发种子根长和芽长较长,表明PS-MPs降低了噻虫胺对萌发种子生长的抑制作用。

图6 噻虫胺及聚苯乙烯微塑料联合处理对玉米根长及芽长的影响Fig.6 Effects of the combined treatment of PS-MPs and clothianidin on root and sprout length of maize
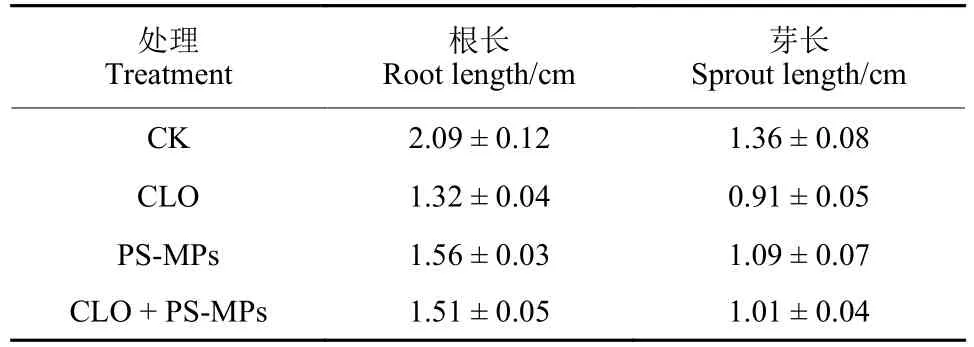
表4 暴露于噻虫胺、PS-MPs 及噻虫胺 + PS-MPs 的玉米种子根长及芽长Table 4 Root length and sprout length of maize seeds exposed to clothianidin, PS-MPs and clothianidin + PS-MPs
2.3 联合暴露对种子中噻虫胺含量的影响
在进行96 h 暴露后,采用1.4 节方法对联合暴露后玉米种子中噻虫胺的含量测定结果见图7。200 mg/L 噻虫胺水溶液单一暴露组玉米种子中噻虫胺的含量为41.5 mg/kg,而联合暴露组中噻虫胺的含量降低至13.7 mg/kg,表明PS-MPs 可能吸附了水溶液中的噻虫胺,从而降低了玉米种子对噻虫胺的生物利用度。

图7 噻虫胺及聚苯乙烯微塑料联合处理对玉米种子中噻虫胺含量的影响Fig.7 Effects of the combined pollution of PS-MPs and clothianidin on the clothianidin content in maize
3 结论与讨论
本研究表明,聚苯乙烯微塑料(PS-MPs)对于玉米种子萌发具有抑制作用。这可能是由于PS-MPs能够吸附在玉米种子种皮或根部细胞壁孔隙,造成物理堵塞,扰乱种子或根系正常的水分和营养吸收与传导[34]。在0.5、5 和50 μm 3 种粒径及10 和100 mg/L 两个质量浓度下,PS-MPs 的粒径和浓度变化对于玉米种子萌发影响不显著。然而,前人研究发现,PS-MPs 对水生植物Spirodela polyrhiza和Lemna minor的叶片生长、鲜重以及叶绿素含量等指标无显著影响,也有研究表明,PS-MPs 显著降低了蚕豆和洋葱的根系生长,以及沉水大型植物Myriophyllum spicatim的主要茎长[12,16,36]。这可能与植物对微塑料的耐受性以及植物接触微塑料的器官有关。本研究中,相较于对照组,暴露于低浓度噻虫胺(10 mg/L) 时对玉米种子的萌发以及幼苗根长及芽长的影响较小,而暴露于高浓度噻虫胺 (100 和200 mg/L) 时,玉米种子萌发受到显著抑制。在种子处理剂中添加成膜剂等成分,使用噻虫胺对种子进行包衣,噻虫胺在土壤中遇水膨胀透气而不被溶解,在环境中缓慢释放[37]。此外,种子处理剂在使用时用水量至关重要。如果用水不当,易造成种衣剂成膜不均匀、脱落等,导致高浓度的有效成分直接与种子接触,从而对种子正常生长以及病虫害防效产生负面影响[38-40]。由于本研究进行的是水培试验,玉米种子直接暴露于高浓度噻虫胺环境下,虽然无法真实模拟种子在实际土壤环境中的情况,但研究结果仍然可以为种衣剂的安全使用提供参考数据。
Hao 等[26]发现,PS-MPs 可以吸附敌草隆,并可显著减轻敌草隆对硅藻的细胞内损伤。Zhang等[27]研究了纳米聚苯乙烯与草甘膦联合暴露对铜锈微囊藻Microcystis aeruginosa的毒性影响,发现纳米聚苯乙烯对草甘膦具有较强的吸附能力,从而减少藻类对草甘膦的吸收,显著减轻了草甘膦对藻类生长的抑制作用。Mao 等[28]发现,PSMPs 能缓解环丙沙星对Spirodela polyrhiza和Lemna minor两种浮水生植物的毒性。也有研究表明,PS-MPs 能够导致诺氟沙星和磺胺嘧啶在菊花根、茎、叶等器官积累,影响菊花正常代谢,这可能与微塑料粒径和植物孔隙大小有关[41]。粒径小的微塑料更容易通过植物间隙进入植物体内,而吸附在微塑料上的抗生素、农药等有机污染物也随之进入植物体内,并在植物体内的积累;而粒径大的微塑料容易沉降,并且难以通过植物孔隙进入,从而使有机污染物不易在植物体内的积累。本研究结果表明,与单一噻虫胺暴露相比,PS-MPs 的存在降低了玉米种子中噻虫胺的含量,表明噻虫胺与PS-MPs 联合暴露对玉米种子的生长毒性减小,PS-MPs 通过吸附环境中的噻虫胺,可降低噻虫胺与玉米种子的接触浓度,从而减少玉米种子对噻虫胺的利用程度,减缓了噻虫胺对玉米种子的毒理效应。
本研究主要对单一PS-MPs、单一噻虫胺暴露以及噻虫胺与PS-MPs 联合暴露对玉米种子萌发的影响进行研究,未来研究需考虑PS-MPs 对种子萌发关键酶活性等方面的影响,以探究微塑料与植物毒性效应之间的内在机制。

